Эффективность оптико-электронной методики TruScreen в диагностике предраковых процессов шейки матки
- Аннотация
- Статья
- Ссылки


Рак шейки матки (РШМ) – распространенное заболевание во всем мире. В России ежегодная заболеваемость РШМ составляет 15,4 на 100 000 женщин. В 2009 г. зарегистрирован 14 351 новый случай РШМ (стандартизированный показатель на 100 000 женщин составил 11,2), от этого заболевания умерли 6454 женщины [1, 2]. РШМ является многостадийным заболеванием, развитие опухоли в доклиническом периоде длится годами, поэтому существуют возможности для дальнейшей верификации диагноза и применения эффективных методов лечения [3]. Кроме того, диагностировать ту или иную патологию шейки матки на ранних этапах позволяет цитологическое исследование [4, 5, 6].
Цервикальный скрининг – это система мероприятий, направленных на выявление и своевременное лечение предраковых изменений шейки матки. Традиционно используется окраска цитологического материала гематоксилин-эозином, однако чувствительность этого метода ограничена и, по данным разных авторов, составляет 50–60% [7]. Подчеркнем: цитологический метод исследования должен быть не только чувствительным, но и высокоспецифичным, поскольку женщина с положительными данными цитологического исследования переходит из разряда здоровых в группу больных.
Таким образом, эффективность скрининга РШМ зависит от чувствительности цитологического исследования, которая, по данным разных исследователей, составляет от 66 до 83% [6, 8]. В 70–90% случаев причиной ложноотрицательных цитологических ответов является плохой забор материала для цитологического исследования и лишь в 10–30% случаев – ошибочная интерпретация цитологических данных. Ложноположительные результаты, как правило, нивелируются проводимой кольпоскопией и прицельной биопсией. Более серьезной проблемой с точки зрения высокой настороженности врачей в отношении рака является предотвращение ложноотрицательных результатов.
Наиболее часто неинформативный материал получают при взятии мазков из цервикального канала, отсутствие в мазках клеток эндоцервикального эпителия отмечается в 8–18% случаев. Вследствие этого именно железистые виды рака и железисто-плоскоклеточные РШМ наиболее часто пропускаются при скрининге [7, 9]. Исследование мазков по Папаниколау, полученных традиционным методом сбора материала, показывает, что не все, а только от 6,5 до 18% взятых клеток наносятся на стекло. Кроме того, многие из этих клеток по причине плохого нанесения на стекло трудно или невозможно анализировать [10].
Нельзя не упомянуть и о том, что в отдаленных районах ряда регионов нашей страны цитологические лаборатории отсутствуют. Именно поэтому для скринингового обследования женщин требуются такие методы, которые бы являлись неинвазивными и позволяли получить результат в режиме реального времени. Этим требованиям соответствует портативный диагностичеcкий сканер TruScreen, зарегистрированный в Российской Федерации. Преимущество метода – в моментальном результате и высоких показателях чувствительности и специфичности (80–90%) [11, 12]. Однако в нашей стране прибор мало применяется, в этой связи отсутствует оценка клинической целесообразности его использования.
Оптико-электронный метод сканирования TruScreen позволяет идентифицировать наличие предраковых и раковых состояний тканей шейки матки в режиме реального времени при гинекологическом обследовании. Данная методика – одна из многообещающих, поскольку обеспечивает высокую точность и быстрый результат исследования. Оборудование состоит из ручного зонда и консоли сканера. Консоль сканера TruScreen снабжена микрокомпьютером с предустановленной программной экспертной системой оценки для анализа и обработки полученных от диагностического зонда данных об исследуемой ткани. Полученные с помощью ручного зонда результаты исследования сравниваются с интегрированной базой данных более 3000 пациенток с учетом всей широты географической и этнической подтвержденной гистологической картины. Для обследования цервикальных тканей используются низкоуровневые электрические и световые сигналы. Ответные сигналы измеряются, а экспертная компьютерная программа прибора их сравнивает с компьютерной базой данных, находящейся в памяти встроенного микрокомпьютера в основе портативного сканера. Тестирование проводится путем легких касаний зондом поверхности шейки матки в соответствии со специальным диагностическим паттерном (последовательность тест-точек).
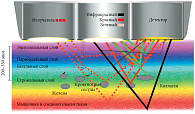
Ручной зонд сканера TruScreen оснащен электрооптическими биодатчиками для измерения свойств цервикальной ткани и использует для зондирования цервикальной ткани комбинацию светового излучения с длинами волн 525, 660 и 936 нм видимого и инфракрасного диапазонов. Устройство измеряет степень отражения и рефракции света, прошедшего через ткани шейки матки. Диапазон сканирования по глубине составляет от 200 до 350 мкм (рис. 1). Таким образом, исследованию подвергаются не только поверхностные эпителиальные клетки, но и изменения в базальном и стромальном слоях. Дополнительным типом измерения является параллельное определение электроемкостных свойств ткани непосредственно с помощью подачи биодатчиками ручного зонда электрических импульсов очень малой интенсивности (0,8 вольт каждые 100 микросекунд).
Оптические и электрические измерения повторяются с частотой 14 раз в секунду. Полученная от точек исследования информация обрабатывается микрокомпьютером, встроенным в консоль сканера, после чего происходят анализ, извлечение и оценка параметров наиболее измененного участка цервикальной ткани, которые и являются окончательным результатом теста. В течение последних 10 лет TruScreen был апробирован и изучен в исследованиях с участием более 5000 женщин в Австралии, Италии, Бразилии, Филиппинах, Китае, Великобритании и США. В мультицентровых исследованиях была показана высокая чувствительность сканера в определении предраковых изменений в сравнении с традиционным цитологическим обследованием. В отличие от последнего, сканер TruScreen позволяет не только исследовать поверхностные эпителиальные клетки, но и идентифицировать изменения в базальном и стромальном слоях, поскольку сигналы ручного зонда сканера проходят через ткани шейки матки [13, 14].
Цель исследования
Целью исследования является оценка клинической эффективности оптико-электронного сканирования путем применения сканера TruScreen для диагностики плоскоклеточных интраэпителиальных поражений шейки матки.
Материалы и методы исследования
В исследование были включены 56 пациенток с диагностированной патологией шейки матки в возрасте от 19 до 48 (35,5 ± 7,8) лет. Предварительное комплексное обследование шейки матки включало проведение кольпоскопического исследования с помощью кольпоскопа фирмы Leisegang, цитологического исследования мазков с экто- и эндоцервикса и ВПЧ-тестирование методами ПЦР для типирования вируса и гибридного захвата (Hybrid Capture 2, HC2) в целях оценки вирусной нагрузки, гистологического исследования биопсийного материала, взятого с использованием радиохирургического высокочастотного аппарата ФОТЕК Е141. После получения всех результатов проводилось диагностическое оптико-электронное сканирование шейки матки с помощью сканера TruScreen (Polartechnics ltd., Сидней, Австралия) с целью определения его чувствительности.
Оптико-электронное сканирование проводилось после гистологического подтверждения диспластического процесса шейки матки той или иной степени выраженности. Исследование проводилось путем легких касаний зондом поверхности шейки матки под контролем световой индикации. В зависимости от площади поражения сканировалось от 15 до 25 точек, в среднем – 21 точка. Продолжительность процедуры составляла 3–4 минуты. Результаты выдавались на бумажном носителе в двух вариантах: 1) abnormal – обнаружены патологические изменения ткани шейки матки, цервикальная интраэпителиальная неоплазия присутствует; 2) normal – цервикальная интраэпителиальная неоплазия отсутствует. Цитологические и гистологические диагнозы и результаты оптико-электронного сканирования сводились в таблицы. Точность диагностического метода определялась путем расчета чувствительности и прогностической ценности положительного и отрицательного результатов теста. Оценка характеристик основывается на сравнении результатов теста с результатом точного способа определения заболевания – референтным, или эталонным, методом. В исследовании референтным методом явилось морфологическое исследование ткани шейки матки, полученной в результате биопсии. Результаты гистологического исследования трактовались согласно классификации цервикальной интраэпителиальной неоплазии (CIN) и терминологической системе Бетесда.
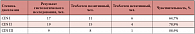
При гистологическом исследовании 56 цервикальных образцов было верифицировано сквамозное интраэпителиальное поражение (SIL) в 45 (80,3%) случаях: в 11 случаях обнаружена плоская кондилома, в 45 – CIN. При этом у 17 пациенток (37,8%) диагностирована CIN I, у 19 (42,2%) – CIN II и у 9 (20%) – CIN III степени. Результаты цитологического исследования интерпретировались с применением терминологии Бетесда и распределились следующим образом: интраэпителиальные поражения низкой степени тяжести (L-SIL) обнаружены в 23 случаях, интраэпителиальные поражения высокой степени тяжести (H-SIL) – в 14, еще у 5 пациенток цитологическая картина интерпретирована как «атипичные сквамозные клетки неопределенного значения» (ASCUS). В 6 случаях результаты цитологических мазков были отнесены к норме. В процессе диагностического оптико-электронного сканирования с помощью прибора TruScreen результат abnormal получен у 39, normal – у 17 пациенток. На основании анализа полученных данных чувствительность TruScreen в обнаружении сквамозных интраэпителиальных поражений (SIL) составила 86,7% для H-SIL и 65,3% для L-SIL (табл. 1). Таким образом, оптико-электронная технология продемонстрировала сопоставимую с цитологическим методом чувствительность в диагностике как цервикальных интраэпителиальных поражений в целом, так и поражений высокой степени тяжести в частности.
Оптико-электронная технология также продемонстрировала сопоставимую с гистологическим методом чувствительность в диагностике цервикальных интраэпителиальных поражений. Как видно из таблицы 2, чувствительность оптико-электронного метода тем выше, чем тяжелее поражение диспластического процесса. В данном исследовании также оценивались результаты расширенной кольпоскопии, включающей изучение эпителиальных и сосудистых тестов путем нанесения на слизистую оболочку шейки матки 3% раствора уксусной кислоты и 2% водного раствора Люголя (проба Шиллера) в сравнении с оптико-электронным сканированием. Чувствительность кольпоскопического метода, по данным разных авторов, составляет 45–65%, в нашем исследовании кольпоскопия продемонстрировала более высокую чувствительность по сравнению с TruScreen (табл. 3). Кольпоскопическая терминология, используемая в таблице 3, приведена согласно Международной классификации кольпоскопических терминов, одобренной в Рио-де-Жанейро в 2011 г.
Заключение
Таким образом, результаты проведенного исследования с использованием оптико-электронной технологии TruScreen продемонстрировали высокую чувствительность в диагностике цервикальных интраэпителиальных поражений, в основном высокой степени тяжести. Преимущество использования метода TruScreen по сравнению с цитологическим и кольпоскопическим методами заключается в способности оптико-электронного устройства получать быстрый и объективный результат в конце исследования. Применение сканера TruScreen в дополнении к цитологическому исследованию позволит повысить чувствительность цервикального скрининга.Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.