Эффективность тройной комбинации в терапии распространенной меланомы с мутацией BRAF V600. Разбор клинического случая пациента с метастатической меланомой
- Аннотация
- Статья
- Ссылки
- English



В многоцентровое двойное слепое плацебо-контролируемое рандомизированное исследование III фазы IMspire150, которое проводилось в 108 академических и общественных больницах 20 стран, были включены пациенты в возрасте 18 лет и старше с ранее не леченной нерезектабельной меланомой стадии IIIc или IV и статусом 0 или 1 по шкале Восточной кооперативной онкологической группы. Пациенты были рандомизированы в соотношении 1:1 для получения в 28-дневных циклах либо атезолизумаба (840 мг внутривенно в первый и 15-й дни), либо плацебо и вемурафениба (960 мг или 720 мг два раза в день перорально) и кобиметиниба (60 мг один раз в день перорально). Атезолизумаб и плацебо добавлялись к схемам лечения начиная со второго цикла. Общая выживаемость (ОВ) была проанализирована в начавшей лечение популяции, а безопасность – у всех пациентов, получивших хотя бы одну дозу исследуемого препарата в соответствии с фактически полученным лечением. Первичной конечной точкой была выживаемость без прогрессирования (ВБП).
В исследовании приняли участие 514 пациентов (средний возраст – 54 года; 299 (58%) мужчин и 215 (42%) женщин). На момент окончания сбора данных умерли 273 пациента (126 в группе атезолизумаба и 147 в контрольной группе).
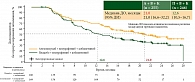
При анализе эффективности медиана ВБП составила 15,1 месяца (95% доверительный интервал (ДИ) 1,4–18,4) в группе тройной терапии (атезолизумаб + вемурафениб + кобиметиниб) и 10,6 месяца (9,3–12,7) в группе двойной комбинации (вемурафениб + кобиметиниб) с более выраженным эффектом в субпопуляции пациентов с мутацией V600E, наиболее часто встречающейся при меланоме (рис. 1). Также при применении тройной комбинации было показано увеличение длительности ответа практически вдвое по сравнению с двойной комбинацией – 21,0 месяца (95% ДИ 16,6–32,2) в группе тройной терапии и 12,6 месяца (10,5–16,7) в контрольной группе (рис. 2) [1, 2].
Помимо увеличения выживаемости без прогрессирования и длительности ответа в группе тройной комбинации по сравнению с двойной, первичный анализ III фазы IMspire150 также показал существенный тренд на улучшение общей выживаемости при применении атезолизумаба, вемурафениба и кобиметиниба в первой линии терапии. При медиане наблюдения 18,9 месяца (IQR 10,4–23,8) при первичном анализе данные об общей выживаемости были неполными. Однако недавно были опубликованы результаты второго промежуточного анализа общей выживаемости.
Медиана периода наблюдения составила 29,1 месяца для группы атезолизумаба по сравнению с 22,8 месяца для контрольной группы, а медиана ОВ составила 39,0 месяца (95% ДИ 29,9 – не достигнуто) против 25,8 месяца (22,0–34,6) соответственно (отношение рисков (ОР) 0,84 (95% ДИ 0,66–1,06)).
Интересно отметить, что при подгрупповом анализе общей выживаемости наилучший результат с применением тройной комбинации по сравнению с двойной был достигнут в группе пациентов с мутацией BRAF V600E, наиболее часто встречающейся при меланоме. Медиана ОВ составила 42,2 месяца (30,4 – не достигнуто) по сравнению с 25,1 месяца (19,3–31,6), ОР 0,76 (95% ДИ 0,58–1,00) (рис. 3).
Таким образом, показатель медианы общей выживаемости в данной группе пациентов с применением тройной комбинации более чем на 17 месяцев превысил аналогичный при применении лишь двойной терапии (вемурафениб + кобиметиниб) [2].
По параметрам безопасности между профилями тройной и двойной комбинаций существенных различий выявлено не было. Нежелательные явления (НЯ), приведшие к досрочному прекращению исследуемой терапии по причине токсичности, встречались в 16% случаев в группе тройной и в 15% случаев в группе двойной комбинации.
Использование тройной комбинации (атезолизумаб + вемурафениб + кобиметиниб) в первой линии терапии распространенной меланомы с положительной мутацией BRAF V600 представлено в данном клиническом случае.
Из анамнеза заболевания: пациент Х., 42 года, с лета 2019 г. отмечает появление новообразования на фоне пигментного невуса, рост опухоли наблюдался на протяжении трех месяцев. За медицинской помощью не обращался. Только после появления изъязвления опухоли обратился к врачу-онкологу.
На первичном осмотре: на коже боковой стенки грудной клетки слева пигментная опухоль до 1 см с изъязвлением, сателлитов нет. Цитологическое исследование показало наличие меланомы. На рентгенографии органов грудной клетки патологии нет; на ультразвуковом исследовании периферических лимфоузлов и органов брюшной полости метастазы не выявлены. Уровень лактатдегидрогеназы (ЛДГ) в крови – норма.
Выставлен диагноз: меланома кожи грудной клетки T3bN0M0, стадия IIB. Проведено широкое иссечение меланомы кожи грудной клетки без биопсии сигнальных лимфатических узлов. Гистология: меланома кожи с изъязвлением, IV уровень инвазии по Кларку, толщина опухоли по Бреслоу – 2,9 мм. Линия резекции свободна от опухолевого роста.
Проводилась иммунотерапия интерфероном α-2b 3–5 млн МЕ подкожно три раза в неделю (через день). Лечение протекало без осложнений. По состоянию на 20.02.2020 на позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ/КТ), признаков прогрессирования заболевания не выявлено.
Пациент находился под динамическим наблюдением. В апреле 2021 г. проведено исследование методом прямого секвенирования по Сэнгеру на генетическом анализаторе 3500x: в 15-м экзоне гена BRAF обнаружена активирующая мутация V600E (c.1799T > A), что определяет чувствительность к терапии BRAF-ингибиторами.
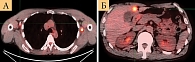
Контрольное обследование ПЭТ/КТ от 07.04.2021 показало: периферические лимфоузлы справа не увеличены, подмышечный лимфоузел 1-го уровня кальцинирован, менее активный в динамике – до 17 × 8 мм, SUVmax 2,9 (ранее 18 × 10 мм, SUVmax 6); выше 2-го уровня единичные мелкие кальцинированные лимфоузлы с фоновой активностью (ранее 6 мм, SUVmax 2,3); слева – увеличился, стал активным аксиллярный лимфоузел до 15 × 18,5 мм, SUVmax 9,2 (ранее 6,5 × 10 мм, метаболически неактивный), мелкие аксиллярные лимфоузлы 2-го уровня до 4,5 × 6 мм, фоновые. Клиническая картина без ухудшения, жалоб не предъявляет. Состояние не расценено как прогрессирование заболевания.
Наблюдение продолжено до июня 2022 г., когда отмечалось прогрессирование, появились жалобы на слабость. Результаты ПЭТ/КТ от 17.06.2022 показали прогрессирование заболевания и появление множественных метастазов в мягкие ткани, легкие, печень, кости, лимфатические узлы. ЛДГ от 28.08.2022 – 241,36 ед. – норма (рис. 4).
С 01.08.2022 проводилась первая линия лечения – комбинированная иммунотаргетная терапия ингибиторами BRAF/MEK + анти-PD-1/PD-L1-ингибитором: атезолизумаб 840 мг внутривенно один раз в первый и 15-й дни, вемурафениб 720 мг два раза в сутки (1440 мг/сут) ежедневно, кобиметиниб 60 мг/сут 21 день, затем перерыв семь дней. Пациент показал удовлетворительную переносимость лечения, НЯ были легкой степени. В первые шесть-семь недель приема отмечались кожная токсичность 2-й степени, артралгия 1-й степени. Редукция дозы не проводилась, назначения не отменялись.
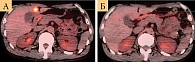
Через три месяца на фоне терапии тройной комбинацией на ПЭТ/КТ выявлен регресс очагов в печени и легких (рис. 5).
Положительная динамика заболевания наблюдается по настоящее время (таблица).
По состоянию на апрель 2023 г. отмечалось развитие частичного ответа: уменьшение очагов на 54%, регресс очага в левой подмышечной области, печени, мягких тканях. Продолжена первая линия лечения: атезолизумаб 840 мг внутривенно один раз в первый и 15-й дни, вемурафениб 720 мг два раза в сутки (1440 мг/сут) ежедневно, кобиметиниб 60 мг/сут 21 день, семь дней перерыв. Осложнений не выявлено.
Выводы
Окончательные результаты по показателям ОВ тройной комбинации по сравнению с двойной в исследовании IMspire150 еще ожидаются, но уже сейчас можно сделать вывод о впечатляющей клинической эффективности сочетанного применения иммунотерапевтического компонента атезолизумаб (PD-L1-ингибитор) в комбинации с таргетной BRAF+MEK терапией препаратами вемурафениб + кобиметиниб.
A.V. Sultanbaev, PhD, K.V. Menshikov, PhD, Sh.I. Musin, PhD
Ufa Clinical Oncology Center
Contact person: Alexander V. Sultanbaev, rkodrb@yandex.ru
Skin melanoma is one of the most aggressive malignant forms of neoplasms, difficult to treat, has a high potential for growth and dissemination, as well as regional and widespread metastasis. Over the past few years, the issues of efficacy and safety of a number of drugs used to treat patients both in mono mode and in combination therapy regimens have been actively discussed. One notable study on the efficacy of a new drug combination is IMspire150. The use of a triple combination (atezolizumab, vemurafenib, cobimetinib) in the first line of therapy for advanced melanoma with a positive BRAF V600 mutation is presented in this clinical case.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.