Зуд и другие проявления кожной токсичности у пациентов с меланомой на фоне терапии ингибиторами BRAF и MEK: обзор клинических рекомендаций по тактике ведения
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Структура нежелательных явлений на фоне комбинированной терапии вемурафенибом и кобиметинибом, абс. (%) [3]](/upload/resize_cache/iblock/efa/195_350_1/Michenko2.jpg)

Введение
Последние десятилетия ознаменовались значительным прорывом в области внедрения новых эффективных методов лечения меланомы, что позволило увеличить продолжительность жизни пациентов. Изучены сигнальные пути, участвующие в развитии меланомы, и созданы таргетные препараты, подавляющие их патологическую активность. Внедрение таргетной терапии меланомы в группе пациентов, имеющих мутацию в гене BRAF, существенно увеличило продолжительность жизни пациентов с меланомой и позволило получать относительно быстрый ответ. Однако его продолжительность может быть ограниченной в силу снижения либо эффективности терапии, либо ее переносимости из-за развития явлений токсичности. Поэтому вскоре на смену монотерапии BRAF-ингибиторами пришла комбинированная терапия ингибиторами BRAF и MEK, обеспечившая увеличение продолжительности ответа и снижение частоты развития токсичности [1].
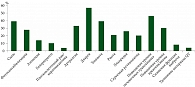
Проявления кожной токсичности в структуре нежелательных явлений (НЯ) комбинированной терапии ингибиторами BRAF и MEK занимают одну из ведущих позиций по частоте развития (рис. 1) [2]. При этом спектр клинических изменений кожи и ее придатков достаточно широк.
Так, согласно данным L. Heinzerling и соавт., к наиболее частым проявлениям кожной токсичности комбинированной терапии ингибиторами BRAF и MEK относятся сыпь, включая пятнисто-папулезную, повышение чувствительности к ультрафиолетовому излучению, выпадение волос, разнообразные нарушения ороговения и формирование новых первичных новообразований кожи, как доброкачественных, так и злокачественных (табл. 1) [3]. При этом в ряде случаев тяжесть кожного процесса достигает 3-й или 4-й степени и служит причиной вынужденного перерыва в лечении, снижения дозы препаратов либо отмены терапии и перевода пациента на другие возможные методы лечения. Доказано, что частота развития НЯ при использовании комбинированной терапии ниже, чем на фоне монотерапии вемурафенибом [4]. Не случайно практика применения комбинации с кобиметинибом расширяется.
Определить факторы риска развития тяжелой кожной токсичности на фоне терапии вемурафенибом и кобиметинибом попытались A.M. Hopkins и соавт. [5] в исследовании с участием 962 пациентов, которые получали вемурафениб (в монотерапии или комбинации с кобиметинибом). У 150 (16%) пациентов развилась тяжелая токсичность. Методом логистической регрессии авторы оценивали ассоциацию тяжелой сыпи (3-я или 4-я степень) с возрастом, полом, общим состоянием пациентов, массой тела, индексом массы тела, маркерами функции печени, скоростью клубочковой фильтрации. Оказалось, что лишь женский пол служит значимым фактором риска развития тяжелой сыпи (p < 0,001): у женщин такой риск был в два раза выше, чем у мужчин (22 против 11%, отношение шансов 2,17; 95%-ный доверительный интервал 1,52–3,09). Важно, что ассоциация с полом сохранялась во всех исследованиях и при всех режимах терапии (монотерапия либо комбинация с кобиметинибом).
В данном аспекте интерес представляют наблюдения A.R. Naqash и соавт., показавших, что назначение таргетной терапии после периода лечения ингибиторами контрольных точек иммунного ответа (и наоборот) сопровождалось сокращением срока развития сыпи в среднем до двух недель [6].
Прогностическое значение развития сыпи оценивали на фоне терапии вемурафенибом у 62 пациентов с нерезектабельной меланомой стадий III или IV и мутацией BRAF V600E. У 45 из них развилась кожная токсичность. С помощью многовариантного анализа ассоциации НЯ и эффективности вемурафениба (медиана общей выживаемости (ОВ), медиана выживаемости без прогрессирования (ВБП)) установлено, что наличие хотя бы одного проявления токсичности 2-й степени служит протективным фактором в отношении ВБП, но не ОВ [7]. В то же время имеются наблюдения развития витилигоподобных высыпаний, гало-невусов и регресса невусов на фоне терапии таргетными препаратами с последующим полным регрессом опухоли, что может указывать на благоприятное прогностическое значение данных изменений со стороны кожи [8].
Пятнисто-папулезная сыпь
Сигнальный путь RAS-BRAF-MEK-ERK передает сигналы от факторов роста и митогенов, регулируя экспрессию генов и процесс апоптоза и пролиферации клеток [9]. Гиперактивация этого сигнального пути наблюдается при различных злокачественных опухолях, а блокада с помощью ингибиторов BRAF и MEK приводит к изменениям в достаточно активно пролиферирующих органах и тканях – коже, волосяном фолликуле, слизистой оболочке кишечника и др. Вероятно, помимо прямого подавления пролиферации клеток опухоли терапевтическое действие ингибиторов BRAF и MEK, равно как и патогенез явлений кожной токсичности, объясняется иммуномодулирующим эффектом препаратов. Об этом свидетельствуют случаи развития иммуноопосредованных НЯ на фоне терапии BRAF-ингибиторами в виде регресса невусов, формирования витилиго, развития гранулематозных заболеваний [8, 10].
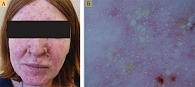
Как видно из табл. 1, поражение кожи у пациентов, получающих терапию вемурафенибом и кобиметинибом, чаще проявляется пятнисто-папулезной сыпью (рис. 2А), которая имеет вид участков покраснения кожи, обычно с относительно четкими границами, гладкой поверхностью, склонных к слиянию. Постепенно отдельные элементы могут утолщаться за счет инфильтрата и эволюционировать в папулы. При дерматоскопии определяются нечетко очерченные скопления мелких точечных сосудов на лососево-розовом фоне (рис. 2Б). По мере нарастания тяжести сыпи цвет высыпаний при осмотре и дерматоскопии приобретает пурпурно-синюшный оттенок (рис. 2В и 2Г). Гистологически определяются отек сосочкового слоя дермы, небольшая вакуолизация базального слоя, поверхностный дермальный периваскулярный лимфоцитарный инфильтрат и эозинофилы [11].
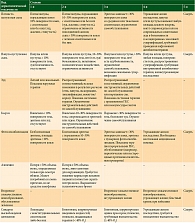
Диагностический и терапевтический подходы при пятнисто-папулезных высыпаниях на фоне терапии ингибиторами BRAF и MEK аналогичны таковым при ведении пациентов с пятнисто-папулезной сыпью, возникающей на фоне применения ингибиторов контрольных точек иммунного ответа [12]. При первичном обращении пациента с пятнисто-папулезными высыпаниями следует исключить высыпания любой иной этиологии (инфекционного происхождения, вызванные действием другого препарата, другим системным заболеванием). Затем проводят полный осмотр кожного покрова и слизистых оболочек, определяют степень тяжести сыпи. Важно также оценить общее состояние пациента (наличие лихорадки, увеличение лимфатических узлов и т.д.) и при необходимости выполнить лабораторные исследования (общий и биохимический анализы крови). Это необходимо также для исключения дерматологических неотложных состояний, таких как лекарственная реакция с эозинофилией и системными симптомами (DRESS), острый фебрильный нейтрофильный дерматоз (синдром Свита), синдром Стивенса – Джонсона, или токсический эпидермальный некролиз, и синдром высвобождения цитокинов. При подозрении на перечисленные состояния лечение отменяют, немедленно назначают симптоматическую терапию, госпитализируют пациента. В остальных случаях лечение определяется степенью тяжести сыпи (табл. 2) [12].
При сыпи и/или зуде 1-й степени можно продолжать противоопухолевую терапию. Симптоматическая терапия включает наружные смягчающие средства, антигистаминные препараты при наличии зуда, наружные глюкокортикостероиды (ГКС) слабой силы.
В случае пятнисто-папулезной сыпи 2-й степени основную терапию можно продолжать, но нужно еженедельно оценивать наличие улучшения. Если высыпания не уменьшаются, лечение прерывают, пока их степень не снизится до 1-й. Симптоматическое лечение продолжают: прием внутрь антигистаминных препаратов, наружное применение ГКС средней и высокой силы, а также смягчающих средств.
При прогрессировании сыпи до 3-й степени требуется немедленное прекращение противоопухолевой терапии до достижения 1-й степени. Лечение предполагает использование эмолентов, пероральных антигистаминных препаратов и высокопотентных наружных ГКС (клобетазола пропионат). Можно рассмотреть вопрос о проведении терапии системными ГКС в дозе 0,5–1 мг/кг в зависимости от тяжести симптомов.
В редких случаях развития кожной токсичности 4-й степени противоопухолевую терапию прерывают. Пациенты подлежат незамедлительной госпитализации в дерматологический стационар. Схема лечения включает внутривенное введение метилпреднизолона или преднизолона в дозе 1–2 мг/кг с постепенным снижением дозы после регресса высыпаний.
Методы профилактики пятнисто-папулезной сыпи не разработаны, но имеются упоминания о целесообразности возврата к таргетной терапии у пациентов, у которых лечение отменяли из-за развития сыпи 3–4-й степени тяжести, требовавшей лечения системными ГКС, еще на фоне продолжения приема преднизолона. Применение указанной тактики обсуждалось только у пациентов, ранее получавших терапию ингибиторами контрольных точек иммунного ответа. Подобная тактика может иметь профилактическое значение [11].
Папуло-пустулезная сыпь
По данным R. Anforth и соавт., кожная токсичность в форме папуло-пустулезных высыпаний в большей степени характерна для MEK-ингибиторов (рис. 3) [13] и наблюдается у 77% пациентов при использовании монотерапии. Это целесообразно учитывать в случае принятия решения о снижении дозы препаратов (возможно, при развитии акнеформной сыпи достаточно только снижения дозы MEK-ингибитора).
По клиническим и дерматоскопическим характеристикам сыпь схожа с акнеформными высыпаниями, развивающимися на фоне применения ингибиторов EGFR. Как правило, папуло-пустулезная сыпь возникает прежде всего на коже лица. По мере увеличения степени тяжести аналогичные элементы появляются на коже в зонах с множеством сальных желез (кожа груди, верхней трети спины), а также на коже остальных участков туловища и проксимальных участков конечностей. От вульгарных угрей сыпь обычно отличается отсутствием комедонов, хотя на фоне терапии вемурафенибом отмечается развитие комедонов. Папулы и пустулы расположены на эритематозном основании, быстро покрываются корочками. Медиана срока возникновения сыпи составляет 12,5 дня при монотерапии ингибиторами MEK и 307 дней при комбинированной терапии [13]. Дерматоскопически сыпь обнаруживает сходство с вызванными ингибиторами EGFR акнеформными высыпаниями, для которых характерно формирование пустул в виде белых округлых зон с желтой глыбкой в центре, что гистологически соответствует фолликулярной роговой пробке. При патоморфологическом исследовании могут обнаруживаться пустулы, сформированные нейтрофильным перифолликулярным инфильтратом, разрывы фолликулов [14].
Терапевтическая тактика при акнеформных высыпаниях определяется степенью тяжести сыпи (табл. 2) и обозначена в ряде отечественных и зарубежных рекомендаций, разработанных для коррекции акнеформной сыпи, вызванной ингибиторами EGFR [15–17]. Однако следует подчеркнуть, что сходство клинических, дерматоскопических и патоморфологических проявлений, соответствующих пустулезным высыпаниям, а также клинический опыт лечения этих высыпаний оправдывают применение упомянутого опыта лечения акнеформной сыпи, обусловленной ингибиторами EGFR, и при лечении папуло-пустулезной сыпи на фоне терапии ингибиторами BRAF и MEK.
Как известно, для профилактики угревой сыпи, вызванной использованием ингибиторов EGFR, эффективно применяются наружные ГКС (гидрокортизон 2,5%, алклометазон) и пероральные антибиотики (миноциклин, доксициклин или антибиотики, воздействующие на кожную флору) два раза в день в течение как минимум первых шести недель по непрерывной или интермиттирующей схеме (неделя приема препарата, неделя перерыв). Это приводит к уменьшению случаев кожной токсичности 2-й степени и выше и изменению дозы ингибитора EGFR более чем на 50%. Что касается комбинированной терапии ингибиторами BRAF и MEK, исследования, которые подтверждали бы эффективность и целесообразность назначения профилактической терапии, отсутствуют. Назначение профилактической терапии также ограничивается сроком развития сыпи, который при комбинированной терапии достаточно длительный. Возможно, назначение профилактической терапии целесообразно и в случае высокого риска быстрого развития акнеформной сыпи. Например, когда пациенту, ранее получавшему терапию ингибиторами контрольных точек иммунного ответа, предстоит прием MEK-ингибитора в монорежиме.
При развитии сыпи 1-й степени наружно применяют противовоспалительные и антибактериальные средства (гель с метронидазолом 1% два раза в день и мазь с такролимусом 0,1% два раза в день/мазь с такролимусом 0,1% два раза в день/комбинированный крем с гидрокортизона ацетатом 1% и фузидовой кислотой 2% два раза в день/крем алклометазона два-три раза в день), рекомендуются фотозащитные средства.
Акнеформные высыпания 2-й степени тяжести требуют дополнения указанной наружной терапии пероральными антибиотиками (миноциклин, доксициклин по 100 мг два раза в день или препараты исходя из антибиотикограммы) в течение не менее четырех недель. Допустимо также сочетать наружную терапию и интермиттирующий прием доксициклина в дозе 100 мг два раза в день с третьего дня от начала терапии в течение семи дней, далее семидневный перерыв. Общая длительность курса – 12 недель при акнеподобных высыпаниях на фоне терапии ингибиторами EGFR с учетом длительности периода, в течение которого сыпь развивается чаще всего [18]. При подозрении на вторичную инфекцию проводят микробиологическое исследование (посев) материала из очагов поражения с определением типа и чувствительности возбудителя для последующего назначения системной антибактериальной терапии.
При наличии сыпи 3-й степени тяжести рекомендуется рассмотреть возможность прекращения приема противоопухолевого препарата или препаратов на две недели или до тех пор, пока тяжесть сыпи не снизится до ≤ 1-й степени. Целесообразно назначать системные ГКС (метилпреднизолон или преднизолон в дозе 0,5 мг/кг в течение семи дней). Кроме того, необходимо продолжать применение наружных ГКС и системных антибиотиков после возобновления таргетной терапии. Всем пациентам рекомендуется применение увлажняющего крема для кожи и солнцезащитного крема широкого спектра защиты с SPF не менее 30 при выходе на улицу, поскольку сыпь сопровождается сухостью кожи и под воздействием солнечного излучения может усиливаться.
Еще одним возможным терапевтическим подходом является применение системных ретиноидов. В литературе описано 43 пациента, получавших терапию системными ретиноидами по поводу акнеформных высыпаний (на фоне терапии ингибиторами EGFR) [19]. Большинство из них (77%) отметили умеренное или выраженное улучшение после начала лечения, НЯ были минимальны (16%). Результаты систематического обзора указывают на то, что системная терапия ретиноидами при акнеформных высыпаниях, вызванных приемом ингибиторов EGFR, безопасна и эффективна [19]. В то же время описания использования ретиноидов пациентами с акнеформными высыпаниями на фоне терапии ингибиторами BRAF единичны. При этом отмечается хороший эффект при лечении тяжелых папуло-пустулезных высыпаний [20].
Сыпь, сопровождающаяся общими симптомами
В случае повышения температуры тела до ≥ 39 °С у пациента с сыпью на фоне терапии ингибиторами BRAF и MEK важно своевременно распознать тяжелые формы кожной токсичности. Они достаточно редки, но требуют максимально быстрого оказания медицинской помощи. Среди таких НЯ следует упомянуть синдром Стивена – Джонсона, или токсический эпидермальный некролиз, лекарственную реакцию с эозинофилией и системными симптомами (DRESS), острый генерализованный экзантематозный пустулез, синдром высвобождения цитокинов, сепсис [12].
Зуд и ксероз
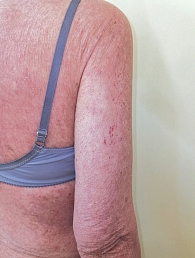
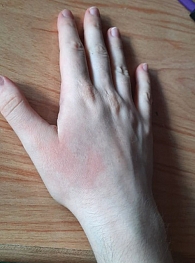
Зуд формируется на условно чистой коже либо сопровождает высыпания. Развитие зуда у пациентов, получающих терапию таргетными препаратами, может реализоваться по нескольким механизмам. Во-первых, подавление процессов пролиферации и дифференциации усугубляет ксероз кожи, часто сопровождающийся зудом и расчесами (рис. 4). Во-вторых, иммуномодулирующее влияние ингибиторов BRAF и MEK способствует секреции пруритогенных провоспалительных молекул и развитию зуда на чистой коже либо появлению зудящих высыпаний. В-третьих, в популяции онкологических пациентов весьма высока распространенность тревожных и депрессивных расстройств, которые доказанно снижают порог чувствительности к раздражителям, вызывающим зуд, и усугубляют этот субъективно тяжело переносимый симптом. Распространенность депрессивных и тревожных расстройств у пациентов с онкологическими заболеваниями составляет 23,4 и 19,9% соответственно [21]. При этом отмечается двусторонняя связь между зудом и психическим расстройством. Например, не только зуд способствует развитию тревоги, но и сама тревога потенцирует зуд, создавая замкнутый патологический цикл «зуд – тревога» [22].
Зуд и ксероз обычно не служат причиной отмены противоопухолевой терапии или коррекции дозы препаратов, поскольку не рассматриваются как угрожающий жизни симптом (табл. 2). Терапевтические опции включают наружное применение увлажняющих и смягчающих средств, проведение масляных ванн, при наличии сыпи нанесение наружных нестероидных препаратов (гель диметиндена, крем пимекролимуса, мазь такролимуса) или ГКС, содержащих алклометазон, бетаметазон, клобетазол, с учетом степени тяжести кожного процесса и анатомической области. При необходимости назначают системные препараты с противозудным эффектом, среди которых наиболее широко применяются антигистаминные препараты (супрастин, тавегил, цетиризин и др.).
Фотосенсибилизация
Поскольку в результате фотосенсибилизации могут развиваться солнечные ожоги, тяжесть которых способна достигать угрожающей жизни степени (табл. 2), всем пациентам до начала терапии следует разъяснять необходимость соблюдения мер фотозащиты. Важно дифференцировать фототоксические (сыпь только на открытых участках кожи) и фотоаллергические реакции (сыпь распространяется на закрытые участки кожи), поскольку во втором случае требуется отмена провоцирующего препарата (возврат к его приему запрещен). При наличии сыпи 1–2-й степени (рис. 5) достаточно исключить воздействие ультрафиолетового излучения, проведение наружной противовоспалительной терапии (наружные ГКС, охлаждающие повязки). При наличии сыпи 2–3-й степени отменяют прием вызвавшего реакцию препарата, назначают симптоматическую наружную терапию и антигистаминные средства, а иногда системные ГКС. При болевом синдроме возможно применение нестероидных противовоспалительных препаратов (диклофенак). При тяжелых фототоксических реакциях может потребоваться лечение в ожоговом отделении.
Алопеция
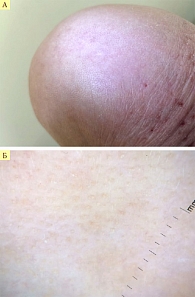
На фоне терапии ингибиторами BRAF и MEK развивается особый вид потери волос – расопатическая алопеция. Такое название обусловлено тем, что в патогенезе поражения фолликула ключевую роль играет активация сигнального пути RAS. Клиническая картина соответствует диффузной алопеции и проявляется усиленным выпадением волос через 8–16 недель от начала лечения с выраженным разрежением волос по всей площади волосистой части головы. Возможно выпадение ресниц, подмышечных и лобковых волос, волос на коже конечностей. Проба с потягиванием волос положительная, корни извлекаемых волос преимущественно находятся в фазе телогена. При дерматоскопии определяется снижение плотности волос с запустевающими фолликулами. При сочетании таргетной терапии с другими методами лечения тяжесть поражения фолликулярного аппарата возрастает (рис. 6). Патоморфологически определяются уменьшение числа терминальных волос в фазе анагена и увеличение числа фолликулов в фазе телогена и катагена, наличие телогеновых герминативных юнитов (указывает на арест телогена и придает сходство с очаговой алопецией) в отсутствие воспалительного инфильтрата. При окраске по Вейгерту выявляется массивная фрагментация эластиновых волокон [23].
С учетом наличия черт, схожих с гнездной алопецией, предпринимались попытки лечения наружными ГКС. Эти препараты во всех случаях обеспечили восстановление роста волос через 3–6 недель от начала применения [23].
Новообразования
Как известно, применение ингибиторов BRAF сопровождается повышением частоты развития такого НЯ, как формирование новых первичных доброкачественных и злокачественных новообразований кожи, эпителиальных (чаще) и меланоцитарных [24]. Данный побочный эффект, равно как и все остальные, в значительной степени нивелируется в случае проведения комбинированной терапии. Патогенез проонкогенного влияния блокады BRAF изучали в исследовании in vitro с использованием эквивалентов кожи и кератиноцитов с разными генетическими свойствами (нормальные кератиноциты: NHEK, HaCaT (p53/mut) и HrasA5 (p53/mut + Hras/mut)). Показано, что вемурафениб активирует передачу сигналов MEK-ERK как в кератиноцитах, так и в фибробластах in vitro- и in vivo-подобных эквивалентов кожи. Следовательно, вемурафениб не обеспечивает преимущества роста, но приводит к дифференцировке, вызывая ускоренную дифференциацию и гиперкератоз в клетках NHEK и формирование нормального строения слоев эпидермиса и ороговения в трансформированных кератиноцитах. При этом только в клетках HrasA5 выявляли зависимый от вемурафениба патофизиологический сдвиг в сторону опухолевой прогрессии, то есть инициацию инвазивного роста, о чем свидетельствовало повышение протеолитической активности, обеспечивавшей проникновение через базальную мембрану и инвазию в разрушенный нижележащий матрикс. Совместная обработка эквивалентов кожи вемурафенибом и ингибитором MEK кобиметинибом предотвращала гиперактивацию MEK-ERK и тем самым отменяла как эпидермальную дифференцировку, так и формирование фенотипа инвазии опухоли. Это говорит о том, что оба НЯ со стороны кожи находятся под непосредственным контролем вемурафениб-зависимой гиперактивации MEK-ERK, и подтверждает зависимость от предсуществующих генетических изменений кератиноцитов кожи, которые служат основой для индукции онкогенной прогрессии [25].
Таким образом, пациентам, получающим терапию ингибиторами BRAF и MEK, показано наблюдение дерматолога с проведением дерматоскопии для своевременного выявления очагов, вызывающих подозрения по поводу злокачественных новообразований кожи.
Заключение
Внедрение в онкологическую практику новых лекарственных средств неразрывно связано с появлением специфических НЯ, нередко требующих отмены жизненно важного и необходимого пациенту лечения. Однако, располагая данными о профилактике и коррекции явлений кожной токсичности таргетных препаратов, можно продлить сроки проведения эффективной и жизненно важной терапии.
A.V. Michenko, PhD, L.S. Kruglova, PhD, Prof., K.V. Orlova, PhD, I.V. Samoylenko, PhD, I.A. Utyashev, PhD, A.N. Lvov, PhD, Prof., D.V. Romanov, PhD, Ye.A. Fedulina
Central State Medical Academy
Medical Scientific and Educational Center of Lomonosov Moscow State University
N.N. Blokhin National Medical Research Center of Oncology
Hadassah Institute of Oncology
I.M. Sechenov First Moscow State Medical University
Mental Health Research Center
Contact person: Anna V. Michenko, amichenko@mail.ru
Targeted therapy of melanoma with BRAF and MEK inhibitors has become a breakthrough in the treatment of this aggressive tumor. At the same time, long-term use of these effective drugs is often limited by the development of severe adverse events, among which skin toxicity symptoms are of special importance. Therefore, this article presents the spectrum of manifestations of skin toxicity of combined targeted therapy with BRAF and MEK inhibitors using the combination of vemurafenib and cobimetinib as an example: pruritus, maculopapular and papulopustular rash, photosensitivity, alopecia, skin neoplasms. The principles of diagnostics are discussed, algorithms for prescribing external and systemic therapy are presented, taking into account the severity of damage to the skin and its appendages.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.