количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Экстракорпоральная фармакотерапия антибиотиками у родильниц с проявлениями гнойно-септических осложнений
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и Гинекология" №5
- Аннотация
- Статья
- Ссылки
Использование экстракорпоральной фармакотерапии способствовало более быстрому наступлению лечебного эффекта, сокращению сроков антибиотикотерапии и пребывания в стационаре, сохранению лактации, а также предупреждению развития осложненных форм гнойно-септических процессов.
В статье представлены результаты исследования эффективности применения методик экстракорпоральной фармакотерапии антибиотиками у родильниц с начальными гнойно-септическими осложнениями.
Использование экстракорпоральной фармакотерапии способствовало более быстрому наступлению лечебного эффекта, сокращению сроков антибиотикотерапии и пребывания в стационаре, сохранению лактации, а также предупреждению развития осложненных форм гнойно-септических процессов.
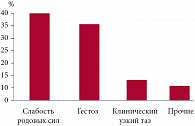
Рис. Показания для оперативного родоразрешения

Таблица 1. Показатели лейкоцитарного индекса интоксикации и С-реактивного белка до и после курса лечения у обследованных родильниц

Таблица 2. Средние сроки длительности лечения и антибиотикотерапии у родильниц сравниваемых групп
Послеродовые гнойно-септические заболевания встречаются у 13–54% родильниц и наряду с акушерскими кровотечениями лидируют среди причин материнской смертности. Частота гнойно-септических осложнений после родов обусловлена высокой инфицированностью женщин, вторичным иммунодефицитом, увеличением частоты оперативных родов и рядом других причин [1]. Основным методом лечения при гнойно-септических осложнениях является антибиотикотерапия, проведение которой осложняется быстрым развитием резистентности микроорганизмов к используемым препаратам. Кроме того, у части больных развивается аллергическая реакция на вводимые лекарства, оказывающие токсическое влияние на функцию печени, почек, кишечника. Порой недостаточная клиническая эффективность антибиотиков обусловлена:
- тяжестью инфекционного процесса;
- быстрым метаболизмом значительной части препарата до его попадания в очаг гнойного воспаления;
- низкой способностью препарата проникать через грануляционные и рубцовые ткани;
- естественной или приобретенной лекарственной резистентностью микрофлоры;
- атипичными формами бактерий;
- длительным приемом иммунодепрессивных препаратов;
- режимом дозирования и путями введения антибиотика [2].
В последние годы значительное внимание уделяется направленному в очаги поражения транспорту лекарств, в частности антибиотиков. Доказано, что в качестве носителей лекарственных препаратов наиболее удобно, безопасно и эффективно использовать аутогенные трансфузионные среды: аутоплазму, аутокровь, аутоэритроцитарную и лейкоцитарную массу [3]. В клинической практике этот метод чаще применяется у септических больных. Он известен под названием «экстракорпоральная фармакотерапия». Выделение плазмы и клеток крови осуществляется с помощью метода плазмафереза. Выделенная клеточная масса крови насыщается лекарством (антибиотиком), а затем возвращается в организм и доставляет антибиотик в очаг воспаления. Суммирование детоксикационных и прочих (рео- и иммунокоррекционных) эффектов плазмафереза и селективно-направленной антибиотикотерапии способствует быстрому купированию всего комплекса нарушений гомеостаза, имеющегося у родильниц с гнойно-септическими осложнениями [4, 5].
Установлено, что оптимальным контейнером для транспорта антибиотиков являются аутолейкоциты, поскольку они обладают естественной способностью к эндоцитозу – поглощению различных веществ и субстанций, в том числе антибиотиков. Активированные аутолейкоциты могут передвигаться в кровотоке и очаге воспаления по хемотаксису. Это свойство делает возможным не только доставку вещества кровотоком в зону повреждения, но и проникновение его непосредственно в очаг в обход зон сладжа, микроциркуляторных шунтов, куда эритроциты, например, попасть не могут [6, 7].
В клинике Перинатального центра с помощью сотрудников отделения клинической трансфузиологии начато внедрение методики экстракорпоральной фармакотерапии в виде направленного транспорта антибиотика на лейкоцитах у родильниц с гнойно-септическими осложнениями после кесарева сечения. Нами была оценена эффективность применения данной методики.
Материалы и методы исследования
Под нашим наблюдением находилось 35 родильниц (средний возраст 29,6 лет) с начальными проявлениями гнойно-септических осложнений после оперативных родов. 57% женщин были повторнородящими. У 95% родильниц в анамнезе имелись заболевания почек, печени, кожи и пр. (каждая вторая страдала несколькими заболеваниями). 14,6% женщин имели хроническую никотиновую интоксикацию; 12% страдали аллергией различного генеза; 7,4% имели профессиональные вредности. Кроме того, у 80% наблюдаемых был отягощенный акушерско-гинекологический анамнез (аборты – 36,6%, самопроизвольные выкидыши – 35,6%, осложнения родов, абортов и выкидышей – 40% и др.).
У всех родильниц было также осложнено течение настоящей беременности (у 35% – преэклампсия, у 27% – анемия различной степени тяжести, у 15% – угроза прерывания, у 13% – инфекции во время беременности, у 5% – гепатоз беременных, у 5% – прогрессирующее многоводие) и родов (несвоевременное излитие околоплодных вод – у 32%, аномалии родовых сил – у 8%, преждевременная отслойка нормально расположенной плаценты – у 13%, травмы мягких тканей – у 13% и др.).
Считается, что экстренное проведение кесарева сечения является одним из факторов риска развития инфекции у родильниц. Основные показания для кесарева сечения у пациенток, принявших участие в нашем исследовании (в 92% случаев экстренное), представлены на рисунке. У всех пациенток через 3–5 дней после родов наблюдались начальные проявления послеродовой инфекции в виде лохиометры, субинволюции матки, раневой инфекции на фоне проявлений синдрома системного воспалительного ответа организма:
- температура > 38 ºС (69%);
- тахикардия > 90 уд/мин (35%);
- лейкоцитоз > 12,0 × 109 со сдвигом формулы влево (95%);
- частота дыхания > 20 в минуту (100%).
- У пациенток были выражены и симптомы общей интоксикации – слабость, недомогание, головная боль, плохой сон и аппетит и др.
- Явления эндотоксикоза подтверждались результатами лабораторных исследований:
- гемоглобин < 100 г/л (68%);
- общий белок крови < 60 г/л (64%);
- СОЭ > 30 мм/час (87%);
- лейкоцитарный индекс интоксикации > 3,0 усл. ед. (100%) [8].
У каждой третьей женщины (n = 12) имели место повышенные уровни печеночных ферментов (аспартат- и аланинаминотрансферазы) в крови, у каждой второй в анализе мочи выявляли повышенное количество лейкоцитов. При посевах из половых путей были обнаружены энтерококк (n = 6), кишечная палочка (n = 4), белый (n = 4) и эпидермальный (n = 3) стафилококки, чаще чувствительные к антибиотикам.
Всем пациенткам при проведении кесарева сечения интраоперационно для профилактики инфекционных осложнений внутривенно вводили 1,5 г цефтриаксона. При наличии симптомов инфекции на момент операции терапию цефтриаксоном продолжали в течение трех дней после родов.
При появлении симптомов гнойно-септических осложнений пациентки получали комплексное лечение (терапевтические дозы аугментина, инфузионную терапию, средства, способствующие сокращению матки, противоанемические препараты и др.). 18 пациенткам была проведена вакуум-аспирация полости матки.
15 родильницам (вошедшим в основную группу) дополнительно проводили экстракорпоральную фармакотерапию в виде среднеобъемного центрифужного (n = 7) или аппаратного (n = 8) плазмафереза. Методика аппаратного или центрифужного плазмафереза и лейкоцитофереза была стандартной. Аутоплазму заменяли на плазмозамещающие препараты (кристаллоиды, тетраспан, 10%-ный альбумин и пр.), а в выделенные аутолейкоциты вводили разовую дозу гентамицина (80 мг) / аугментина (1,2 г) и 1,0 мл аденозинтрифосфата. Лейковзвесь с лекарствами инкубировали при комнатной температуре при периодическом помешивании в течение 30–40 мин и возвращали в сосудистое русло пациентки. Процедуры проводили через день, на курс больные получали в среднем 2,6 сеансов экстракорпоральной фармакотерапии.
Остальным 20 родильницам (контрольная группа) плазмаферез и экстракорпоральную фармакотерапию не назначали.
После лечения больным проводили обследование по протоколу, принятому в клинике для септических больных. Эффективность лечения оценивали по изменениям клинических и лабораторных показателей.
Результаты и их обсуждение
Пациентки основной группы отмечали значительное улучшение сразу после проведения сеанса экстракорпоральной фармакотерапии (табл. 1). У них улучшалось самочувствие и лактация, температура тела в течение 1–2 суток снижалась до нормальных показателей, улучшался анализ крови (снижение количества лейкоцитов и нормализация лейкоцитарной формулы, повышение уровня гемоглобина, общего белка крови, значительное снижение лейкоцитарного индекса интоксикации) и мочи. Инволюция матки по данным УЗИ происходила нормальными темпами, было отмечено быстрое купирование местных и общих признаков воспаления.
В контрольной группе клинический эффект был не так ярко выражен, он отмечался позднее на 3–4 дня. В анализах крови длительно сохранялись анемия, воспалительные изменения (лейкоцитоз, лимфопения, сдвиг лейкоцитарной формулы влево, повышение СОЭ).
Регистрации тяжелых форм гнойно-септических осложнений в виде эндометрита у пациенток основной группы не было, в контрольной группе это осложнение наблюдали в 3 случаях (табл. 2).
Средние сроки нахождения в стационаре и длительность антибиотикотерапии в контрольной группе были существенно и достоверно выше, чем у женщин, получавших экстракорпоральную фармакотерапию.
Особо подчеркнем, что применение экстракорпоральной фармакотерапии позволило снизить курсовые дозы применяемых антибиотиков, сократить их неблагоприятное влияние на организм матери и ребенка. Причем в контрольной группе в 35% случаев потребовалась смена антибактериального препарата на более мощный антибиотик. В основной группе лактация была сохранена во всех случаях, в контрольной – лактация была прекращена в целях сохранения здоровья новорожденного.
Заключение
Таким образом, раннее включение методики экстракорпоральной фармакотерапии в курс комплексного лечения родильниц с клинически значимыми проявлениями гнойно-септических осложнений приводит к более быстрому и стабильному улучшению общего состояния больных, устранению субъективных и объективных признаков интоксикации и воспаления, позволяет снизить антибактериальную нагрузку на организм матери и косвенно – на организм новорожденного. Исследование также показало, что применение экстракорпоральной фармакотерапии является надежной мерой профилактики тяжелых форм гнойно-септических осложнений.
1. Савельева Г.М., Курцер М.А., Шалина Р.И. Материнская смертность и пути ее снижения // Акушерство и гинекология. 2009. № 3. С. 11–15.
2. Горин В.С., Серов В.Н., Бирюкова Л.А., Степанов В.В. Оптимизация диагностики и лечения послеродового эндометрита // Российский вестник акушерства и гинекологии. 2009. № 1. С. 21–28.
3. Чермных С.В., Джоджуа Т.В., Кнуров И.Ю. Экстракорпоральная детоксикация и антибиотикотерапия в комплексном лечении гнойно-септических осложнений у беременных и родильниц // Информационный архив. 2008. Т. 12. № 2–3. С. 18–20.
4. Яковлева Н.В., Власов С.В. Эффективность экстракорпоральной иммунофармакотерапии в лечении женщин с воспалительными заболеваниями органов малого таза // Материалы V Российского научного форума «Мать и дитя». М., 2003. С. 505–506.
5. Марченко А.В., Карпушина И.А. Некоторые механизмы лечебного действия направленного транспорта антибиотиков // Тезисы 16-й научно-практической конференции «Методы гемафереза и квантовая терапия в клинической медицине». М., 2008. С. 73–74.
6. Bellomo R., Honoré P.M., Matson J. et al. Extracorporal blood treatment (EBT) methods in SIRS/Sepsis // Int. J. Artiff. Organs. 2005. Vol. 28. № 5. P. 450–458.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.