Антибиотики как модуляторы провоспалительных свойств бактериальных патогенов
- Аннотация
- Статья
- Ссылки
- English
В обзоре рассмотрены вопросы влияния антибиотиков на способность патогенных бактерий инициировать и поддерживать воспалительный ответ организма, реакции врожденного и адаптивного иммунитета. Рассмотрены данные об изменении синтеза компонентов клеточной стенки, вызванном антибиотиками, в контексте модификации воспалительных реакций и иммунного ответа на бактериальные патогены. Рассмотрены данные о влиянии антибиотиков с различным механизмом антимикробного действия на способность чувствительных и резистентных к действию антимикробных препаратов бактериальных патогенов индуцировать развитие воспалительной реакции и инициировать запуск механизмов врожденного и адаптивного иммунитета. На основании литературных данных проанализированы причины низкой эффективности антибиотиков и механизмы воспалительных осложнений при их применении у иммунокомпрометированных пациентов, обосновывается необходимость более глубокого понимания механизмов воздействия антибиотиков на воспалительные реакции, что в свою очередь может способствовать разработке новых подходов к использованию антибиотиков. Высказано мнение, что сочетание ингибиторов синтеза клеточной стенки и ингибиторов синтеза белков может уменьшить некоторые связанные с антибиотикотерапией осложнения воспалительного характера при определенных инфекциях. В обзоре также обсуждается возможность того, что ингибиторы синтеза клеточной стенки, которые ранее считались неэффективными при уничтожении бактерий, могут быть полезны для модификации бактериальных клеточных стенок и могут эффективно элиминировать бактериальные патогены за счет иммунологических механизмов.
В обзоре рассмотрены вопросы влияния антибиотиков на способность патогенных бактерий инициировать и поддерживать воспалительный ответ организма, реакции врожденного и адаптивного иммунитета. Рассмотрены данные об изменении синтеза компонентов клеточной стенки, вызванном антибиотиками, в контексте модификации воспалительных реакций и иммунного ответа на бактериальные патогены. Рассмотрены данные о влиянии антибиотиков с различным механизмом антимикробного действия на способность чувствительных и резистентных к действию антимикробных препаратов бактериальных патогенов индуцировать развитие воспалительной реакции и инициировать запуск механизмов врожденного и адаптивного иммунитета. На основании литературных данных проанализированы причины низкой эффективности антибиотиков и механизмы воспалительных осложнений при их применении у иммунокомпрометированных пациентов, обосновывается необходимость более глубокого понимания механизмов воздействия антибиотиков на воспалительные реакции, что в свою очередь может способствовать разработке новых подходов к использованию антибиотиков. Высказано мнение, что сочетание ингибиторов синтеза клеточной стенки и ингибиторов синтеза белков может уменьшить некоторые связанные с антибиотикотерапией осложнения воспалительного характера при определенных инфекциях. В обзоре также обсуждается возможность того, что ингибиторы синтеза клеточной стенки, которые ранее считались неэффективными при уничтожении бактерий, могут быть полезны для модификации бактериальных клеточных стенок и могут эффективно элиминировать бактериальные патогены за счет иммунологических механизмов.
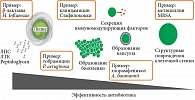

С момента открытия пенициллина в 1928 г. и его использования в качестве препарата в 1940-х гг. антибиотики стали одним из важнейших достижений современной медицины. Антибиотики широко использовались и используются в медицине до настоящего времени – они доказали свою эффективность и спасли бесчисленное количество жизней. Тем не менее с началом эры применения антибиотиков человек вмешался в сложившийся за миллионы лет эволюции механизм, обеспечивающий выживание его самого в мире бактерий. В частности, использование антибиотиков влияет на то, как иммунная система обнаруживает и реагирует на бактерии, что может иметь как положительные, так и отрицательные последствия для исхода инфекции.
Согласно ранее сложившимся представлениям, антибиотики in vivo работают синергично с иммунитетом хозяина, и есть доказательства того, что воздействие антибиотиков приводит к тому, что иммунная система способна более эффективно элиминировать бактериальные патогены из организма. Установлено, что антибиотики часто не столь эффективны у людей с ослабленным иммунитетом, как можно было ожидать, что свидетельствует в пользу предположения, что часть механизма, с помощью которого работают антибиотики, заключается в синергии с иммунной системой [1]. Так, G. Sakoulas и соавт. [2] наблюдали, используя сенсибилизированный с нафциллином MRSA, что уничтожение патогена в конечном итоге опосредовано защитными пептидами человека, продуцируемыми нейтрофилами и кератиноцитами. S. Muller и соавт. отметили, что лечение MRSA β-лактамами уменьшает количество пептидогликановых поперечных связей и тем самым облегчает уничтожение бактерий лизоцимом хозяина [3]. Таким образом, особенности того, как антибиотики влияют на механизмы формирования адаптивного иммунитета и на чувствительность бактерии к эффекторным механизмам врожденного иммунитета, могут оказывать непосредственное влияние на течение и исход инфекционного процесса. В большинстве случаев распознавание и уничтожение бактериального патогена осуществляется посредством запуска механизмов воспалительной реакции. В этом обзоре мы рассмотрим некоторые механизмы, с помощью которых антибиотики влияют на воспалительные реакции во время инфекции (рис. 1).
Этот обзор также будет посвящен изменениям бактерий, вызванным антибиотиками, которые влияют на реакцию иммунной системы на них. Имеются данные о том, что антибиотики могут непосредственно взаимодействовать с клетками-хозяевами для воздействия на их функцию и экспрессию генов [4], хотя это не будет рассматриваться в дальнейшем. Кроме того, антибиотики могут изменять микробные сообщества хозяев в кишечнике и на других поверхностях слизистой оболочки, что косвенно влияет на иммунитет и воспаление организма [5, 6].
Список применяемых в настоящее время антибиотиков и их многочисленных производных обширен. В широком смысле антибиотики могут быть сгруппированы в три основных класса, основанных на их способе действия:
- ингибиторы синтеза клеточной стенки;
- ингибиторы синтеза белка;
- ингибиторы синтеза нуклеиновых кислот.
Список наиболее распространенных антибиотиков из вышеуказанных групп представлен в таблице.
В большинстве случаев клиническая эффективность антибиотика ассоциируется с интенсивной гибелью бактерии-патогена. Этот процесс сам по себе может индуцировать выраженные воспалительные реакции. Известно, что блокирующие синтез клеточной стенки β-лактамы, интерферируя за участки связывания PBPs, блокируют синтез пептидогликана и вызывают активацию ряда ферментов, участвующих в аутолитическом разрушении клеточной стенки. Это приводит к высвобождению мощных индукторов воспалительных реакций – липополисахаридов (ЛПС), липотейхоевой кислоты (ЛТК) и пептидогликана [7], которые все вместе именуются PAMP и которые распознаются рецепторами врожденного иммунитета, расположенными на многих типах клеток. Например, в эксперименте показано, что обработка Streptococcus pneumoniae дикого типа (но не аутолизин-дефицитного мутанта) пенициллином усиливает TLR2-опосредованный сигналинг в фагоцитирующих клетках [8].
Наиболее широко обсуждаемый случай индуцированного антибиотиком обострения воспалительных реакций относится к грамотрицательному бактериальному сепсису. Уже более века известно, что ЛПС достаточно, чтобы вызвать септический шок, и с 1960-х гг. прошлого века считается общепринятым, что многие бактерицидные антибиотики вызывают высвобождение ЛПС из клеточных стенок грамотрицательных бактерий [9]. ЛПС очень эффективно распознаются врожденной иммунной системой с помощью комплекса TLR4 и его кофакторов, экспрессируемого многими типами клеток, включая циркулирующие миелоидные клетки. Следствием этого распознавания является системная воспалительная реакция [9]. Имеются обширные литературные данные, подтверждающие in vitro идею о том, что различные антибиотики могут индуцировать высвобождение ЛПС из стенок бактериальных клеток [9], но тем не менее относительно небольшое число сообщений достоверно документируют это явление in vivo. В одном раннем исследовании десять из десяти пациентов с сепсисом, ассоциированным с обнаруживаемыми ЛПС крови, развили повышенный уровень свободных ЛПС в крови после начала введения антибиотиков [10]. Авторы отметили некоторую корреляцию между тем, какие антибиотики вызывали наибольшее выделение ЛПС in vivo и in vitro. Тем не менее в этом исследовании не было выявлено корреляций со смертностью пациентов. В более позднем исследовании было отмечено увеличение уровней ЛПС в сыворотке крови при лечении антибиотиками, но не было выявлено каких-либо ассоциированных изменений клинической симптоматики [11]. В экспериментальных исследованиях в модели сепсиса у кроликов, вызванного Escherichia coli, антибиотикотерапия, которая повышала уровень ЛПС в сыворотке крови в десять раз, не влияла на выживаемость по сравнению с контрольной группой [12]. Более убедительные данные были получены в случае инфекций, вызванных Streptococcus pneumoniae и Haemophilus influenzae [13]. Было показано, что назначение антибиотиков сопровождалось ухудшением клинического течения инфекции, которое авторы рассматривают как последствие массивного лизиса бактерий под влиянием антибиотиков. Лечение пациентов или лабораторных животных кортикостероидами до или одновременно с β-лактамными антибиотиками приводит к улучшению неврологического исхода в случаях S. pneumoniae или H. influenzae менингита и является стандартной рекомендацией при лечении бактериального менингита [14].
В литературе имеются данные, указывающие на то, что выраженность и характер воспалительного ответа на антибиотикотерапию может зависеть от механизма антибактериального действия препарата. Так, было продемонстрировано, что антибиотики, которые ингибируют синтез белка, вызывают меньший выброс бактериальных продуктов. Например, обработка Staphylococcus aureus ванкомицином – антибиотиком, вызывающим разрушение клеточной стенки, повышает его способность стимулировать выработку цитокинов макрофагами, воздействие же ингибитора синтеза белка – антибиотика линезолида подавляет эти ответы [15, 16]. Точный механизм наблюдаемых феноменов не совсем ясен. Это может быть связано как со снижением синтеза PAMP, так и с отсутствием бактериального лизиса. Еще одним важным следствием изучения особенностей влияния на иммунную систему антибиотиков с различным механизмом антибактериального действия стало предположение, что эффективность бактериостатических препаратов, к которым в большей степени относятся антибиотики – ингибиторы синтеза белка, в значительной степени зависит от эффективности иммунологических механизмов.
К настоящему времени накоплен большой массив данных, достоверно подтверждающих связь между выраженностью системного воспалительного ответа при инфекционном процессе, вызванного бактериями, и появлением в системной циркуляции компонентов бактериальной клетки и продуктов жизнедеятельности патогена. Тем не менее следует отметить, что в своем большинстве это результаты экспериментов in vitro или данные экспериментальных исследований in vivo на животных. В многочисленных клинических исследованиях были получены неоднозначные результаты. Отражением этой ситуации стало принятие международных критериев диагностики сепсиса и септического шока. В них совершенно не учитывается факт обнаружения и концентрация в системном кровотоке бактериальных продуктов, относящихся к PAMP. Неудивительно, что в литературе очень мало данных о деталях запуска системного воспалительного ответа после назначения антибиотиков, включая иммунологические механизмы. Это обстоятельство хорошо иллюстрируется на примере ЛПС. Поскольку ЛПС оказывают биологическое действие в феноменально низких концентрациях и способны вызывать толерантность к последующему поступлению в кровоток больших количеств ЛПС [17], вполне вероятно, что увеличение концентрации ЛПС, вызванное действием антибиотика, вносит минимальный вклад в течение заболевания.
Ситуация осложняется еще и тем, что не ограничивается феноменом бактериального лизиса и высвобождением в окружающие ткани и системный кровоток компонентов бактериальной клетки, относящихся к PAMP. Под влиянием антибиотиков бактерии претерпевают структурную и метаболическую трансформацию, приспосабливаясь к изменившимся условиям, что в свою очередь может влиять на характер взаимодействия бактерий с иммунной системой организма-хозяина. Этот механизм вполне может работать в реальных клинических условиях и в силу следующих причин – хотя антибиотики рекомендованы для применения в концентрациях, которые эффективно элиминируют патогены, оптимальные концентрации антибиотиков часто не достигаются у инфицированных пациентов. Плохое соблюдение рекомендаций пациентом может привести к нарушению режима дозирования антибиотиков. Кроме того, некоторые антибиотики плохо проникают через гемато-тканевой барьер, в клетки, инфицированные внутриклеточными патогенами, а также относительно неактивны в патологически измененных тканях и биологических средах [18, 19]. Например, ванкомицин представляет собой громоздкую молекулу, которая плохо проникает в легкие или мозг [20], а аминогликозиды неэффективны в средах с низким рН, таких как абсцессы или фаголизосомы фагоцитирующих клеток [18]. Кроме того, многие бактерии генерируют биопленки, которые могут снизить эффективность антибиотика [19]. Как следствие, воздействие субтерапевтических или субингибирующих концентраций антибиотиков на бактерии, вероятно, происходит гораздо чаще, чем это предполагается при лечении клинических инфекций. Антибиотики, вводимые в субтерапевтических или субингибирующих концентрациях, могут оказывать длительное и глубокое воздействие на бактериальную клетку, изменяя характер взаимодействия последней с иммунной системой. При наличии сублитических доз антибиотиков микробы могут инициировать de novo синтез провоспалительных и вирулентных факторов [21] и подвергаться различным клеточным модификациям, включая изменения клеточной стенки [22]. Одним из прогнозируемых результатов воздействия на бактерии сублитических доз антибиотиков является инициирование реакции микробного стресса (SOS-ответ и «строгий» ответ), которая приводит к адаптации патогена, включая индукцию различных генетических программ. Эти реакции способствуют восстановлению клеточных повреждений и готовят бактерию-патоген к выживанию в потенциально агрессивной среде. Так, было показано, что лечение инфекции, вызванной Listeria monocytogenes субингибирующими дозами β-лактамных антибиотиков или ванкомицином (ингибиторами синтеза клеточной стенки) приводит к усилению экспрессии ряда связанных со стрессом генов и генов, кодирующих факторы вирулентности, включая порообразующий белок листериолизин O, биологическая активность которого заключается в клеточной цитотоксичности, индукции апоптоза, усилении продукции провоспалительных цитокинов [23, 24]. У Pseudomonas aeruginosa воздействие субингибирующих концентраций антибиотиков, включая ципрофлоксацин (ингибитор гиразы ДНК) и тетрациклин (ингибитор синтеза белка), вызывает изменения в экспрессии более 5% генов микроорганизма [25], включая экспрессию факторов вирулентности, таких как компоненты секреторной системы III типа, которая непосредственно участвует в модуляции функциональной активности фагоцитирующих макрофагов и синтеза ими провоспалительных цитокинов [26].
В последние годы высказана идея, что антибиотики не только выступают в качестве индуктора бактериального стресса, но и могут имитировать сигнальные молекулы, которые естественным образом регулируют микробные клеточные процессы и экспрессию генов вирулентности. Эта гипотеза возникла из наблюдения, что многие микробные сигнальные молекулы обладают антибиотическими свойствами и играют важную роль в экспрессии генов вирулентности, например в хорошо охарактеризованной системе аgr у S. aureus. Agr – секретируемый пептид, который проявляет противомикробную активность, ингибируя рост родственных и неродственных бактерий в сообществе, а также в субингибирующих концентрациях координирует экспрессию различных токсинов в этих бактериях, обладающих цитолитическими свойствами в отношении клеток млекопитающих и индуцирующих провоспалительные реакции [27]. Показано, что в соответствии с этой гипотезой передачи сигналов антимикробный пептид LL-37 связывает CsrS-компонент 2-компонентной системы CovRS в стрептококках группы A и в субингибирующих концентрациях индуцирует усиление некоторых генов вирулентности, в том числе тех, которые контролируют переход от локализованной инфекции к инвазивной болезни [28]. Кроме того, из последовательности LL-37 исследователям удалось выделить фрагмент из десяти остатков, не обладающий противомикробной активностью, который все еще способен активировать сигнальный путь посредством CovRS [28]. Таким образом, антибиотики могут непосредственно вызывать передачу сигналов в бактериальной клетке, изменяя способность бактерии индуцировать воспалительные реакции в ходе инфекционного процесса. Хотя ингибиторы синтеза белков, как правило, считаются ингибиторами экспрессии факторов вирулентности и воспаления, при определенных обстоятельствах этот класс антибиотиков может быть провоспалительным. Опубликованные исследования предоставляют множество примеров ингибиторов синтеза белка, подавляющих экспрессию токсина и вирулентности в сублитических и субингибирующих концентрациях. Показано, что экспозиция стафилококков или стрептококков в присутствии субингибирующих концентраций клиндамицина вызывает снижение экспрессии токсина синдрома токсического шока 1 [29], А-токсина, агониста NLRP3 субъединицы инфламмасомы [30] и суперантигена стрептококка – пирогенного экзотоксина А (SpeA) [31]. Клиндамицин и линезолид также ингибируют транскрипцию лейкоцидина S. aureus, который индуцирует воспаление через NLRP3-зависимый воспалительный процесс в моноцитах человека [32] и гибель нейтрофилов [33, 34]. Однако эффекты ингибирования синтеза белка могут быть зависимыми не только от типа антибиотика, но и от характера генной экспрессии. Транскрипционное исследование P. aeruginosa показало разнонаправленную экспрессию многих генов в присутствии субингибиторных концентраций тобрамицина и тетрациклина [25]. Среди генов с повышенной экспрессией тетрациклин индуцирует синтез компонентов системы секреции III типа. Следствием этого является увеличение цитолитической активности патогена в отношении макрофагов [25]. У S. aureus тетрациклин и клиндамицин вызывают экспрессию провоспалительного и цитолитического фенол-растворимого токсина [35] с помощью механизма, который включает активацию ранее упомянутого agr-регулятора вирулентности S. aureus [36].
Многие бактерии способны образовывать капсулы, которые обеспечивают защиту от окружающей среды и бактерицидных факторов иммунной системы [37]. Воздействие субингибиционных доз антибиотиков может вызывать или подавлять образование капсул.
Acinetobacter baumannii является грамотрицательной бактерией, которая часто поражает пациентов, получающих антибиотики. E. Geisinger и соавт. недавно отметили, что субингибирующие дозы ингибирующих синтез белка антибиотиков хлорамфеникола или эритромицина способны индуцировать синтез экзополисахаридной капсулы микроба [38]. Было продемонстрировано, что образование капсулы защищает бактерии от действия бактерицидных факторов сыворотки крови и способствует повышению вирулентности. Авторы отметили, что образование капсулы дополнительно способствует устойчивости микробов к пептидным антибиотикам. Аналогично обработка Klebsiella pneumoniae полимиксином B индуцирует экспрессию капсульных полисахаридов, тем самым повышая устойчивость бактерии к антимикробным пептидам [39]. В противоположность этому, Bacteroides fragilis, обработанные субингибирующими дозами клиндамицина, теряют экспрессию капсулы и становятся более восприимчивыми к комплемент-зависимому лизису и фагоцитозу нейтрофилами и моноцитами [40]. Кроме того, Pasteurella multocida реагирует на субингибирующие дозы ингибирующего синтез нуклеиновой кислоты новобиоцина или триметоприма, уменьшая экспрессию капсульных генов, что приводит к потере капсулы [41].
Другим типичным ответом нескольких видов патогенных бактерий на субингибирующие концентрации конкретных антибиотиков является индукция образования биопленки [42]. Например, было показано, что P. aeruginosa легко образует биопленки в ответ на субингибирующие концентрации тобрамицина, аминогликозидного антибиотика, но не на многие другие типы антибиотиков [43]. E. coli реагирует на субингибирующие концентрации широкого спектра ингибирующих трансляцию антибиотиков образованием биопленок [44]. Интересно, что механизмы, с помощью которых эти две бактерии реагируют, связаны между собой, но противоположны. P. aeruginosa реагирует на тобрамицин, утилизируя циклический dGMP, сигнал, который, вероятно, является необходимым для содействия образованию биопленки [43]. Напротив, E. coli реагируют на субингибирующие дозы специфических антибиотиков, увеличивая продукцию циклического dGMP [44]. Циклический dGMP распознается врожденной иммунной системой, что приводит к активации сигнальных путей, в конечном счете приводящих к экспрессии генов интерферонов, хотя до настоящего времени неясно, влияет ли этот тип регуляции продукции dGMP на способность бактерий модулировать воспалительный ответ [45]. С другой стороны, формирование биопленок способствует устойчивости входящих в ее состав бактерий к клеточным и гуморальным факторам иммунной системы – киллингу нейтрофилами и макрофагами, бактерицидному действию антимикробных пептидов. В сочетании с высокой устойчивостью бактерий в составе биопленок к бактерицидному действию антибиотиков образование биопленок может ограничивать системный воспалительный ответ при применении антибиотиков [46–48].
В целом многое еще предстоит узнать о том, как антибиотики влияют на способность микробов индуцировать воспалительные реакции. Хотя не всегда легко предсказать, как антибиотик повлияет на экспрессию конкретного бактериального фактора, особенно при субингибиторных концентрациях. Выяснено несколько закономерностей в отношении того, как определенные классы антибиотиков влияют на воспаление. Активные бактерицидные антибиотики – ингибиторы синтеза компонентов клеточной стенки, такие как β-лактамы, в основном индуцируют воспалительные реакции в организме-бактерионосителе, поскольку они вызывают высвобождение самого большого количества бактериальных продуктов посредством лизиса клеток. Для сравнения, ингибиторы синтеза белка, такие как эритромицин или клиндамицин, обычно блокируют производство токсинов и факторов вирулентности и считаются противовоспалительными. Эти данные, подтвержденные значительными доклиническими данными, привели к клинической практике сочетания ингибиторов синтеза белка с β-лактамными антибиотиками в лечении тяжелых инфекций, например комбинированного применения β-лактамов и клиндамицина для лечения сепсиса и септического шока, вызванных стафилококками или стрептококками [49].
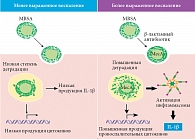
До недавнего времени в литературе преобладали работы по антибиотикоиндуцированным изменениям в воспалительных реакциях на патогенные бактерии, в которых основное внимание фокусировалось на антибиотиках, которые ингибируют синтез клеточной стенки и часто являются бактерицидными. Как уже обсуждалось выше, влияние на воспалительные реакции в основном связывают с PAMP, высвобождаемыми при лизисе бактерий. Однако в этих работах редко принимается во внимание важность выживших бактериальных клеток в воспалительных процессах. Внимание к этой проблеме было связано с недавней работой по MRSA, проведенной S. Muller и соавт. [3]. Установлено, что β-лактамные антибиотики блокируют синтез пептидогликана клеточной стенки путем связывания и инактивации бактериальных PBP, которые необходимы для заключительных стадий синтеза пептидогликана и образования перекрестных сшивок [50]. Устойчивые штаммы S. aureus приобрели дополнительный ген MecA, кодирующий PBP-2a, который устойчив к β-лактамным антибиотикам [51]. Анализ высокоэффективной жидкостной хроматографии показал, что, несмотря на устойчивость к антибиотикам, полученный пептидогликан клеточной стенки неэффективно сшивается. Это приводит к более рыхлой, более чувствительной к деградации клеточной стенке [3, 52]. Ранее мы отмечали, что фагоцитоз и деградация пептидогликана необходимы для активации NLRP3-зависимых воспалительных реакций в макрофагах [53]. Как следствие, обработанный β-лактамом MRSA вызывает более тяжелую воспалительную реакцию в экспериментальной модели инфицированного кожного дефекта у мышей [3]. Важность структурных изменений пептидогликана была дополнительно подтверждена экспериментами с генетическими модифицированными бактериями, не обладающими PBP4. Этот дефект вызывает низкий уровень сшивок в молекуле пептидогликана и также индуцирует более высокий уровень интерлейкина 1β (IL-1β) с выраженным системным воспалительным ответом во время инфекции, вызванной данным штаммом (рис. 2).
Напротив, штаммы, лишенные казеинолитической протеазы, увеличивают толщину клеточной стенки и перекрестное связывание пептидогликана, что не только повышает устойчивость MRSA к антибиотикам β-лактамам, но и уменьшает количество IL-1β, вырабатываемого макрофагами.
В последнее время было проведено несколько исследований, свидетельствующих о важности внутриклеточного разрушения бактерий для реализации провоспалительного потенциала фагоцитирующих клеток. Было отмечено, что некоторые бактерии способны модифицировать свои клеточные стенки для защиты от разрушения внутри фаголизосом, и это имело серьезные последствия в отношении воспалительных реакций [54]. Показано, что разрушение грамположительных бактерий в фагосомах увеличивает продукцию медиаторов воспаления, таких как IL-1β [53], TNF-α, IL-6, NO [16, 55] и IFN-β [56], что дает основание предположить, что степень воспаления может быть напрямую связана с чувствительностью пептидогликана клеточной стенки бактерий к внутриклеточному разрушению, при этом усиление воспалительного ответа не только не является результатом разрушения пептидогликана с измененной под влиянием антибиотика структурой, но и связано с изменениями в доступности других PAMP, таких как ЛТК и бактериальная ДНК и РНК. Таким образом, воздействие антибиотиков на воспалительную реакцию, вызванную патогеном, может реализовываться через изменение чувствительности бактерий к внутриклеточной деградации. Следует отметить, что усиление провоспалительных свойств может наблюдаться и у резистентных к данному антибиотику штаммов, так как, несмотря на отсутствие бактерицидного или бактериостатического действия на резистентный микроорганизм, антибиотик может влиять на отдельные этапы метаболизма бактерий, ответственные за синтез компонентов клеточной стенки. По-видимому, последнее предположение верно в отношении антибиотиков, влияющих на химический состав и структуру клеточной стенки грамотрицательных и грамположительных бактерий. Так, воздействие субингибирующих концентраций ванкомицина на чувствительный штамм S. aureus увеличивало провоспалительную реакцию макрофагов, фагоцитировавших бактерии, в то же время бактерии, подвергнутые воздействию ингибитора синтеза белка линезолида, не влияли на фагоцитирующие макрофаги по сравнению с контролем – необработанными антибиотиком бактериями [16].
Учитывая усиление синтеза провоспалительного потенциала, связанное с повышенной чувствительностью к лизосомальной деградации, вполне вероятно, что более выраженные провоспалительные свойства, вызванные антибиотиком у MRSA, описанные S. Muller и соавт. [3], не ограничиваются продуцированием IL-1β. Экспрессия MecA не является единственным механизмом, влияющим на устойчивость к антибиотикам MRSA. Было показано, что экспрессия MurT и GatG влияет на амидирование пептидогликана, устойчивость к β-лактамам и лизоциму [57]. Как экспрессия этих генов может повлиять на воспалительный процесс, остается неясным.
Устойчивость штаммов MRSA к большинству β-лактамных антибиотиков и рост заболеваемости MRSA привели к использованию ванкомицина в качестве основного альтернативного препарата выбора для лечения инфекций MRSA. Однако, как и при использовании других антибиотиков, развивается резистентность. В этом случае резистентность была связана с полиморфизмами гена аgr, выражающимися в увеличении толщины клеточной стенки на 105% и уменьшении автолиза [58, 59]. И хотя специальных исследований провоспалительных свойств бактерий в данном контексте не проводилось, тем не менее было высказано предположение о затрудненной лизосомальной деградации фагоцитированных бактерий и связанном с этим процессом высвобождении PAMP. Грамположительная бактерия L. monocytogenes устойчива к цефалоспориновым антибиотикам. Однако в ответ на пенициллин G бактерия становится значительно более чувствительной in vivo к цефалоспоринам, другому типу ингибиторов синтеза клеточной стенки [60]. Пенициллин G регулирует экспрессию поверхностного белка Lmo1941, в свою очередь Lmo1941 содержит домен LysM и, предположительно, не ковалентно связан с пептидогликаном. Lmo1941, влияя на изменения структуры пептидогликана, воздействует на чувствительность к лизосомальной деградации и воспалительные реакции фагоцитов и может иллюстрировать концепцию, что существует много типов связанных с антибиотиками нарушений метаболизма бактерий, которые могут влиять на структуру стенок, высвобождение PAMP и таким образом на воспалительные реакции, вызванные бактериальным патогеном.
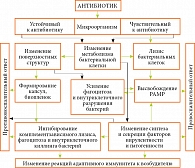
В контексте антибактериальной терапии эффективность может зависеть как от прямого воздействия препарата на инфекционный агент, так и от того, как препарат может изменить механизмы, с помощью которых наша иммунная система реагирует на микроорганизм. Более четкое понимание того, как антибиотики влияют на иммунное распознавание микробов, должно способствовать новым и рациональным подходам к антибактериальной терапии, хотя найти простые решения тут вряд ли возможно, поскольку даже подклассы β-лактамных антибиотиков, воздействующих на различные РВР, оказывают различное воздействие на бактерии. Например, P. aeruginosa высвобождает до 40 раз больше ЛПС при лечении PBF-3-специфическим цефтазидимом, чем PBP-2-специфическим имипенемом [61]. Аминогликозиды, такие как гентамицин, блокируют синтез белка, и следовательно, можно ожидать, что они будут вызывать менее выраженный провоспалительный ответ, но эти препараты также стимулируют P. aeruginosa высвобождать везикулы, наполненные воспалительными факторами, такими как LPS и наружные мембраны [62]. Все больше доказательств того, что сочетание ингибиторов синтеза клеточной стенки и ингибиторов синтеза белков может уменьшить некоторые связанные с антибиотикотерапией осложнения воспалительного характера при определенных инфекциях. Еще более интересной является возможность того, что ингибиторы синтеза клеточной стенки, которые ранее считались неэффективными при уничтожении бактерий, могут быть полезны для ослабления бактериальных клеточных стенок, так что другие лекарства, такие как антимикробные пептиды LL-37 или даптомицин, могут более эффективно убивать бактерии. Тем самым открываются новые пути для разработки эффективных методов лечения [2]. Мы можем обнаружить, что антибиотики, которые являются минимально эффективными in vitro, являются очень эффективными in vivo при терапии инфекций, вызванных бактериями, восприимчивыми к естественной защите хозяина.
На рисунке 3 в общем виде показано, как антибиотики меняют воспалительную и иммунологическую реактивность организма. Графическое представление позволит более глубоко и наглядно представить понимание механизмов воздействия антибиотиков на воспалительные реакции, что может стимулировать к разработке новых, более рациональных подходов к использованию антибиотиков.
A.V. Tutelyan, MD, PhD, Prof., corresponding member RAS
Central Research Institute of Epidemiology of Rospotrebnadzor
I.M. Sechenov First Moscow State Medical University (Sechenov University)
Contact person: Aleksey V. Tutelyan, bio-tav@yandex.ru
In the context of antibacterial therapy, the effectiveness can depend on direct influence of the drug on infective agent and on the capability of drug to change the mechanisms that the immune system utilizes to react to microorganisms. The review considers the influence of antibiotics on the ability of pathogenic bacteria to initiate and maintain the inflammatory response of the organism, the reaction of congenital and adoptive immunity. Data on the modification of the synthesis of cell wall components caused by antibiotics are considered in the context of modification of inflammatory responses and immune response to bacterial pathogens. Data on the effect of antibiotics with various mechanisms of antimicrobial action on the ability of bacterial pathogens sensitive and resistant to antimicrobial agents to induce the development of an inflammatory response and initiate the triggering of mechanisms of congenital and adoptive immunity are considered. Based on the literature data, the reasons for the low effectiveness of antibiotics and the mechanisms of inflammatory complications in their use in immunocompromised patients are analyzed, the need for a deeper understanding of the mechanisms of antibiotic action on inflammatory responses is substantiated, which in turn can contribute to the development of new approaches to the use of antibiotics. It is suggested that a combination of cell wall synthesis inhibitors and protein synthesis inhibitors can reduce some antibioticrelated complications of an inflammatory nature, with certain infections. The review also discusses the possibility that cell wall synthesis inhibitors that were previously considered ineffective in killing bacteria by themselves can be useful for modifying bacterial cell walls and can.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.