количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Эндометриоз и тазовая боль
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 3 (35)
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются эпидемиология, патогенез и клиническая картина эндометриоза. Обсуждаются возможности хирургического вмешательства и гормональной терапии в комплексном лечении заболевания. Отмечается необходимость долговременного лечения, направленного на купирование болевого синдрома как наиболее частого и специфичного симптома эндометриоза, с целью получения максимального эффекта и улучшения качества жизни пациенток.
Эндометриоз – присутствие эндометриоподобной ткани за пределами слизистой оболочки матки – занимает одно из ведущих мест в структуре гинекологических заболеваний. Предполагается, что общее число женщин в возрасте от 15 до 49 лет, страдающих этим заболеванием, в настоящее время достигло 176 млн [1]. С диагнозом «эндометриоз» выписываются 1,3 из 1000 пациенток стационара в возрасте от 15 до 44 лет [2]. Распространенность эндометриоза намного выше среди женщин с тяжелой дисменореей (50%) и хронической тазовой болью (75%), что подтверждает очевидную связь болевого симптома и наличия эндометриоидного поражения. Однако связь эта далеко не однозначна: распространенность процесса часто не соответствует выраженности симптома. Это побуждает всякий раз задаваться вопросом: какова цель лечения женщин с эндометриозом? Следует признать: одной из главных задач является не избавление от очагов эндометриоза, а улучшение качества жизни пациенток, следовательно, в первую очередь необходимо принимать во внимание именно симптомы заболевания.
Происхождение боли при эндометриозе нельзя объяснить только развитием спаечного процесса или попаданием частиц эндометрия и крови на брюшину. Вероятно, не столько сами эндометриоидные гетеротопии, сколько факторы, обусловливающие их выживание и инвазию, становятся причиной болевого симптома.
Эндометриоз считается заболеванием с наследственной предрасположенностью [3]. Согласно генетической теории эндометриоз – это результат аномального функционирования трех классов генов: генов, включенных в ксенобиотический метаболизм, генов, опосредующих воспалительные ответы, и генов, регулирующих действие стероидов [4]. Однако генетическая обусловленность не детерминирует имплантацию эндометриальных клеток, а только предполагает существование благоприятных условий, для того чтобы клетки, различными путями попавшие в чужеродную среду, не элиминировались, а продолжали свой жизненный цикл [5, 6].
Ответственность за создание таких условий во многом лежит на дисфункции иммунной системы [7], выражающейся в Т-клеточном иммунодефиците, угнетении функции Т-супрессоров, снижении активности натуральных киллеров (NK-клетки), активизации гиперчувствительности замедленного типа [8]. Макрофаги, скапливающиеся в перитонеальной жидкости у пациенток с эндометриозом, инициируют каскад реакций, в которые вовлекаются хемокины, цитокины и факторы роста [4]. Цитокины служат посредниками межклеточных взаимодействий, регулируют кроветворение, иммунный ответ, клеточный цикл в различных тканях. Интерлейкин 1 индуцирует синтез простагландинов, стимулирует пролиферацию фибробластов, накопление коллагена и образование фибриногена, то есть процессы, которые способствуют фиброзу и образованию спаек, характерных для эндометриоза.
Одновременно у больных эндометриозом обнаруживается полиморфизм генов, ассоциированных со снижением фибринолиза, следовательно, образование спаек оказывается не столько результатом функционирования гетеротопий, сколько следствием генных и иммунных поломок, лежащих в основе возникновения эндометриоза.
Одновременно у больных эндометриозом обнаруживается полиморфизм генов, ассоциированных со снижением фибринолиза, следовательно, образование спаек оказывается не столько результатом функционирования гетеротопий, сколько следствием генных и иммунных поломок, лежащих в основе возникновения эндометриоза.
В то же время эндометриальные клетки, в том числе и клетки эутопического эндометрия у женщин с эндометриозом, обладают особыми свойствами, позволяющими им выживать и агрессивно вести себя в окружении других тканей [9–11]. Этому способствуют внеклеточные события. При наружном эндометриозе имеют место значительные изменения в активности протеаз и ингибиторов протеаз перитонеальной жидкости [12]. Следствием этого становится изменение апоптоза при снижении экспрессии катепсинов и повышении активности их ингибиторов, увеличение инвазивного потенциала самого эндометрия из-за роста активности плазмина – одного из основных дезинтеграторов межклеточного матрикса. В результате эндометриальные клетки, попадая в перитонеальную жидкость с измененными свойствами, не подвергаются апоптозу и внедряются в брюшинный покров. Собственно, для эндометриальных клеток при эндометриозе характерны смещение баланса пролиферация/апоптоз в сторону пролиферации, сниженная рецепторная чувствительность к гормональным влияниям, способность к экспрессии ферментов стероидного биосинтеза, повышенная экспрессия различных ангиогенных [13] и ростовых факторов [14], усиливающих пролиферативный потенциал [15]. Факторы роста, содержание которых при эндометриозе меняется как в перитонеальной жидкости, так и в тканях, не только отражают активацию макрофагов, но и также мощно воздействуют на баланс процессов клеточной пролиферации и апоптоза. В очагах эндометриоза обнаруживается повышенная экспрессия сосудистого эндотелиального фактора роста, трансформирующего фактора роста бета, инсулиноподобного фактора роста 1, притом что концентрация связывающих ростовые факторы протеинов в эндометриоидных гетеротопиях оказывается сниженной по сравнению с нормальным эндометрием. Вместе с тем пролиферация поддерживается протоонкогенами, например онкопротеином С-myc, высокая экспрессия которого обнаружена в эндометриоидных гетеротопиях.
Кроме повышенной жизнеспособности клетки эндометриоидных гетеротопий обладают высокой инвазивной способностью. Вероятно, эта способность к инвазии, свойственная и нормальным эндометриальным клеткам, обусловлена активностью матриксных металлопротеиназ, которые стимулируют ангиогенез, то есть служат дополнительным фактором неоваскуляризации эндометриоидных имплантатов вместе с фактором роста фибробластов, интерлейкинами 6 и 8, сосудистым эндотелиальным фактором роста [4].
Таким образом, при генетической предрасположенности, обусловливающей агрессивное поведение эндометриальных клеток при вялом ответе системного иммунитета, на фоне избыточного воспаления [16, 17] и активного неоангиогенеза [13] у 10–20% женщин заброс менструальной крови в брюшную полость, метаплазия целомического эпителия или иное проникновение эндометриальных клеток в чужие ткани [18] завершается эндометриозом.
Пути внешнего влияния на аутокринную и паракринную регуляцию и межклеточное взаимодействие реализуются через систему гормонального контроля. Все описанные выше процессы, опосредуемые цитокинами, факторами роста, другими биологически активными веществами, зависят от концентрации и циклических колебаний стероидных гормонов. Гормонозависимость эндометриоза не следует понимать примитивно как стандартную реакцию на избыток эстрогенов и дефицит прогестерона. Надо учитывать, что в числе генетических детерминант заболевания есть и измененная реакция на стероидные гормоны. Эндометриоидные гетеротопии в меньшей степени чувствительны к гормонам, чем нормальный эндометрий. Это подтверждается снижением экспрессии рецепторов эстрадиола и прогестерона, прямо зависимой от степени удаленности очага поражения от матки. Более того, при эндометриозе наблюдаются генетически обусловленные аномалии рецептора прогестерона [19]. При снижении чувствительности к прогестерону эндометриоидные гетеротопии обладают способностью локального синтеза эстрогенов, в пользу которого свидетельствует наличие повышенной экспрессии ароматазы. Так, при эндометриозе создается прецедент не системного, а тканевого гормонального дисбаланса со смещением акцента в сторону пролиферативных эстрогеновых влияний.
Комплекс тканевых нарушений, характерных для эндометриоза, лежит в основе возникновения боли. Цитокины и макрофаги участвуют в повышении синтеза простагландинов, эстрогены поддерживают этот процесс, увеличивая активность циклооксигеназы 2. Избыточная концентрация простагландинов в тканях и системном кровотоке ответственна наряду с цитокинами за возникновение боли [4]. Не меньшую роль в формировании боли играют и сами эстрогены. Нейроны ганглиев дорсального рога имеют рецепторы эстрогенов типа альфа и бета [20]. Через эти нейроны эстрогены модулируют висцеро-висцеральную перекрестную сенситизацию, вовлекая тазовые органы в формирование хронического болевого синдрома [21]. Одновременно, нарушая баланс ноцицептивной и антиноцицептивной системы, эстрогены вызывают центральную сенситизацию. Эстрогенная зависимость боли объясняет преимущественное возникновение ее у женщин и вместе с тем частое выявление эстроген-зависимого эндометриоза при синдроме хронической тазовой боли.
Боль является наиболее частым и специфичным симптомом эндометриоза [22]. Она может носить циклический (дисменорея) и постоянный характер, ассоциироваться с половым актом (диспареуния), иррадиировать в поясничную область, крестец, копчик, задний проход, промежность. Тазовая боль при эндометриозе отличается разнообразием, зависящим в большей мере от локализации процесса, чем от степени его распространения. Так, даже крупные кисты яичников могут не проявляться болью и обнаруживаться случайно при проведении профилактического осмотра или ультразвукового исследования. В то же время минимальный эндометриоз тазовой брюшины, крестцово-маточных связок и/или прямокишечно-влагалищной перегородки в некоторых случаях сопровождается выраженным болевым синдромом.
Для ретроцервикального эндометриоза типичны боли в крестце (72%) с возможной иррадиацией в поясницу и верхние отделы живота, у 30% больных наблюдается тяжелая диспареуния. Боль достигает особой выраженности у пациенток с глубоким инфильтрирующим эндометриозом. Взаимосвязь между интенсивностью болевого синдрома и стадиями эндометриоза не установлена. Предменструальное/менструальное усиление боли – характерный, но не строго обязательный признак эндометриоза. Оценка степени выраженности боли всегда субъективна, но тем не менее именно субъективное представление о тяжелой, умеренной или легкой боли определяет тактику ведения пациентки. Объективизация выраженности болевого симптома имеет ценность в процессе наблюдения за эффектом терапии, при этом рекомендуется использовать визуальные аналоговые шкалы.
Эндометриоз является одной из ведущих причин формирования синдрома хронической тазовой боли, часто в сочетании с функциональными болевыми синдромами, включая синдром раздраженного кишечника, цисталгию и миалгию тазового дна [22]. Нарушения со стороны мочевыделительной системы или кишечника затрудняют дифференциальную диагностику, и здесь важно принять во внимание, что первоисточник тазовой боли далеко не всегда удается идентифицировать. У каждой третьей больной аденомиозом наблюдаются дизурические жалобы (учащенное мочеиспускание, недержание мочи). Нередкое сочетание эндометриоза с интерстициальным циститом и синдромом раздраженного кишечника привносит дополнительные симптомы в клиническую картину заболевания: цисталгию, дизурию, дисхезию (болезненная дефекация), расстройства стула. С одной стороны, наличие жалоб со стороны смежных органов всегда должны настораживать в отношении экстрагенитального эндометриоза [23], с другой – необходимо помнить об эстроген-зависимой тазовой гипералгезии и возможности существования иной причины боли, даже при наличии эндометриоза.
Длительная персистенция боли формирует синдром хронической тазовой боли, при котором боль наблюдается в течение 15 дней в месяц и более на протяжении шести последовательных месяцев. Хроническая боль способствует возникновению, поддержанию, усилению и фиксации эмоционально-личностных, в частности тревожно-депрессивных, нарушений, которые по принципу обратной связи усиливают и хронизируют боль, создавая порочный круг.
У 77,2% пациенток с эндометриозом отмечаются психоэмоциональные нарушения, среди них неустойчивое настроение, раздражительность, эмоциональная лабильность (55,6%), тревожность, фобии, бессонница (12,3%), ипохондрия, истерия, депрессия (9,3%). Длительное существование симптомов эндометриоза формирует психопатическую личность, характеризующуюся аутизацией, аффективной ригидностью и интравертированностью [24]. У 54,9% больных наблюдаются объективные симптомы вегетативной дисфункции. В структуре вегетативной дистонии преобладают кардиоваскулярные симптомы, дизрегуляторные расстройства деятельности желудочно-кишечного тракта, нарушения потоотделения. Психопатологические реакции при эндометриозе, ассоциированном с хронической тазовой болью, расцениваются как вторичные, усугубляющие субъективное ощущение боли, сопровождающиеся вегетативной дисфункцией и приводящие к дезадаптации женщин [25].
Учитывая значимость эутопического эндометрия как поставщика новых клеток для развития эндометриоза, логично предположить, что единственно радикальным способом лечения заболевания является удаление не только эндометриоидных гетеротопий, но и самого эндометрия. Однако этот подход не оправдывает себя у пациенток с хронической тазовой болью – неудачи гистерэктомии в купировании болевого синдрома связывают с периферической и центральной сенситизацией, приводящей к персистенции боли уже после удаления ее первичного очага [26].
Ведущим методом лечения эндометриоза сегодня признана органосохраняющая хирургическая тактика. Эксцизия и аблация эндометриоидных очагов имеют сравнимую эффективность [2] в купировании тазовой боли. Возможности хирургического лечения ограничены довольно высокой частотой рецидивов [27, 28]. Примерно у 50% больных боль возобновляется в течение ближайших пяти лет. От 20 до 40% женщин не отмечают облегчения тазовой боли после операции. Неблагоприятным прогностическим фактором является формирование хронической тазовой боли. Включение нейровоспаления в патогенез болевого симптома, формирование очага патологического возбуждения в коре головного мозга, развитие депрессивного расстройства на фоне длительно существующей боли значительно ухудшают прогноз любого вида лечения, в том числе и операции. Следует также придерживаться сформировавшегося на сегодняшний день положения, что операцию по поводу эндометриоза желательно проводить один раз, избегая повторных хирургических вмешательств [29].
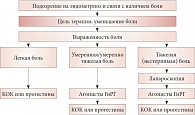
Ликвидация эндометриоидных гетеротопий представляет самостоятельную ценность в лечении эндометриоза. Однако если врач учитывает боль как главный симптом эндометриоза и следует принципу «лечить пациента, а не болезнь», то он индивидуально определяет тактику лечения (необходимость и объем оперативного лечения, метод супрессивной гормональной терапии). Появление новых терапевтических стратегий в настоящее время позволяет в некоторых ситуациях противопоставить грамотную гормональную терапию хирургическому вмешательству [30]. Бесспорным показанием к операции является тяжелая хроническая тазовая боль, которая обычно связана с глубоким инвазивным эндометриозом и структурными повреждениями тканей и поэтому не предполагает консервативного лечения. При умеренной и легкой тазовой боли у женщин, не планирующих беременность, возможно применение эмпирической гормональной терапии (рисунок).
Гормональная терапия боли, обусловленной эндометриозом, должна носить супрессивный характер, то есть подавлять овуляцию и эстрогенный биосинтез. Это связано с тем, что патогенез эндометриоза отличается от такового других эстроген-зависимых заболеваний. Одно из главных различий заключается в ассоциации эндометриоза с регулярной овуляцией и эстроген-зависимым воспалением. Даже в норме овуляция сопровождается воспалительной реакцией и выбросом в брюшную полость биологически активных веществ, провоцирующих пролиферативные и воспалительные процессы. По этой причине основа терапии – восстановление нормального овуляторного цикла с полноценной лютеиновой фазой – при эндометриозе не предупредит развитие рецидивов. Понимание механизмов развития эндометриоза и осознание его как воспалительного хронического заболевания [16, 17] привело к созданию концепции долговременной патогенетически обоснованной терапии, направленной на супрессию овуляции и эстрогенного биосинтеза.
Главные положения супрессивной гормональной терапии отражены в современных клинических руководствах разных стран [31–34] и сводятся к следующим постулатам. Гормональная терапия может стать альтернативой хирургическому лечению при наличии рецидива подтвержденного ранее эндометриоза (исключение касается кист яичников размером более 4 см и глубокого инфильтративного эндометриоза). Эмпирическая гормональная терапия может быть назначена при подозрении на эндометриоз в связи с жалобами на легкую или умеренно тяжелую боль. При положительном эффекте такой терапии через три месяца от ее начала гормональное лечение можно продолжить, не прибегая к операции. Гормональная терапия эндометриоз-ассоциированой боли эффективна только в тех случаях, когда ее продолжительность составляет не менее шести месяцев. Предоперационная гормональная терапия неэффективна и не рекомендована к применению в клинической практике. Послеоперационная гормональная терапия достоверно снижает частоту рецидивов эндометриоза в прямой зависимости от длительности ее проведения.
В гормонотерапии эндометриоза применяют антигонадотропины (даназол), агонисты гонадотропин-рилизинг гормона (ГнРГ), прогестины и комбинированные оральные контрацептивы [49].
Возможность использования контрацептивных препаратов обусловлена их способностью тормозить циклические процессы в яичниках, снижая тем самым влияние эндогенных эстрогенов. Наряду с этим прогестагенный компонент комбинированных оральных контрацептивов тормозит пролиферацию эпителия, что ведет к регрессу очагов эндометриоза. Клинические преимущества метода заключаются в его хорошей переносимости и наличии дополнительных положительных эффектов (например, уменьшение менструальной кровопотери и тяжести дисменореи). При долговременном лечении легкой и умеренно тяжелой тазовой боли (в основном дисменореи и диспареунии) эффективность комбинированных оральных контрацептивов сравнима с таковой у агонистов ГнРГ [35]. Оптимальный режим приема комбинированных оральных контрацептивов, позволяющий контролировать тазовую боль, – продленный или непрерывный прием [36]. В ряде проспективных исследований женщины с эндометриозом и дисменореей, сохранявшейся несмотря на циклический прием оральных контрацептивов, отметили существенное уменьшение симптомов при их непрерывном ежедневном использовании. Однако применение комбинированных оральных контрацептивов ограничено отсутствием соответствующего показания для лечения эндометриоза, недостатком данных об их эффективности [35]. Имеются предположения, что защитный эффект комбинированных оральных контрацептивов при эндометриозе приводит к отсрочке хирургической оценке заболевания в связи с временным подавлением болевых симптомов [37]. В этой связи комбинированные оральные контрацептивы применяются в лечении эндометриоза только у женщин, нуждающихся в предохранении от беременности [37], и считаются в этой группе пациенток терапией первой линии [31].
Прогестины, используемые для лечения эндометриоза (дидрогестерон, медроксипрогестерона ацетат, линестренол, норэтистерона ацетат, левоноргестестрел-высвобождающая внутриматочная система, диеногест), ингибируют рост эндометриоидной ткани, вызывают децидуализацию эндометрия, атрофию его железистого эпителия. Эффективность прогестинов при эндометриозе зависит от фармакологических характеристик, дозы и режима приема [38–40]. Низкие дозы прогестинов, назначаемые в циклическом режиме, хорошо переносятся, но эффективность их недостаточна. Высокоэффективные схемы приема прогестинов имеют ряд недостатков, которые снижают их переносимость: длительное восстановление фертильности (медроксипрогестерона ацетат), повышение массы тела, отеки, негативные метаболические реакции (производные нортестостерона, содержащие этинильный радикал, медроксипрогестерона ацетат), наличие противопоказаний, связанных со способом введения (внутриматочная левоноргестрел-содержащая система). Для всех прогестинов характерен плохой контроль цикла с частыми прорывными кровотечениями, что снижает приверженность лечению. На сегодняшний день наилучшим профилем эффективности/переносимости обладает диеногест, который рассматривают в качестве средства первой линии в долговременной терапии женщин с легкой и умеренно тяжелой тазовой болью.
Антигонадотропные препараты (даназол) подавляют выброс фолликулостимулирующего и лютеинизирующего гормонов, блокируют рецепторы эстрадиола в яичниках, повышают уровень свободного тестостерона в крови, индуцируя таким образом гипоэстрогенное и гиперандрогенное состояние, что приводит к регрессии эндометриоидных гетеротопий. Даназол относится к эффективным методам купирования боли при эндометриозе, но его высокая андрогенная активность обусловливает ряд побочных эффектов, среди которых негативное влияние на жировой и углеводный обмен, прибавка массы тела, гирсутизм и другие проявления андрогензависимых дермопатий [41]. По причине множественных побочных эффектов и ввиду наличия сходных по эффективности, но лучше переносимых препаратов даназол утратил популярность как метод лечения эндометриоза.
Агонисты ГнРГ изначально создавались как лекарственные средства, обладающие большей активностью и длительностью действия по сравнению с эндогенным ГнРГ. Однако оказалось, что длительное непрерывное введение агонистов ГнРГ обеспечивает лишь кратковременное повышение уровня гонадотропинов, а затем синтез и секреция фолликулостимулирующего и лютеинизирующего гормонов снижаются. Этот парадоксальный эффект, получивший название десенсибилизации, оказался полезным в лечении многих гормонозависимых гинекологических заболеваний. Но эффект агонистов ГнРГ не ограничивается опосредованным через гипофиз подавлением продукции эстрогенов в яичниках. Помимо гипофиза рецепторы к ГнРГ обнаружены в ряде тканей, в том числе яичниках, эндометрии, клетках злокачественных опухолей яичников и молочных желез. Следовательно, действие агонистов ГнРГ имеет также местный, тканевой характер. Комплексное воздействие на органы репродуктивной системы приводит к состоянию «медикаментозной псевдоменопаузы» и атрофии эндометрия, эктопических эндометриальных желез и стромы, что в итоге способствует устранению болевого синдрома и уменьшению распространенности эндометриоидных поражений у 75–92% больных [42]. Агонисты ГнРГ непосредственно влияют на передачу болевого сигнала и поэтому оказывают положительное влияние на течение болевых синдромов даже в отсутствие их связи с эндометриозом. Известно, что в патогенезе боли участвуют провоспалительные цитокины (фактор некроза опухоли, интерлейкин 6), хемокины, продукты иммунокомпетентных клеток (CCL2, CCL3, CCL5), которые реализуют свои эффекты как непосредственно воспалительной болевой реакцией, так и опосредованно – повышением болевой чувствительности нейрональных клеток [43]. Эстрогенная зависимость этих провоспалительных факторов и самой нейрональной чувствительности известна, поэтому создание гипоэстрогении оказывает независимое обезболивающее действие. Кроме того, в процесс передачи болевого сигнала, индуцируемого перечисленными факторами, вовлечены гены, экспрессия которых, как показывают исследования, модулируется агонистами ГнРГ и прогестинами, вероятно, посредством супрессии фактора некроза опухоли и интерлейкина 6 [44]. Таким образом, послеоперационная терапия тазовой боли представляется обоснованной, и при тяжелой тазовой боли предпочтение отдается агонистам ГнРГ.
Агонисты ГнРГ по праву считаются одним из наиболее эффективных и обладающих оптимальным профилем безопасности методов лечения эндометриоза [45, 46]. У женщин с хронической тазовой болью им отдается предпочтение при выборе эмпирической терапии умеренно тяжелой боли или в практике послеоперационного ведения больных с тяжелой тазовой болью, особенно ассоциированной с глубоким эндометриозом.
Прямые сравнительные исследования разных препаратов этой группы не проводились, и предполагается, что их клиническая эффективность сопоставима. К одним из наиболее изученных препаратов, широко применяемых в клинической практике, относится трипторелин (Диферелин® 3,75 мг, назначается внутримышечно по одной инъекции раз в 28 дней, Диферелин® 11,25 мг по одной инъекции раз в три месяца). Структура трипторелина близка к нативному ГнРГ и состоит из цепи десяти аминокислот, в которой только одна аминокислота-глицин в шестом положении заменена на D-триптофан. Относительная активность трипторелина превосходит нативный ГнРГ в 100 раз, а синтетические аналоги ГнРГ – в два раза [51].
Результаты российского открытого многоцентрового наблюдательного исследования с участием 1000 российских женщин в 52 центрах, имеющих диагноз «генитальный эндометриоз» первой – четвертой стадии и показание для длительной терапии препаратом Диферелин® 3,75 мг продемонстрировали эффективность и оптимальный профиль безопасности Диферелина. В исследовании препарат назначался по одной инъекции в 28 дней, а длительность терапии была индивидуальной в соответствии с решением лечащего врача и у большинства женщин составила четыре – шесть месяцев. Обобщенные результаты наблюдательного исследования показали, что в популяции, подлежащей лечению (intent-to-treat – ITT) к третьему визиту число пациенток, страдающих тазовой болью, уменьшилось в шесть раз по сравнению с первым визитом (952 и 151 пациентка соответственно). Проводимая терапия хорошо переносилась (наиболее встречающимся нежелательным явлением оказались приливы – 11,3%) [50].
С позиций послеоперационного ведения больных агонисты ГнРГ имеют преимущество в виде доказанного противоспаечного действия. Применение трипторелина в исследовании послеоперационной профилактики спаечного процесса сопровождалось существенным снижением факторов свертывания крови (PAI, TAFI, факторы V и VIII) и повышением уровня протеина С по сравнению с контрольной группой [47]. Эти данные объясняют продемонстрированную в клинических исследованиях противоспаечную эффективность агонистов ГнРГ.
Агонисты ГнРГ уникальны в универсальности своих эффектов на все гормонозависимые ткани [42, 48], в связи с чем они без ограничений могут быть рекомендованы при миоме матки, доброкачественных и злокачественных заболеваниях молочных желез, то есть в ситуациях, когда стероидная терапия неэффективна, нежелательна или противопоказана. Дислипидемии, повышение свертываемости крови и любые заболевания/состояния, ассоциированные с риском тромбозов и тромбоэмболических осложнений, также не являются противопоказанием для назначения этой группы препаратов. У больных с риском тромбоэмболических осложнений, вероятно, предпочтителен выбор трипторелина, поскольку он не оказывает отрицательного влияния на систему гемостаза и может рассматриваться как снижающее коагуляционный тромбогенный потенциал лекарственное средство [47].
Гипоэстрогения, индуцируемая приемом агонистов ГнРГ, – причина возникновения ряда побочных эффектов, таких как приливы жара, головная боль, повышенная утомляемость, бессонница, депрессия, потливость, сухость влагалища, ослабление либидо, снижение минеральной плотности костной ткани, ведущее к остеопении и остеопорозу. Побочные эффекты терапии порой существенно нарушают качество жизни больных, и для улучшения переносимости лечения или при планировании долговременного курса лечения, превышающего шесть месяцев, рекомендуется дополнительное назначение терапии прикрытия минимальными дозами эстрогенов в виде монотерапии, или в составе комбинированных эстроген-гестагенных препаратов, или тиболоном (add-back, возвратная терапия).
Гормональную терапию можно дополнять нестероидными противовоспалительными препаратами, иммуномодуляторами, физиотерапевтическими методами, психотропными средствами. В настоящее время нет однозначного подхода к выбору лечебной тактики при боли, ассоциированной с эндометриозом. Проблема далека от разрешения. Но оперативные технологии совершенствуются, а возможности фармацевтического рынка расширяются, и это дает надежду на успех в сохранении здоровья и улучшении качества жизни больных эндометриозом.
1. Адамян Л.В., Сонова М.М., Тихонова Е.С. и др. Медицинские и социальные аспекты генитального эндометриоза // Проблемы репродукции. 2011. № 6. С. 78–81.
2. Healey M., Ang W.C., Cheng C. et al. Surgical treatment of endometriosis: a prospective randomized double-blinded trial comparing excision and ablation // Fertil. Steril. 2010. Vol. 94. № 7. P. 2536–2540.
3. Hansen K.A., Eyster K.M. Genetics and genomics of endometriosis // Clin. Obstet. Gynecol. 2010. Vol. 53. № 2. P. 403–412.
4. Taylor R.N. Endometriosis // Yen and Jaffe’s reproductive endocrinology: physiology, pathophysiology, and clinical management / ed. by J.F. Strauss, R.L. Barbieri. 5th ed. Philadelphia: Elsevier Saunders, 2004. P. 691–711.
5. Hastings P.J., Lupski J.R., Rosenberg S.M. et al. Mechanisms of change in gene copy number // Nat. Rev. Genet. 2009. Vol. 10. № 8. P. 551–564.
6. Painter J.N., Zondervan K.T., Nyholt D.R. et.al. Genome-wide association study identifies a locus at 7p15.2 associated with endometriosis // Nat. Genet. 2011. Vol. 43. № 1. P. 51–54.
7. Berbic M., Fraser I.S. Regulatory T cells and other leukocytes in the pathogenesis of endometriosis // J. Reprod. Immunol. 2011. Vol. 88. № 2. P. 149–155.
8. Osuga Y., Koga K., Hirota Y. et al. Lymphocytes in endometriosis // Am. J. Reprod. Immunol. 2011. Vol. 65. № 1. P. 1–10.
9. Колотовкина А.В., Калинина Е.А., Коган Е.А. Морфофункциональные особенности эндометрия у больных эндометриозассоциированным бесплодием (обзор литературы) // Гинекология. 2012. № 4. С. 74–79.
10. Максимова Ю.В. Клинико-морфологическая характеристика изменений эутопического и эктопического эндометрия при распространенных формах генитального эндометриоза: автореф. дис. … д-ра мед. наук. М., 2010.
11. Carvalho L., Podgaec S., Bellodi-Privato M. et al. Role of eutopic endometrium in pelvic endometriosis // J. Minim. Invasive Gynecol. 2011. Vol. 18. № 4. P. 419–427.
12. Герасимов А.М. Одно из звеньев патогенеза бесплодия при наружном генитальном эндометриозе // Проблемы репродукции. 2004. № 4. С. 35–39.
13. Laschke M.W., Giebels C., Menger M.D. Vasculogenesis: a new piece of the endometriosis puzzle // Hum. Reprod. Update. 2011. Vol. 17. № 5. P. 628–636.
14. Jiang Q.Y., Wu R.J. Growth mechanisms of endometriotic cells in implanted places: a review // Gynecol. Endocrinol. 2012. Vol. 28. № 7. P. 562–567.
15. Cakmak H., Guzeloglu-Kayisli O., Kayisli U.A. et al. Immune-endocrine interactions in endometriosis // Front. Biosci. 2009. Vol. 1. P. 429–443.
16. Lousse J.C., van Langendonckt A.V., Defrere S. et al. Peritoneal endometriosis is an inflammatory disease // Front. Biosci. 2012. Vol. 4. № 1. P. 23–40.
17. Sacco K., Portelli M., Pollacco J. et al. The role of prostaglandin E2 in endometriosis // Gynecol. Endocrinol. 2012. Vol. 28. № 2. P. 134–148.
18. Signorile P.G., Baldi F., Bussani R. et al. Embryologic origin of endometriosis: analysis of 101 human female fetuses // J. Cell. Physiol. 2012. Vol. 227. № 4. P. 1653–1656.
19. Van Kaam K.J., Romano A., Schouten J.P. et al. Progesterone receptor polymorphism +331G/A is associated with a decreased risk of deep infiltrating endometriosis // Hum. Reprod. 2007. Vol. 22. № 1. P. 129–135.
20. Chaban V. Visceral sensory neurons that innervate both uterus and colon express nociceptive TRPV1 and P2X3 receptors in rats // Ethn. Dis. 2008. Vol. 18. № 2. Suppl. 2. P. 2–20.
21. Chaban V. Estrogen and visceral nociception at the level of primary sensory neurons // Pain Res. Treat. 2012. Vol. 2012. Pii. 906780.
22. Koninckx P.R. Chronic pelvic pain in gynaecology // www.obgyn.net/laparoscopy/chronic-pelvic-pain-gynaecology.
23. Chapron C., Bourret A., Chopin N. et al. Surgery for bladder endometriosis: long-term results and concomitant management of associated posterior deep lesions // Hum. Reprod. 2010. Vol. № 4. P. 884–889.
24. Herbert D.L., Lucke J.C., Dobson A.J. Depression: an emotional obstacle to seeking medical advice for infertility // Fertil. Steril. 2010. Vol. 94. № 5. P. 1817–1821.
25. Champaneria R., Daniels J.P., Raza A. et al. Psychological therapies for chronic pelvic pain: systematic review of randomized controlled trials // Acta Obstet. Gynecol. Scand. 2012. Vol. 91. № 3. P. 281–286.
26. Lamvu G. Role of hysterectomy in the treatment of chronic pelvic pain // Obstet. Gynecol. 2011. Vol. 117. № 5. P. 1175–1178.
27. Donnez J., Squifflet J. Complications, pregnancy and recurrence in a prospective series of 500 patients operated on by the shaving technique for deep rectovaginal endometriotic nodules // Hum. Reprod. 2010. Vol. 25. № 8. P. 1949–1958.
28. Kappou D., Matalliotakis M., Matalliotakis I. Medical treatments for endometriosis // Minerva Gynecol. 2010. Vol. 62. № 5. P. 415–432.
29. Berlanda N., Vercellini P., Fedele L. The outcomes of repeat surgery for recurrent symptomatic endometriosis // Curr. Opin. Obstet. Gynecol. 2010. Vol. 22. № 4. P. 320–325.
30. Vercellini P., Frattaruolo M.P., Somigliana E. et al. Surgical versus low-dose progestin treatment for endometriosis-associated severe deep dyspareunia II: effect on sexual functioning, psychological status and health-related quality of life // Hum. Reprod. 2013. Vol. 28. № 5. P. 1221–1230.
31. Practice bulletin № 114: management of endometriosis // Obstet. Gynecol. 2010. Vol. 116. № 1. P. 223–236.
32. Falcone T., Lebovic D.I. Clinical management of endometriosis // Obstet. Gynecol. 2011. Vol. 118. № 3. P. 691–705.
33. Leyland N., Casper R., Laberge P. et al. Endometriosis: diagnosis and management // J. Obstet. Gynaecol. Can. 2010. Vol. 32. № 7. Suppl. 2. P. 1–32.
34. Vercellini P., Crosignani P.G., Somigliana E. et al. ‘Waiting for Godot’: a commonsense approach to the medical treatment of endometriosis // Hum. Reprod. 2011. Vol. 26. № 1. P. 3–13.
35. Chapron C., Souza C., Borghese B. et al. Oral contraceptives and endometriosis: the past use of oral contraceptives for treating severe primary dysmenorrhea is associated with endometriosis, especially deep infiltrating endometriosis // Hum. Reprod. 2011. Vol. 26. № 8. P. 2028–2035.
36. Seracchioli R., Mabrouk M., Frasca C. et al. Long-term cyclic and continuous oral contraceptive therapy and endometrioma recurrence: a randomized controlled trial // Fertil. Steril. 2010. Vol. 93. № 1. P. 52–56.
37. Vercellini P., Eskenazi B., Consonni D. et al. Oral contraceptives and risk of endometriosis: a systematic review and meta-analysis // Hum. Reprod. Update. 2011. Vol. 17. № 2. P. 159–170.
38. Ferrero S., Camerini G., Ragni N. et al. Norethisterone acetate in the treatment of colorectal endometriosis: a pilot study // Hum. Reprod. 2010. Vol. 25. № 1. P. 94–100.
39. Harada M., Osuga Y., Izumi G. et al. Dienogest, a new conservative strategy for extragenital endometriosis: a pilot study // Gynecol. Endocrinol. 2011. Vol. 27. № 9. P. 717–720.
40. Schweppe K.W. The current place of progestins in the treatment of endometriosis // Expert Rev. Obstet. Gynecol. 2012. Vol. 7. № 2. P. 141–148.
41. Simoens S., Dunselman G., Dirksen C. et al. The burden of endometriosis: costs and quality of life of women with endometriosis and treated in referral centers // Hum. Reprod. 2012. Vol. 27. № 5. С. 1292–1299.
42. Тихомиров А.Л., Лубнин Д.М. Патогенетическое обоснование применения агонистов ГнРГ в терапии сочетанной гинекологической патологии // Вопросы гинекологии, акушерства и перинатологии. 2006. № 1. С. 82–87.
43. Sommer C., Kress M. Recent findings on how proinflammatory cytokines cause pain: peripheral mechanism in inflammatory and neurophatic hyperalgesia // Neurosci. Lett. 2004. Vol. 361. № 1–3. P. 184–187.
44. Matsuzaki S., Canis M., Pouly J.L. et al. Both GnRH agonist and continuous oral progestin treatments reduce the expression of the tyrosine kinase receptor B and mu-opioid receptor in deep infiltrating endometriosis // Hum. Reprod. 2007. Vol. 22. № 1. P. 124–128.
45. Strowitzki T., Marr J., Gerlinger C. et al. Dienogest is as effective as leuprolide acetate in treating the painful symptoms of endometriosis: a 24-week, randomized, multicentre, open-label trial // Hum. Reprod. 2010. Vol. 25. № 3. P. 633–641.
46. Zhao L., Wu H., Zhou X. et al. Effects of progressive muscular relaxation training оn anxiety, depression and quality of life of endometriosis patients under gonadotrophin-releasing hormone agonist therapy // Eur. J. Obstet. Gynecol. Reprod. Biol. 2012. Vol. 162. № 2. P. 211–215.
47. Di Nardo M.A., Annunziata M.L., Ammirabile M. et al. Pelvic adhesion and gonadotropin-releasing hormone analogue: effects of triptorelin acetate depot on coagulation and fibrinolytic activities // Reprod. Sci. 2012. Vol. 19. № 6. P. 615–622.
48. Ушакова Е.Л. Применение Люкрина депо при эндометриозе, миоме матки и других заболеваниях // Бесплодный брак: руководство / под ред. В.И. Кулакова. М.: ГЭОТАР-Медиа, 2005. С. 30–37.
49. Эндометриоз: диагностика, лечение и реабилитация. Федеральные клинические рекомендации по ведению больных. М., 2013.
50. Адамян Л.В., Андреева Е.Н., Яроцкая Е.Л. Клинический профиль российских пациенток с диагнозом «генитальный эндометриоз», получающих лечение агонистом гонадотропинового релизин гормона. Результаты российского открытого многоцентрового исследования // Проблемы репродукции. 2011. № 2. С. 50–62.
51. Schally A.V., Kastin A.J., Arimura A. Hypothalamic follicle-stimulating hormone and luteinizing hormone-regulating hormone: structure, physiology, and clinical studies // Fertil. Steril. 1971. Vol. 22. № 11. P. 703–721.
Endometriosis and pelvic pain
I.V. Kuznetsova
Research educational clinical center at I.M. Sechenov First Moscow state medical university
Contact person: Irina Vsevolodovna Kuznetsova, ms.smith.ivk@gmail.com
Here, epidemiology, pathogenesis and clinical picture of endometriosis are overviewed. An opportunity to apply surgical intervention and hormone therapy in combination therapy of endometriosis are discussed. It is noted that upon endometriosis a long-term treatment must be aimed at relieving pain syndrome as the most common and specific symptom, to obtain the best therapeutic effect and improve patient’s quality of life.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.