количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Эволюция гормональной терапии эндометриоза
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 2
- Аннотация
- Статья
- Ссылки
- English
Эндометриоз – хроническое рецидивирующее заболевание c множеством симптомов, значительно снижающее качество жизни. Стандартные методы медикаментозного и хирургического лечения эндометриоза направлены на удаление или уменьшение очагов эктопического эндометрия. Данное заболевание предполагает разработку плана долговременного ведения пациенток с целью профилактики рецидивов и повторного оперативного лечения. В статье приведен обзор данных литературы, посвященных гормональным препаратам, применяемым при генитальном эндометриозе.
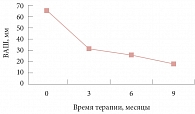
Рис. 1. Динамика профиля болевого синдрома по ВАШ на фоне приема диеногеста (2 мг)
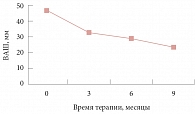
Рис. 2. Степень выраженности диспареунии по ВАШ на фоне приема диеногеста (2 мг)
Введение
Эндометриоз – доброкачественное разрастание ткани, функционально и морфологически подобной нормальному эндометрию. Для заболевания характерны повышенное локальное образование эстрогенов и чувствительность к ним, а также резистентность к прогестерону, что приводит к нарушению менструальной и репродуктивной функций, снижению качества жизни. Сопутствующий воспалительный процесс, иммунологическая дисрегуляция, ингибирование апоптоза, активация ангиогенеза – патогенетические факторы, способствующие выживанию и росту эндометриоидных имплантов. Эндометриозом страдают 6–10% женщин репродуктивного возраста, при хронических тазовых болях и бесплодии – 40–70% и 30–50% соответственно [1, 2].
Гормональные препараты в лечении эндометриоза
Одной из наиболее актуальных проблем современной гинекологии остается лечение эндометриоза. Отсутствие устоявшихся взглядов на этиологию и патогенез заболевания, а также частое сочетание эндометриоза и гиперпластических процессов в эндо- и миометрии затрудняют выбор адекватной терапии [3]. Хирургическое вмешательство считается основным методом лечения, однако высок риск рецидивов (40–50% в течение пяти лет) [4]. Альтернативой хирургическому лечению при симптомах, характерных для эндометриоза, и отсутствии абсолютных показаний к оперативному лечению выступает гормонотерапия. Гормонотерапию применяют также в качестве послеоперационной адъювантной терапии с целью снижения риска возникновения рецидивов.
Обычно эндометриоз развивается на фоне относительной и абсолютной гиперэстрогении при дефиците прогестерона. Именно поэтому патогенетической основой гормональной терапии является временное угнетение функции яичников, то есть уменьшение секреции эстрадиола – создание псевдоменопаузы за счет блокады гипофизарно-яичниковой системы с инициацией гипоэстрогении, приводящее к регрессу очагов эндометриоза [5].
Первые сообщения о выключении функции яичников были опубликованы в 1928 г., когда H. Alberht для лечения эндометриоза использовал рентгеновское облучение. Однако из-за большого количества осложнений внедрить этот метод не удалось [6].
На основании наблюдений за клиническими проявлениями эндометриоза, при котором исчезали симптомы, впервые в 1948 г. K. Karnaky применил высокие дозы эстрогенов, в частности введение в течение 2–26 недель [3] диэтилстильбэстрола по 100 мг в день с комплексом витаминов группы B. Наряду с удовлетворительными клиническими результатами и полной регрессией очагов эндометриоза большие дозы эстрогенов вызывали гиперпластические процессы в эндометрии с кровотечениями, мастопатию, увеличение массы тела, тромбофилические осложнения, новообразования у девочек, родившихся у матерей, получавших такое лечение.
В 1950-х гг. было предложено применять андрогены – метилтестостерон по 5–10 мг в день непрерывно в течение шести месяцев. Терапия оказалась достаточно эффективной: тазовые боли, дисменорея, диспареуния, меноррагия исчезли у 80% больных. Тем не менее побочные эффекты андрогенов в виде гипертрихоза, увеличения клитора, огрубения голоса заставили отказаться от этого лечения [3].
Следующим этапом в лечении эндометриоза стало применение комбинированных оральных контрацептивов (КОК), впервые использованных для этой цели R. Kistner в конце 1950-х гг. [7]. Механизм действия КОК обусловлен блокадой синтеза гонадотропных гормонов гипофизом: блокируются созревание фолликула и овуляция, замедляется синтез эстрогенов в яичниках, подавляется пролиферация эндометрия вплоть до его атрофии [5]. Как показали результаты исследований, на фоне применения КОК в эндометрии происходят быстрая регрессия пролиферативной фазы, раннее развитие секреторных изменений, уплотнение стромы с последующими атрофическими процессами. Такие изменения клинически выражались уменьшением болей и менструальной кровопотери. Имеются сообщения о том, что КОК снижают вероятность приживления эндометриоидных гетеротопий. Эти данные обусловили применение КОК при эндометриозе, которое продолжается до сих пор [8].
Дальнейшее изучение процессов синтеза стероидных гормонов и их метаболизма способствовало созданию новых медикаментозных средств для лечения дисгормональных заболеваний женской половой сферы. Первым соединением, синтезированным C. Djerassi, был 17-альфа-этинил-19-нортестостерон (норэтистерон) [9], ставший родоначальником целого поколения 19-норстероидов. Следующим стал норгестрел (производное 19-нортестостерона второй генерации). Затем был синтезирован левоноргестрел, активный не только при пероральном применении, но и при локальном действии в полости матки в составе внутриматочной системы Мирена. Преимущества локального введения левоноргестрела позволяют использовать внутриматочную систему Мирена у пациенток с противопоказаниями к применению оральных контрацептивов (метаболические нарушения, варикозная болезнь, гипертония, курение). При эндометриозе применяются также производные 19-нортестостерона – норэтистерон, диеногест.
Множество публикаций, связанных с терапией эндометриоза, посвящено даназолу. В 1971 г. опубликовано первое сообщение о его применении в лечении эндометриоза. Препарат является синтетическим производным 17-этинилтестостерона. Он оказывает не только прогестагенное, но и антигонадотропное действие [3, 5] с последующей гипоэстрогенией и атрофией эутопического и эктопического эндометрия. Соединяясь с глобулином, связывающим половые стероиды, даназол вытесняет тестостерон, превращая его в биологически активную субстанцию и обеспечивая воздействие на эндометриоидные очаги [10] с развитием аменореи через один-два месяца. Согласно данным ряда исследований, интравагинальная форма даназола в виде вагинального кольца эффективно снимает болевой синдром при аденомиозе, ретроцервикальной и ретровагинальной локализациях эндометриоза. Кроме обычного анаболически-андрогенного эффекта, присущего даназолу, описаны случаи церебрального, коронарного, артериального и венозного тромбоза, а также фатального гепатита. Имеются исследования, указывающие на возможную связь между лечением даназолом и яичниковыми новообразованиями [11]. Результаты исследований, в ходе которых изучали роль факторов ангиогенеза и факторов роста в развитии эндометриоза, демонстрируют, что даназол, возможно, участвует в ингибировании ангиогенеза [12].
Широкое распространение в лечебной практике получил также препарат гестринон, являющийся производным 19-норстерона и оказывающий одновременно андрогенное, прогестагенное, антипрогестагенное и антиэстрогенное действие [5]. Полагают, что в основе механизма его действия лежат снижение уровня эстрогенов и прогестерона, повышение уровня свободного тестостерона, снижение клеточной активности и атрофия эндометриоидных гетеротопий. Как правило, аменорея на фоне приема гестринона наступает со второго месяца применения препарата. Препарат характеризуется высокой клинической эффективностью, побочные эффекты аналогичны таковым даназола [13].
С начала 1980-х гг. для лечения эндометриоза используют агонисты гонадотропин-рилизинг-гормона, которые по заключению Международного консенсуса по лечению эндометриоза в Зальцбурге (2005) до недавнего времени считались «золотым стандартом» медикаментозной терапии. Данная фармакологическая группа представлена широким спектром препаратов c разным способом введения:
- эндоназальная форма (нафарелин, бусерелин, синарел);
- депо-формы (гозерелин, трипторелин).
Однако при их применении свыше шести месяцев (без «возвратной» (add-back) терапии эстрогенами) возникают нежелательные гипоэстрогенные эффекты: приливы, сухость влагалища, головная боль, снижение либидо, потеря минеральной плотности костной ткани [14].
Следующая группа препаратов – антагонисты гонадотропин-рилизинг-гормона, которые сразу после введения тормозят синтез гонадотропинов с последующим угнетением функции яичников. Предполагается также, что антагонисты гонадотропин-рилизинг-гормона, как и агонисты, участвуют в регуляции процессов апоптоза и неоангиогенеза, нарушенных при эндометриозе. По сравнению с аналогами антагонисты гонадотропин-рилизинг-гормона характеризуются быстрым наступлением клинического эффекта – через две-четыре недели от начала терапии, а также отсутствием периода стимуляции аденогипофиза – кровотечения «прорыва» [15].
На стадии изучения и внедрения находятся препараты антипрогестагенного ряда. С момента синтеза мифепристона (RU486) в лабораториях компании Rousell Uclaf (Франция, 1980) продолжаются исследование и синтез так называемых селективных модуляторов прогестероновых рецепторов. В России препарат зарегистрирован под торговыми названиями Мифегин, Мифолиан, Пенкрофтон, Мифепрекс. Изначально эти препараты использовались для прерывания беременности. Продолжаются исследования и относительно применения их в лечении эндометриоза. Показано, что мифепристон и другие препараты этого ряда, в частности азопризнил в дозах 10 и 25 мг, эффективно уменьшают интенсивность тазовых болей, возможно оказывая тканеселективный эффект при эндометриоз-ассоциированном болевом синдроме.
Ингибиторы ароматазы можно также отнести к группе антиэстрогенов. Ароматаза – фермент, превращающий андрогены в эстрогены, один из ферментов стероидогенеза, связанных с цитохромом Р450 [16]. По данным последних исследований, ароматазе отводится ключевая роль в цепи порочного круга биохимических превращений нормальных клеток эндометрия в эндометриоидные. Примечательно, что ароматазу находят в эктопических очагах, но не в эутопическом эндометрии. Описаны случаи успешного лечения эндометриоза различных локализаций у женщин пременопаузального возраста анастрозолом в комбинации с витаминами и противовоспалительными средствами. Применение ингибиторов ароматазы при эндометриозе требует дальнейшего изучения для широкомасштабного внедрения [17].
Стратегия лечения эндометриоза
К сожалению, изолированное применение консервативных методов лечения не приводит к полному избавлению от эндометриоза. Лечение эндометриоза на первом этапе должно включать хирургическое удаление гетеротопий. На втором этапе целесообразно применение гормональной терапии. Эндометриоз традиционно считают персистирующим, рецидивирующим заболеванием, требующим длительного лечения. Ведущие специалисты международных обществ, памятуя о безопасности и степени переносимости препаратов, к терапии первой линии относят КОК и прогестагены [18, 19].
Во-первых, прогестагены оказывают центральное воздействие – угнетают систему «гипоталамус – гипофиз – яичники», вследствие чего снижается секреция эстрогенов. Во-вторых, при непрерывном применении они влияют непосредственно на очаги эндометриоза, вызывая дифференциацию стромальных клеток (децидуализацию) и атрофию железистого компонента эндометрия. В-третьих, прогестагены активируют фермент 17-бета-гидроксистероиддегидрогеназу, преобразующий эстрадиол в слабый эстрон, что меняет эстрогенный баланс на локальном уровне [20]. Прогестагены блокируют также ключевые звенья патогенеза – пролиферацию, ангиогенез и воспаление.
Диеногест относят к прогестагенам IV поколения. Он сочетает в себе свойства производных 19-нортестостерона (доказаны высокая селективность и антипролиферативная активность, короткий период полувыведения из кровотока, высокая биодоступность при пероральном применении, низкий риск кумуляции при ежедневном приеме) и прогестерона (хорошая переносимость, отсутствие негативных метаболических, сосудистых и печеночных эффектов) [21].
Рандомизированные контролируемые клинические исследования продолжительностью от 12 до 24 недель позволили получить информацию об оптимальной эффективной дозе препарата (2 мг/сут) и подтвердили его хорошую переносимость. По данным визуальной аналоговой шкалы (ВАШ, visual analogue scale – VAS), эта доза купирует вызванную эндометриозом боль: дисменорею, диспареунию, диффузную тазовую боль. Подобный эффект связан с атрофией эндометриоидных очагов по шкале оценки тяжести эндометриоза R-AFS (Revised Classification of American Fertility Society) [22, 23].
В исследовании, проведенном в Европе, 252 пациентки с эндометриозом получали диеногест (2 мг/сут) или лейпролида ацетат в форме депо в стандартной дозе (3,75 мг внутримышечно каждые четыре недели). Лечение сопровождалось сходным по продолжительности уменьшением тазовой боли. К 24-й неделе терапии среднее значение показателя ВАШ снизилось до 47,5 мм для диеногеста и до 46,0 мм для лейпролида ацетата в форме депо. Отмечалось также выраженное улучшение физического и ментального благополучия по данным анкетирования (SF-36, The Short Form – 36, модифицированный опросник здоровья). В группе женщин, получавших лейпролида ацетат в форме депо, выявлено снижение среднего показателя минеральной плотности костной ткани в пояснично-крестцовом отделе позвоночника, в то время как на фоне диеногеста отмечался небольшой прирост. Через шесть месяцев установлены достоверные межгрупповые различия. На фоне приема лейпролида ацетата в форме депо число дней с приливами составило в среднем 4,7 в неделю, на фоне приема диеногеста – лишь 0,82 [22].
Таким образом, прогестаген, схожий по эффективности с агонистами гонадотропин-рилизинг-гормона и не вызывающий неблагоприятных гипоэстрогенных побочных эффектов, можно длительно использовать для лечения болевого синдрома и профилактики рецидивов эндометриоза. Высокая эффективность терапии, немногочисленные побочные действия, возможность длительного использования делают диеногест оптимальным для лечения эндометриоза.
Материалы и методы
На базе ГКБ № 50 г. Москвы с 2011 по 2013 г. наблюдались 62 женщины в возрасте от 18 до 45 лет с лапароскопически и гистологически верифицированным диагнозом наружного генитального эндометриоза I–IV степени распространения согласно классификации R-AFS. Все операции были выполнены лапароскопическим методом. Пациентки в послеоперационном периоде получали диеногест (2 мг в сутки перорально в непрерывном режиме). Общая продолжительность лечения составила девять месяцев. Часть пациенток продолжают принимать его и в настоящее время.
Тазовая боль при эндометриозе – ключевой параметр, негативно влияющий на качество жизни больных. Его трудно объективизировать, поскольку выраженность болевых ощущений носит субъективный характер ввиду индивидуальных различий порога болевой чувствительности.
Для количественной оценки болевых симптомов, определения тяжести и интенсивности боли мы использовали ВАШ с градацией боли от 0 (нет боли) до 100 мм (нестерпимая боль).
Оценку проводили перед лечением и каждые три месяца терапии. Каждая пациентка оценивала по ВАШ отдельно следующие параметры: тяжесть дисменореи, диспареунии и интенсивность хронической тазовой боли. Кроме того, оценивались побочные эффекты лечения, проводились гинекологический осмотр и ультразвуковое исследование органов малого таза трансвагинальным датчиком.
Все пациентки в период терапии должны были использовать барьерный метод контрацепции. Критериями исключения из исследования стали беременность и лактация, злокачественные новообразования или подозрения на таковые, экстрагенитальная патология в стадии декомпенсации и системные заболевания.
Результаты
Средний возраст больных составил 30 ± 7,65 года, индекс массы тела – 19,5 ± 3,9 кг/м². По тяжести заболевания пациентки распределились следующим образом: 58% имели генитальный эндометриоз I–II стадии по R-AFS, 42% – III–IV стадии.
До начала лечения пациентки оценивали болевой синдром по ВАШ как 65,3 ± 11,5 мм. Средние измерения интенсивности тазовых болей к концу лечения составили -18,45 ± 3,6 мм (р < 0,05).
Динамика регресса болевого синдрома после комплексного лечения представлена на рисунке 1. Оценка выраженности диспареунии оценивалась также через три, шесть и девять месяцев от начала терапии (рис. 2). Этот параметр, угнетающий качество половой жизни, достоверно улучшался при проведении лечения. Однако 7% пациенток отмечали снижение либидо в течение первых трех месяцев приема препарата.
Через три месяца среднее значение ВАШ снижалось по сравнению с исходным на 26 мм (39,8%), что статистически значимо (р < 0,05), через шесть месяцев – на 5 мм (7,6%), через девять – на 13 мм (19%).
При лечении диеногестом 33% женщин жаловались на побочные эффекты. Из них наиболее частыми (26%) были метроррагии (включая скудные выделения) обычно в первые месяцы приема препарата. Головные боли впервые отметили 4% женщин, повышенную эмоциональную лабильность – 13%, снижение либидо – 7%.
Клиническая эффективность диеногеста проявлялась в регрессе тазовых болей и наблюдалась в течение девяти месяцев лечения. Через девять месяцев с момента окончания терапии у пациенток не отмечалось рецидива исходного уровня болей. В этот же период у пяти пациенток наступила самопроизвольная беременность.
Заключение
Таким образом, комплексное лечение, включающее хирургический метод с последующей гормонотерапией современными препаратами, можно длительно использовать при болевом синдроме, а также в качестве профилактики рецидивов эндометриоза.
1. Giudice L.C. Clinical practice. Endometriosis // N. Engl. J. Med. 2010. Vol. 362. № 25. P. 2389–2398.
2. Littman E., Giudice L., Lathi R. et al. Role of laparoscopic treatment of endometriosis in patients with failed in vitro fertilization cycles // Fertil. Steril. 2005. Vol. 84. № 6. P. 1574–1578.
3. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. М.: МИА, 2000.
4. Guo S.W. Recurrence of endometriosis and its control // Hum. Reprod. Update. 2009. Vol. 15. № 4. P. 441–461.
5. Адамян Л.В., Кулаков В.И. Эндометриозы: руководство для врачей. М.: Медицина, 1998.
6. Торубаров С.Ф. Состояние локального иммунитета у больных наружным генитальным эндометриозом: автореф. дис. … канд. мед. наук. М., 2000.
7. Kistner R.W. The use of newer progestins in the treatment of endometriosis // Am. J. Obstet. Gynecol. 1958. Vol. 75. № 2. P. 264–278.
8. Mahutte N.G., Arici A. Medical management of endometriosis-associated pain // Obstet. Gynecol. Clin. North Am. 2003. Vol. 30. № 1. P. 133–150.
9. Djerassi C., Miramontes L., Rosenkranz G. Abstracts of Papers, Division of Medicinal Chemistry, Milwaukee, American Chemical Society. Washington, DC, 1952. № 25. P. 18J.
10. Кареева Е.Н. Молекулярные механизмы действия женских половых стероидов и их антагонистов: автореф. дис. ... докт. мед. наук. М., 2003.
11. Cottreau C.M., Ness R.B., Modugno F. et al. Endometriosis and its treatment with danazol or lupron in relation to ovarian cancer // Clin. Cancer. Res. 2003. Vol. 9. № 14. P. 5142–5144.
12. Matalliotakis I.M., Goumenou A.G., Koumantakis G.E. et al. Serum concentrations of growth factors in women with and without endometriosis: the action of anti-endometriosis medicines // Int. Immunopharmacol. 2003. Vol. 3. № 1. P. 81–89.
13. Адамян Л.В. Опыт применения гестринона в комбинированном лечении распространенных форм эндометриоза. Гормональная терапия эндометриоза. М., 1993.
14. Sagsveen M., Farmer J.E., Prentice A. et al. Gonadotrophin-releasing hormone analogues for endometriosis: bone mineral density // Cochrane Database Syst. Rev. 2003. Vol. 4. CD001297.
15. Kupker W., Felberbaum R.E., Krapp M. et al. Use of GnRH antagonists in the treatment of endometriosis // Reprod. Biomed. Online. 2002. Vol. 5. № 1. P. 12–16.
16. Frackiewicz E.J., Zarotsky V. Diagnosis and treatment of endometriosis // Expert Opin. Pharmacother. 2003. Vol. 4. № 1. P. 67–82.
17. Racine A.C., Legrand E., Lefebvre-Lacoeuille C. et al. Treatment of endometriosis by aromatase inhibitors: efficacy and side effects // Gynecol. Obstet. Fertil. 2010. Vol. 38. № 5. P. 318–323.
18. Leyland N., Casper R., Laberge P. et al. Endometriosis: diagnosis and management // J. Obstet. Gynaecol. Can. 2010. Vol. 32. № 7. Suppl. 2. P. S1–32.
19. Practice bulletin no. 114: management of endometriosis // Obstet. Gynecol. 2010. Vol. 116. № 1. P. 223–236.
20. Bulun S.E. Endometriosis // N. Engl. J. Med. 2009. Vol. 360. № 3. P. 268–279.
21. Sasagawa S., Shimizu Y., Kami H. et al. Dienogest is a selective progesterone receptor agonist in transactivation analysis with potent oral endometrial activity due to its efficient pharmacokinetic profile // Steroids. 2008. Vol. 73. № 2. P. 222–231.
22. Strowitzki T., Marr J., Gerlinger C. et al. Dienogest is as effective as leuprolide acetate in treating the painful symptoms of endometriosis: a 24-week, randomized, multicentre, open-label trial // Hum. Reprod. 2010. Vol. 25. № 3. P. 633–641.
23. Kohler G., Faustmann T.A., Gerlinger C. et al. A dose-ranging study to determine the efficacy and safety of 1, 2, and 4 mg of dienogest daily for endometriosis // Int. J. Gynaecol. Obstet. 2010. Vol. 108. № 1. P. 21–25.
Evolution of hormone therapy of endometriosis
M.M. Sonova, A.V. Laskevich, N.M. Shamugiya
Moscow State University of Medicine and Dentistry named after prof. A.I. Evdokimov
City Clinical Hospital No 50, Moscow
Contact person: Marina Musabiyevna Sonova, sonova@rambler.ru
Endometriosis is a chronic relapsing disease characterized by a number of symptoms that severely reduces quality of life. Basic methods of medicated and surgical treatment of endometriosis are aimed at excision or reduction of sites of ectopic endometrium. Such disease supposes development of a long-term maintenance strategy for patients in order to prevent relapses as well as administration of repeated surgical treatment.
Here we provide with an overview of available publications on hormone drugs used under genital endometriosis.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.