Эволюция сна от простых форм до млекопитающих
- Аннотация
- Статья
- Ссылки
- English

У млекопитающих и птиц сон состоит из двух подстадий – медленноволнового сна (МС) и парадоксального сна (ПС) (или быстрого сна, или стадии быстрых движений глаз). Разные виды млекопитающих проводят во сне от двух до 20 часов в сутки, а птицы – от пяти до 17 часов. Попытки установить корреляции параметров сна с анатомо-физиологическими характеристиками млекопитающих и птиц, а также с условиями сна до сих пор были не очень успешными [1–6]. Во многом это определяется тем, что данные о продолжительности сна и его стадий получены в основном в лабораторных условиях. Они не учитывают все многообразие внешних факторов, влияющих на сон животных в природе. Корреляционные отношения не всегда указывают и на причинно-следственные связи. Приходится признать, что функция и биологическая роль сна до конца не понятны. Задача этого обзора – обобщить результаты наиболее интересных сравнительно-физиологических исследований сна, выполненных в последние два десятилетия. Дополнительная информация может быть найдена в оригинальных работах и других обзорах, ссылки на которые находятся в списке цитируемой литературы.
Сон у беспозвоночных
На сегодняшний день состояние поведенческого сна изучено у нескольких десятков видов беспозвоночных [7–9]. У всех исследованных видов поведенческий сон имеет такие же признаки, как у млекопитающих и птиц, включая неподвижность, типичную позу, сниженную реакцию на раздражители. Продолжительность сна увеличивается после навязанной двигательной активности (признак гомеостатической регуляции). Препараты с седативным эффектом удлиняют время сна, а стимуляторы, наоборот, сокращают. Как и у млекопитающих, наибольшее количество сна у беспозвоночных отмечается на ранних этапах развития и постепенно снижается с возрастом [8–13]. Формальные поведенческие характеристики сна наблюдаются даже у медуз – простых форм с децентрализованной нервной системой, которые существуют на Земле уже более 600 млн лет [14]. Следовательно, основные признаки поведенческого сна у животных сформировались в эволюции еще до появления централизованной нервной системы.
У нескольких видов беспозвоночных были зарегистрированы также электрофизиологические признаки сна. Например, снижение двигательной активности и рост порогов пробуждения у фруктовой мушки происходили параллельно уменьшению амплитуды электрической активности (локальные потенциалы в диапазоне 11–40 Гц) грибовидного тела и замедлению уровня метаболизма. Депривация сна приводила к отдаче – снижению амплитуды электрической активности головного мозга и росту порогов пробуждения [15–17]. У речного рака развитие поведенческого сна происходило, наоборот, параллельно с ростом амплитуды электрической активности (в диапазоне 8–9 Гц) головного мозга [18]. По формальным признакам это состояние напоминает МС у млекопитающих, поскольку в обоих случаях есть признаки увеличения когерентности электрических потенциалов мозга. У пчелы спонтанная активность зрительных интернейронов мозга днем в период активности была выше, чем в период покоя в ночное время. Более того, если в дневное время эти нейроны реагировали на каждое предъявление зрительного стимула, то в ночное время были периоды, когда реакция на стимулы отсутствовала [19].
Состояние сна у беспозвоночных – не однородный процесс. В этом тоже есть сходство со сном млекопитающих и птиц. Например, у пчелы в течение всего ночного периода покоя тонус шейных мышц изменяется циклически, временами практически достигая нуля [10]. У дрозофилы величина порогов пробуждения зависит от длительности эпизода сна [16].
В литературе встречаются упоминания о стереотипных движениях глаз у находящихся в состоянии поведенческого сна каракатиц [20], а также подергивании антенн и конечностей у пчел [21] и муравьев [22]. Во всех работах обращается внимание на некоторое сходство этих движений со вздрагиваниями у млекопитающих в ПС. Однако подобное поведение у беспозвоночных никогда детально не анализировалось.
Таким образом, по поведенческим и некоторым физиологическим критериям состояние сна есть у всех исследованных беспозвоночных, включая организмы с децентрализованной нервной системой. По формальным признакам это состояние имеет сходство с МС млекопитающих и птиц.
Сон у рыб
Эпизоды неподвижности определенной длительности (поведенческий сон) у рыб характеризуются ухудшением способности реагировать на внешние раздражители. Поведенческий сон рыб имеет признаки гомеостатической и циркадианной регуляции. Его суммарная длительность увеличивается под действием мелатонина и диазепама и уменьшается под действием гипокретина. Наибольшая общая продолжительность эпизодов сна у рыб наблюдается на ранних этапах постнатального развития и постепенно снижается с возрастом [23–25].
Длительность поведенческого сна у рыб варьируется в большом диапазоне. Например, у обитающих в пещерных водоемах мексиканских рыбок (Astyanax mexicanus) на поведенческий сон приходится в пять раз меньше времени, чем у рыб того же вида, живущих в реках [26]. Меньшая продолжительность сна у рыб пещерных популяций определяется большим числом гипокретинсодержащих нейронов в гипоталамусе. Торможение активности нейронов приводит к увеличению времени сна [27]. Разрушение рецепторов боковой линии, наоборот, повышает продолжительность сна у пещерных форм до уровня речных рыбок, что указывает на важную роль сенсорной информации в регуляции количества сна [8]. Результаты этих исследований раскрывают молекулярно-генетические и нейронные механизмы регуляции продолжительности сна, а также консервативность нейрохимических систем мозга, регулирующих фенотип сна у разных животных. Эволюция сна пещерной формы мексиканской рыбки, которая происходила в течение примерно 2–3 млн лет, – прекрасный пример влияния экологических факторов (дефицит корма, обитание в темноте) на продолжительность сна и его суточную динамику.
Данные об электрофизиологических аспектах сна у рыб противоречивы. Медленные волны и острые спайки были зафиксированы во время поведенческого сна у сома [28]. В других работах однонаправленных изменений электрической активности не регистрировалось [7]. В одном из первых исследований сна у рыб были описаны стереотипные движения глаз и сделано предположение о наличии у них ПС [29]. Однако позже эти результаты не подтвердились [28, 30]. Анатомические и молекулярные исследования показали большое сходство в организации активирующих (холинергической, моноаминергической, гипокретиновой) и сомногенных (мелатониновой) систем мозга у рыб и позвоночных [24, 31].
Сон у амфибий
Исследований сна у амфибий крайне мало. У одних видов признаков поведенческого сна обнаружено не было. У других такие признаки были, но не было электрофизиологических коррелятов. Наконец, поведенческие признаки сна параллельно с характерными волнами-спайками в ЭЭГ были описаны у жабы и лягушки [7, 28, 32]. Имеющиеся данные скорее указывают на наличие поведенческого сна у амфибий, тогда как данных об электрофизиологических коррелятах недостаточно.
Сон у рептилий
Высокоамплитудные спайки на электроэнцефалограмме (ЭЭГ), напоминающие медленные волны у млекопитающих, были зарегистрированы на фоне поведенческого сна у многих видов пресмыкающихся, включая каймана, игуану, черепаху и змею [7, 32]. Фармакологические исследования продемонстрировали, что реакция ЭЭГ-спайков у рептилий на сомногенные препараты такая же, как и гиппокампальных спайков (аналогов корковой медленноволновой ЭЭГ) у кошки. Частота ЭЭГ-спайков у рептилий также увеличивалась после навязанного бодрствования [33].
Признаки ПС у рептилий в ранних исследованиях отмечались редко. Одним из аргументов в пользу отсутствия этой стадии сна у рептилий было и наше исследование динамики разряда изолированных нейронов в цикле «сон – бодрствование» у черепах. Нам не удалось обнаружить признаки повторяющейся активации нейронов ретикулярной формации – ключевого признака ПС у млекопитающих ‒ у черепах во время периодов естественного сна [34]. Тем не менее как минимум у двух видов черепах сон был разделен на две стадии – МС и ПС [35, 36]. Недавно у двух видов ящериц были зарегистрированы повторяющиеся движения глаз во время поведенческого сна. Эпизоды наблюдались с интервалом 80 секунд и сопровождались снижением амплитуды ЭЭГ-спайков. Флуоксетин (ингибитор обратного транспорта серотонина, укорачивает время ПС у млекопитающих) уменьшал амплитуду ЭЭГ-спайков [37, 38]. По мнению авторов, такие эпизоды имеют признаки ПС млекопитающих. Природа регулярного чередования двух стадий сна с подобным коротким периодом не понятна и не имеет аналогов у млекопитающих и птиц.
Таким образом, у рептилий, по всей видимости, есть стадия сна, напоминающая по параметрам МС млекопитающих. Убедительных данных о существовании у рептилий ПС нет. Рептилии дали начало общему предку млекопитающих и птиц. Если ПС у рептилий отсутствует, значит, он появился в эволюции этих двух групп независимо.
Сон у птиц
Электрофизиологическим методом сон изучен примерно у 30 видов класса птиц, большинство из которых принадлежат к надотряду новонёбных (Neognathae), и лишь два вида (африканский страус и тинаму) относятся ко второму надотряду – бескилевых, или древненёбных (Palaeognathae). Новонёбные насчитывают более 10 тыс. видов современных птиц, а бескилевые, или древненёбные, – базовая группа, включающая всего 60 видов современных птиц. Их предки отделились от основной ветви, давшей начало новонёбным птицам, примерно 110 млн лет назад [39].
Только у птиц и млекопитающих сон состоит из двух подстадий – МС и ПС. Главный признак МС у птиц – характерные медленные колебания в ЭЭГ в диапазоне 1–4 Гц. Другие ритмы (например, сонные веретена) у птиц обычно не выделяются. У большинства исследованных видов медленные волны в ЭЭГ развиваются в двух полушариях синхронно (билатерально-симметричный МС). Как минимум у семи видов в МС были зарегистрированы эпизоды межполушарной асимметрии ЭЭГ, или однополушарный сон. В то же время длительность этих эпизодов, как правило, составляет несколько секунд [3, 40–44] и только у некоторых видов более одной минуты [43, 45]. Эпизоды межполушарной асимметрии ЭЭГ у птиц часто сочетаются с асимметричным состоянием глаз. Например, утки, которые спят на краю группы, проводят больше времени с одним открытым глазом по сравнению с птицами, которые спят в центре группы в окружении других особей. При этом глаз, который направлен от центра группы, находится в открытом состоянии больше времени, чем глаз, обращенный на других птиц. Асимметричное состояние глаз коррелирует с эпизодами межполушарной асимметрии ЭЭГ: в полушарии, противоположном закрытому глазу, медленные волны ЭЭГ имели более высокую амплитуду, чем в полушарии, противоположном открытому глазу [44]. Фрегаты во время полетов над океаном на кормовые поля спят в воздухе, планируя по спирали. Вместе с тем полушарие мозга, противоположное направлению вращения, больше времени находится в состоянии бодрствования или низкоамплитудного МС. Косвенно это говорит о том, что во время сна птицы открывают глаз, который направлен в сторону вращения [45]. Поэтому функция МС с межполушарной асимметрией ЭЭГ у птиц состоит, по-видимому, в обработке информации, поступающей от открытого в сторону опасности глаза, и, следовательно, поддержании бдительности во время сна [40–43]. Считается, что основные признаки ПС млекопитающих (быстрые движения глаз, мышечные вздрагивания, торможение скелетной мускулатуры) есть и у птиц. Однако у большинства видов птиц ПС не сопровождается заметным снижением мышечного тонуса по сравнению с МС. У всех исследованных видов птиц, кроме африканского страуса, эпизоды ПС длятся всего лишь несколько секунд [3, 40–42]. Применяя традиционные полиграфические критерии, сложно точно определить границы таких эпизодов ПС.
Сон африканского страуса отличается от сна всех исследованных птиц [46], включая еще одного представителя древненёбных птиц – тинаму [47]. У взрослых страусов эпизоды ПС могут достигать пяти минут, более чем в десять раз превышая максимальную продолжительность эпизода ПС у других птиц. При этом на ПС у страусов приходится в среднем 24% от времени ночного периода, или 26% от общего времени сна, то есть значительно больше, чем у других птиц [3]. Интересно, что характерные для ПС вздрагивания глаз и головы регистрируются на фоне как низкоамплитудной, так и высокоамплитудной ЭЭГ. Подобные особенности сна у страуса послужили основанием для гипотезы о том, что его недифференцированный сон является предшественником «эволюционно более молодого» ПС млекопитающих и птиц, который сопровождается активацией коры переднего мозга. Поэтому, возможно, ПС сформировался в эволюции птиц и млекопитающих независимо [46]. Однако отсутствие такой же недифференцированной стадии сна у тинаму и короткие эпизоды их ПС (как у всех новонёбных птиц) ставят эту гипотезу под сомнение.
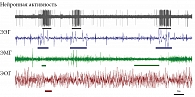
Большинство нейронов в ретикулярной формации ствола мозга млекопитающих разряжаются с наибольшей частотой во время бодрствования и ПС, снижая частоту разряда в МС. Другими словами, активация подкорковых структур мозга млекопитающих – один из важнейших признаков ПС. Нами была исследована особенность импульсной активности нейронов ствола мозга во время цикла «сон – бодрствование» у домашних кур. Оказалось, что большинство таких нейронов разряжались с наибольшей частотой во время эпизодов ПС. Периоды разряда нейронов не всегда точно соответствовали другим признакам ПС [48]. В наибольшей степени учащение частоты разряда совпадало с быстрыми движениями глаз и в наименьшей – с изменением мышечного тонуса. Поэтому в этом случае правильнее использовать название «сон с быстрыми движениями глаз», так как именно этот параметр является определяющим для этого состояния у птиц. Некоторые эпизоды быстрых движений глаз у кур регистрировались на фоне медленных волн в ЭЭГ, то есть без активации переднего мозга (рис. 1). Это означает, что даже у кур – типичных представителей новонёбных ПС менее дифференцирован, чем у наземных млекопитающих. Таким образом, сложившееся представление о том, что суммарная длительность ПС/сна с быстрыми движениями глаз у птиц меньше, чем у млекопитающих, возможно, ошибочно, если в дополнение к полиграфическим критериям применять параметр активации нейронов ретикулярной формации.
Многие птицы совершают сезонные миграции, а также полеты на кормовые поля, причем они находятся в воздухе несколько дней или даже недель. Птицы могут спать в полете, но общая продолжительность сна при этом, скорее всего, значительно меньше таковой на земле. Например, у фрегатов общее время сна в полете составляет менее 7% от продолжительности сна в гнездах [45]. Это один из примеров адаптивного сокращения продолжительности сна в ситуации, когда сон препятствует реализации более важной стратегии поведения, а именно кормлению и обеспечению безопасности. В других случаях птицы сокращают количество сна в период спаривания. В результате самцы, которые спят меньше, спариваются с большим число самок. Судя по частоте встречаемости птиц и их выживаемости, сокращение продолжительности сна в период размножения не имеет последствий для их физиологического состояния и здоровья [49].
Сон у млекопитающих
На Земле обитает примерно 3,5 тыс. видов млекопитающих, включая представителей плацентарных, сумчатых и однопроходных. Сон исследован более чем у 100 видов. Существование МС у однопроходных (ехидны, утконоса) не вызывает сомнений. В то же время ситуация с ПС у этих животных не понятна. Одни считают, что ПС у ехидны нет [50]. Другие придерживаются мнения, что ПС у ехидны есть [51]. Третьи, основываясь на особенностях разряда нейронов в стволе мозга, предполагают, что у ехидны есть недифференцированная стадия сна, сочетающая признаки МС и ПС плацентарных млекопитающих [52]. Интересно, что у утконоса мышечные вздрагивания и подергивания регистрируются одновременно с высоковольтной ЭЭГ. На основании этих данных была выделена стадия спокойного сна (гомологичная МС наземных млекопитающих) и стадия, которая сочетает признаки дифференцированного МС и ПС плацентарных [52, 53]. Очевидные признаки недифференцированного ПС есть и у сумчатых млекопитающих. Например, у опоссума характерные для ПС быстрые движения глаз и мышечные вздрагивания фиксируются на фоне не только активированного паттерна в ЭЭГ, но и низкоамплитудных медленных волн [54]. Таким образом, сон (в первую очередь ПС) у эволюционно «примитивных» млекопитающих (однопроходных, сумчатых) имеет признаки недифференцированности, как и у африканского страуса.
Все наземные млекопитающие во время сна неподвижны, глаза при этом закрыты, а дыхание регулярно. Медленные волны в ЭЭГ двух полушарий коры мозга развиваются одновременно. ПС обнаружен у всех наземных млекопитающих. Обычно он развивается после МС. Избирательная депривация ПС приводит к увеличению числа попыток заснуть ПС, то есть предполагается, что продолжительность ПС регулируется гомеостатическим образом. Депривация ПС сопровождается нарушением когнитивных функций, может иметь последствия для здоровья и даже приводить к смерти [55].
Среди млекопитающих наибольшее количество ПС регистрируется у однопроходных и сумчатых, то есть у животных с наиболее примитивно устроенным мозгом. В целом продолжительность ПС больше у незрелорождающихся видов, что говорит о его возможной роли в развитии мозга. Кроме того, существует положительная корреляция между количеством ПС у млекопитающих и степенью их защищенности во время сна [3–6]. Безусловно, нужно учитывать, что наши представления о сне животных сложились в первую очередь по результатам исследований, выполненных в лабораторных условиях. В природе животные не спят каждый день в одно и то же время, в том числе и ПС [56, 57]. Кроме того, снижение продолжительности ПС – не единственный способ сокращения времени пребывания в наиболее глубокой (судя по порогам пробуждения) стадии сна. Другой способ – изменение циркадной организации паттерна сна и смещение активности на время, когда степень опасности ниже [58].
Сон морских млекопитающих отличается от сна наземных млекопитающих по некоторым признакам, включая те, что считаются ключевыми для определения самого состояния сна. Особенности сна водных млекопитающих – прекрасный пример, в какой степени сон животных зависит от условий их обитания. Предки современных водных млекопитающих должны были «решить» несколько важных проблем, обусловленных условиями сна в воде. Во-первых, в воде невозможна длительная неподвижность. Животным нужно регулярно всплывать к поверхности воды для дыхания или поддерживать голову (ноздри) над водой. Во-вторых, в воде нет убежищ для сна, а всплытие к поверхности делает животных максимально уязвимыми для хищников (косаток, акул). Значит, во время сна животные должны постоянно поддерживать высокий уровень бдительности. В-третьих, теплопроводность воды в десятки раз выше теплопроводности воздуха.
Важнейшие особенности сна китообразных – однополушарный МС и способность спать во время движения, закрывая только один глаз [59–62]. Считается, что именно однополушарный сон (будучи при этом и однополушарным бодрствованием) позволяет китообразным сочетать сон и движение, обеспечивая возможность всплытия к поверхности воды для дыхания без пробуждения. Движение также способствует мышечному термогенезу, препятствуя переохлаждению в холодной воде. Вторая функция однополушарного сна у китообразных состоит в визуальном контроле за состоянием окружающей среды с помощью одного открытого во время сна глаза. Это снижает риск неожиданного нападения хищников и помогает координировать движение с другими особями в группе (например, матерей с детенышами [60–63]).
Причины отсутствия ПС у китообразных (во всяком случае в том в виде, в каком он регистрируется у наземных млекопитающих) не понятны [61, 62]. В то же время у китообразных есть элементы поведения (в частности, вздрагивания во время МС), которые напоминают поведенческие признаки ПС у наземных млекопитающих. Не исключено, что ПС у дельфинов и китов может протекать в модифицированной форме (например, в виде коротких эпизодов длительностью всего в несколько секунд), что затрудняет его идентификацию. Даже в этом случае продолжительность ПС у китообразных была бы значительно меньше, чем у наземных млекопитающих и птиц. Считается, что ПС выполняет витальную (жизнеподдерживающую) функцию. В чем бы эта функция ни состояла, она оказывается менее важной для китообразных по сравнению с теми рисками, которые возникают при развитии длинных эпизодов ПС.
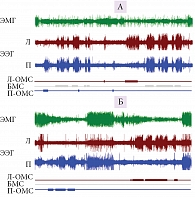
Ластоногие – группа полуводных животных (отряд хищных), которые могут спать и на суше, и в воде. Сон ластоногих сочетает признаки сна наземных млекопитающих и китообразных. Один из типичных представителей ластоногих, в частности семейства ушастых тюленей, и одна из моделей для изучения механизмов сна у млекопитающих – северный морской котик. Морские котики обитают преимущественно в умеренной и субтропической климатических зонах. Во время летнего периода они проводят большую часть времени на суше, где размножаются и линяют. В зимний период котики мигрируют на расстояние до 2000 км и не выходят на сушу до десяти месяцев. В воде они спят на поверхности в характерной позе, поддерживая голову над водой и совершая гребковые движения одним передним ластом (рис. 2). Такая поза позволяет снизить потери тепла (через находящиеся в воздухе ласты) и обеспечивает регулярное дыхание. Во время сна в воде котики, как и китообразные, закрывают на продолжительное время только один глаз, тогда как второй направлен в сторону воды, что повышает вероятность обнаружения хищников [63–65].
Наши исследования показали, что переход от наземного к водному образу жизни сопровождается у котиков «переключением» с «типичного наземного» (билатерально-симметричный МС, неподвижность, ПС) на характерный для китообразных «водный» тип сна (однополушарный сон, сохранение двигательной активности, прерывистый тип дыхания, отсутствие ПС) (рис. 3 и 4) [65, 66]). Способность котиков естественным образом фактически полностью исключить ПС из жизни на как минимум одну-две недели без каких бы то ни было очевидных последствий представляет большой интерес для понимания функции и биологической роли ПС. Исчезновение ПС при переходе от сна на суше ко сну в воде говорит о важности экологических факторов в регуляции ПС у этого вида. При этом исчезновение ПС происходит в условиях, когда животным необходимо поддерживать высокий уровень двигательной активности и бдительности. Находясь в воде две недели, морские котики накапливают огромный дефицит ПС в количестве 15–20 часов. После возвращения на сушу у них не наблюдается значимого превышения ПС над контрольными значениями на суше. Полученные данные ставят под сомнение представления о гомеостатической регуляции ПС. В то же время они хорошо согласуются с ранее высказанной гипотезой, что ПС необходим для смягчения возможных негативных последствий глубокого билатерально-симметричного МС (например, снижения температуры мозга [67]). Это могло бы объяснить не только сокращение ПС в воде у котиков (параллельно с исчезновением билатерально-симметричного МС), но и отсутствие ПС у дельфинов (у которых высокоамплитудный билатерально-симметричный МС не регистрируется). Особенности сна морских млекопитающих необходимо каким-то образом согласовать с представлением о роли ПС в поддержании когнитивных функций, или следует признать, что эта стадия сна выполняет различные функции у разных видов и групп.
Отсутствие/резкое сокращение ПС у дельфинов и морских котиков вовсе не означает, что ПС несовместим с водным образом жизни, а однополушарный МС на фоне постоянной двигательной активности – единственная возможность для млекопитающих спать в водной среде. Существует и другой паттерн (стратегия) сна, который сформировался в эволюции у настоящих тюленей. Большинство настоящих тюленей, а также моржи обитают в холодных водах субполярных и полярных районов вдоль кромки льдов или в замерзающих озерах и внутренних морях в условиях ограниченного доступа к открытой воде. Задерживая дыхание, тюлени могут спать под водой на глубине [68]. Подобный паттерн сна не требует поддержания двигательной активности. Поэтому МС у тюленей билатерально-симметричный, как у неподвижно спящих наземных млекопитающих. Сохранение тепла у тюленей достигается посредством толстого подкожного жирового слоя. Эффективная защита от переохлаждения не препятствует развитию ПС. При этом они должны пробуждаться для движения при всплытии к поверхности воды [63].
Таким образом, имеющиеся данные об особенностях сна водных млекопитающих указывают на важность экологических факторов в формировании паттерна сна. Необходимость всплывать к поверхности воды для дыхания, постоянно контролировать окружающую среду и осуществлять эффективную терморегуляцию – основные факторы, определившие формирование структуры сна у современных водных млекопитающих [61–66]. Однополушарный МС – одна из главных особенностей сна китообразных и ушастых тюленей сформировалась в эволюции этих групп независимо в условиях действия одних и тех же экологических факторов. Чрезвычайно интересно, что однополушарный МС у морских млекопитающих и птиц фенотипически похож, несмотря на различия в анатомической организации их переднего мозга. Не исключено, что в будущем такая форма сна обнаружится и у других представителей животного мира, для которых условия сна требуют поддержания высокого уровня бдительности или сохранения двигательной активности во время сна.
Заключение
Наиболее интересные и значимые результаты в нейробиологии сна (сомнологии) последних 20 лет были получены при изучении сна у простых организмов, а также при исследовании сна животных в природе. Оказалось, что сон – универсальное состояние всех животных, от простых форм с децентрализованной нервной системой до высших млекопитающих со сложно устроенным головным мозгом. У всех животных состояние сна характеризуется удивительно похожими поведенческими, нейронными, молекулярными и физиологическими признаками. В то же время две дифференцированные стадии сна – МС и ПС (или быстрый сон) существуют только у млекопитающих и птиц. Поэтому сравнительные исследования сна у млекопитающих и птиц особенно важны для осмысления эволюции сна и механизмов его регуляции. Для понимания природы и функции (функций) сна и его стадий важно изучать сон животных в условиях, предельно приближенных к естественным, и в дикой природе. При этом необходимо учитывать влияние на поведение и сон максимально возможного числа внешних факторов, динамику их изменений и особенности биологического цикла данного вида животных.
Исследования сна птиц поддержаны грантом Российского фонда фундаментальных исследований (18-04-01252).
Исследования сна морских млекопитающих поддержаны грантами Национального научного фонда США, Национального института здоровья США, Российского фонда фундаментальных исследований и ООО «Утришский дельфинарий» (Россия).
O.I. Lyamin
A.N. Severtsov Institute of Ecology and Evolution of the Russian Academy of Sciences, Moscow
University of California, Los Angeles
Contact person: Oleg Irikovich Lyamin, oilyamin@yahoo.com
Sleep and wakefulness are two basic states characteristic of all animals from simple organisms with decentralized nervous systems to placental mammals with very complex brains. In all studied animals, sleep features similar behavioral, neuronal, molecular and physiological parameters. In low vertebrates sleep has many characteristics of the mammalian slow wave sleep (SWS). At the same time, two differentiated states – SWS and paradoxical (rapid eye movement of fast) sleep are present only in birds and mammals. In birds and ‘primitive’ mammals (monotreems and marsupials) sleep is less differentiated than in placental mammals. In marine mammals (cetaceans and eared seals belonging to the group of pinnipeds) SWS may occur in one cortical hemisphere at a time (called unihemispheric sleep). Episodes of interhemispheric electroencephalogram asymmetry during SWS are also recorded in some birds. Those episodes resemble unihemispheric sleep. It is believed that unihemispheric sleep facilitates movement and vigilance in animals while they are asleep. The most recent studies have convincingly demonstrated the key role of ecological and evolutional factors in shaping the features and duration of sleep in animals.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.