Факторы, ассоциированные с ранней госпитальной летальностью у пациентов с острым ишемическим инсультом
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить факторы, ассоциированные с ранней госпитальной летальностью у пациентов с острым ишемическим инсультом.
Материал и методы. В ходе ретроспективного сравнительного когортного одноцентрового исследования проанализированы медицинские записи 80 пациентов старше 18 лет с диагнозом «ишемический инсульт», госпитализированных в инсультное отделение крупной многопрофильной больницы третичного уровня. Пациенты были разделены на две группы – умершие (n = 40) и выжившие (n = 40).
Результаты. У пациентов, которые вошли в основную исследуемую группу (умершие от ишемического инсульта или его осложнений), госпитальная летальность ассоциировалась с изначальной тяжестью состояния за счет сопорозного сознания (31 (69%); р ≤ 0,001), коротким сроком пребывания в больнице (27 (60%); р ≤ 0,001), нестабильной гемодинамикой и дыхательной недостаточностью (25 (55,5%); р ≤ 0,001), что потребовало применения аппарата искусственной вентиляции легких (20 (44,4%); р ≤ 0,001) и урологического катетера (45 (100%); р ≤ 0,001), гиперкреатинемией (238 ± 232 ммоль/л; р ≤ 0,05), гипергликемией (23 (51,1%); р ≤ 0,001) и гипертермией (20 (44,4%); р ≤ 0,001), а также признаками нарастающего отека мозга с явлениями дислокации (17 (37,7%); р ≤ 0,001).
Заключение. Полученные результаты продемонстрировали важность стратификации групп риска летального исхода с учетом рассчитанных прогностически значимых показателей для индивидуального подбора тактики ведения с целью уменьшения вероятности наступления летального исхода у пациентов с ишемическим инсультом.
Цель – изучить факторы, ассоциированные с ранней госпитальной летальностью у пациентов с острым ишемическим инсультом.
Материал и методы. В ходе ретроспективного сравнительного когортного одноцентрового исследования проанализированы медицинские записи 80 пациентов старше 18 лет с диагнозом «ишемический инсульт», госпитализированных в инсультное отделение крупной многопрофильной больницы третичного уровня. Пациенты были разделены на две группы – умершие (n = 40) и выжившие (n = 40).
Результаты. У пациентов, которые вошли в основную исследуемую группу (умершие от ишемического инсульта или его осложнений), госпитальная летальность ассоциировалась с изначальной тяжестью состояния за счет сопорозного сознания (31 (69%); р ≤ 0,001), коротким сроком пребывания в больнице (27 (60%); р ≤ 0,001), нестабильной гемодинамикой и дыхательной недостаточностью (25 (55,5%); р ≤ 0,001), что потребовало применения аппарата искусственной вентиляции легких (20 (44,4%); р ≤ 0,001) и урологического катетера (45 (100%); р ≤ 0,001), гиперкреатинемией (238 ± 232 ммоль/л; р ≤ 0,05), гипергликемией (23 (51,1%); р ≤ 0,001) и гипертермией (20 (44,4%); р ≤ 0,001), а также признаками нарастающего отека мозга с явлениями дислокации (17 (37,7%); р ≤ 0,001).
Заключение. Полученные результаты продемонстрировали важность стратификации групп риска летального исхода с учетом рассчитанных прогностически значимых показателей для индивидуального подбора тактики ведения с целью уменьшения вероятности наступления летального исхода у пациентов с ишемическим инсультом.



Введение
Инсульт остается глобальной проблемой и ведущей причиной заболеваемости и смертности в мире. В структуре острых нарушений мозгового кровообращения на долю ишемического инсульта приходится примерно 87% [1]. Несмотря на достижения в лечении острого инсульта, эффективность тромболизиса и эндоваскулярных вмешательств, общий уровень смертности от ишемического инсульта остается высоким, особенно среди пациентов с тяжелым инсультом [2]. Выявление предикторов летального исхода у пациентов в остром периоде ишемического инсульта важно для обеспечения своевременного и надлежащего лечения и улучшения его результатов.
Предикторы госпитальной летальности у пациентов с ишемическим инсультом изучают в разных странах. В качестве важных предикторов смертности ранее были определены возраст, сопутствующие заболевания и подтип инсульта [3–5]. Установлено, что ряд лабораторных показателей, таких как повышенный уровень глюкозы в крови и лейкоцитоз, также могут служить предикторами внутрибольничного неблагоприятного исхода [6, 7]. Однако не до конца изучены некоторые потенциально важные предикторы. Например, вопросы влияния на госпитальную летальность гиперкреатинемии, гипертермии и кардиореспираторной недостаточности, осложнений и других факторов, таких как гиперкоагуляция, этническая принадлежность, требуют всестороннего изучения.
Цель исследования – изучить факторы, ассоциированные с ранней госпитальной летальностью у пациентов с острым ишемическим инсультом. Проанализирована связь между рядом анамнестических, клинических, нейровизуализационных и лабораторных данных и низкой выживаемостью у взрослых пациентов в остром периоде ишемического инсульта.
Материал и методы
В ходе ретроспективного когортного одноцентрового исследования проанализированы данные 80 пациентов в возрасте старше 18 лет с диагнозом «ишемический инсульт», госпитализированных в инсультное отделение самой крупной многопрофильной больницы третичного уровня Кыргызской Республики с 1 января по 30 июня 2021 г. Диагноз инсульта был установлен в соответствии с клиническим протоколом по ведению пациентов с острым ишемическим инсультом (ИИ) или транзиторной ишемической атакой на госпитальном этапе, а также обновленным руководством Американской кардиологической ассоциации/Американской ассоциации инсульта (2023). Все случаи ИИ, вошедшие в данное исследование, кодировались согласно Международной классификации болезней 10-го пересмотра в рубриках I63.3, I63.4 и I63.5. Инсульт диагностирован неврологом на основании результатов нейровизуализационного исследования. Проанализированы стато-демографические, анамнестические, клинические, радиологические и лабораторно-инструментальные данные историй болезни пациентов.
Комитет по медицинской этике при Кыргызской государственной медицинской академии им. И.К. Ахунбаева одобрил протокол исследования от 27 апреля 2022 г. Учитывались демографические данные пациентов (возраст, пол, адрес и история болезни), базовые характеристики при поступлении в больницу (результаты физического, в том числе неврологического, обследования, лабораторные данные (параклинические, биохимические, гемостазиограмма и т.д.), догоспитальный прием лекарств, результаты допплеровского ультразвукового исследования сонной артерии, а также протоколы аутопсий). Инсульт верифицирован при поступлении с помощью компьютерной томографии или магнитно-резонансной томографии (МРТ), в отдельных случаях подкрепленных бесконтрастной МР-ангиографией. Отмечался первоначальный объем поражения.
Статистический анализ выполнен с использованием статистического программного обеспечения SPSS 23. Качественные данные представлены в виде абсолютных и относительных значений. Нормальность распределения количественных данных выражена в виде среднего и стандартного отклонения. Сравнение между группами проведено с использованием t-критерия Стьюдента. Значения считались статистически значимыми при p < 0,05.
Результаты
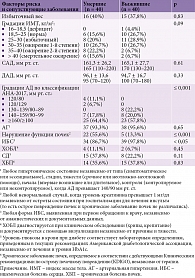
Пациенты были разделены на две группы – основную (40 умерших) и контрольную (40 выживших). Демографическая характеристика больных на момент первичного осмотра представлена в табл. 1. Основные демографические показатели (возраст, пол, национальная принадлежность) умерших и выживших были схожими, статистически не отличались.
Как видно из табл. 1, средний возраст в группе умерших составил 71,6 ± 10,3 года, мужчин насчитывалось 19 (48,9%).
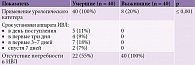
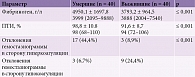
Коронарная болезнь сердца, гипертония и дисфункция почек были наиболее распространенными факторами риска как среди умерших, так и среди выживших, реже наблюдалась хроническая обструктивная болезнь легких (ХОБЛ). Статистически достоверной разницы между исследуемыми группами по этим факторам риска не зафиксировано (табл. 2). Но отмечались статистически достоверные различия между частотой встречаемости заболеваний почек среди умерших и выживших. Так, дисфункция почек зарегистрирована у 22 (55,6%) умерших и 5 (13,3%) выживших (р ≤ 0,001). Коронарная болезнь сердца в отличие от болезней почек у выживших регистрировалась чаще, чем у умерших, – 39 (97,8%) и 34 (86,7%) соответственно (р ≤ 0,05). Что касается связи ХОБЛ, сахарного диабета и хронических заболеваний почек с неблагоприятным исходом, статистически достоверной разницы между группами не выявлено.
Различий между группами в отношении повышения уровня артериального давления (АД), разницы между значениями систолического (САД) и диастолического АД (ДАД) на момент поступления в отделение не наблюдалось (табл. 2). Так, при сравнении уровней САД и ДАД между исследуемыми группами установлено, что как у умерших, так и выживших при поступлении в стационар средние значения САД были высокими – в пределах 161,3 ± 26,2 мм рт. ст. у умерших и 165,1 ± 27,7 мм рт. ст. у выживших. Уровень ДАД также превышал нормальные значения – 96,1 ± 13,6 мм рт. ст. у умерших и 94,7 ± 16,7 мм рт. ст. у выживших. У пациентов основной группы, госпитализированных в отделение по поводу ИИ, по сравнению с пациентами контрольной отмечался большой разброс градаций АД согласно классификации Американской ассоциации кардиологов (AHA) 2017 г. В обеих группах уровень АД часто превышал 160/100 мм рт. ст. Статистически достоверной разницы между группами умерших и выживших не зафиксировано. Пограничные значения АД 130–139/80–89 мм рт. ст. не регистрировались среди умерших. В то же время такие значения имели место у 8 (22,2%) выживших (р ≤ 0,001).
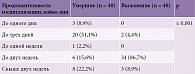
Нами также был оценен показатель длительности пребывания в стационаре, указывающий на тяжесть состояния и характер течения заболевания (табл. 3). У пациентов, у которых острый сосудистый процесс завершился летальным исходом, пребывание в стационаре было непродолжительным. Этот срок достоверно отличался от срока пребывания в стационаре пациентов, которые были выписаны для дальнейшего реабилитационного лечения (p ≤ 0,001). Так, у 51,1% пациентов с ИИ основной группы смерть наступила в течение первых трех суток с момента поступления в отделение, у 8,9% – через сутки, у 2,2% – в течение первых семи дней. 14-дневный порог преодолели 37,8% пациентов основной и 34 (86,7%) пациентов контрольной групп.
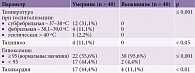
Гиперергическая реакция в виде лихорадки в дебюте заболевания наблюдалась у 17 (44,4%) умерших, у 12 (31,1%) из них температура тела поднималась до субфебрильных цифр, у 4 (11,1%) – до фебрильных и у 1 (2,2%) – до гектических показателей. В группе выживших случаев повышения температуры тела не зафиксировано. По данному параметру имела место высокая достоверность различий между группами (табл. 4).
Функции жизненно важных органов также были значительно нарушены у пациентов с ИИ основной группы. Степень отклонения параметров гемодинамики и дыхания у них заметно отличалась от аналогичного показателя в группе выживших (≤ 0,001). Симптомы дыхательной и сердечно-сосудистой недостаточности, такие как тахипноэ (4 (11,1%)), гипоксемия (22 (55,6%)) и тахикардия (17 (44,4%)), в пять-шесть раз чаще встречались в группе умерших (табл. 4).
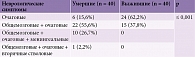
В неврологическом статусе наблюдалось четыре вида симптомокомплексов: общемозговая, очаговая, менингеальная и вторичная стволовая симптоматика. Зафиксирована статистически достоверная разница в частоте развития неврологических симптомов между умершими и выжившими. Обращал на себя внимание тот факт, что у умерших достоверно чаще сочетались два неврологических симптомокомплекса – очаговый и общемозговой. Такая клиническая картина встречалась у 22 (55,6%) пациентов основной группы. В группе выживших самым частым симптомокомплексом был синдром очагового поражения мозга – 24 (62,2%) случая. В группе выживших отсутствовали менингеальные и вторичные стволовые симптомы (табл. 5).
Один из важных показателей тяжести состояния и углубленного нарушенного сознания – потребность в применении урологического катетера. В основной группе он был установлен в 40 (100%) случаях, в контрольной – в 8 (20%) (p ≤ 0,001) (табл. 6).
Еще более тяжелым показателем угрозы жизни является необходимость подключения к аппарату искусственной вентиляции легких (ИВЛ). У 18 (45%) умерших отмечалась дыхательная недостаточность из-за тяжести состояния, они нуждались в подключении к аппарату ИВЛ, но сроки его установки были разными. В контрольной группе не было пациентов, нуждавшихся в ИВЛ, что свидетельствовало о высокой степени достоверности различий между группами по этому параметру (р ≤ 0,001) (табл. 6).
Пациентов основной группы подключали к аппарату ИВЛ в день госпитализации, в первые три дня, через 3–7 дней и спустя семь дней. Чаще ухудшение состояния у умерших отмечалось на 3–7-е сутки, в связи с чем возникала потребность в аппаратном дыхании у 45% умерших. Ухудшение состояния с последующим применением аппарата ИВЛ в другие сроки также имело место, но в основной группе срок использования ИВЛ был более продолжительным (табл. 6).
Уровень сознания – важный показатель тяжести инсульта. В исследовании выявлены статистически значимые различия между группами по данному параметру. У пациентов основной группы уже в дебюте заболевания отмечалось грубое угнетение сознания до степени сопора (10,3 ± 2,4), у пациентов контрольной группы – нарушение более легкой степени – до уровня оглушения (13,1 ± 1,9).
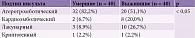
При анализе частоты встречаемости подтипа ИИ по классификации TOAST 1993 г. установлено, что самым частым подтипом был атеротромботический инсульт – 32 (82,2%) пациента основной группы и 20 (50%) пациентов контрольной. Вторым по частоте был лакунарный инсульт, который стал причиной госпитализации 3 (8,9%) пациентов основной и 10 (26,7%) пациентов контрольной групп. Третьим по частоте был кардиоэмболический инсульт – 2 (6,7%) и 8 (20%) пациентов соответственно. В обеих группах выявлено по одному случаю криптогенного инсульта (табл. 7).
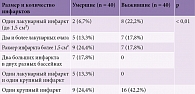
Результаты сравнения объемов и количества инфарктов в группах не показали статистически значимой разницы (табл. 8). Как у умерших, так и выживших чаще встречались крупные очаги ишемии головного мозга – 48,8 и 42,2% случаев соответственно. Лакунарные инфаркты как группе выживших, так и в группе умерших выявлены в 40% случаев. Статистически значимой разницы между группами по данному параметру не установлено.
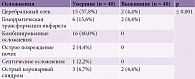
При анализе осложнений инсульта зафиксирована статистически достоверная разница между группами (p ≤ 0,001). Так, у умерших самыми частыми осложнениями были комбинированные осложнения (интрацеребральные + экстрацеребральные), церебральный отек и геморрагическая трансформация инфаркта. Значительно реже наблюдались острое повреждение почек или декомпенсация хронического заболевания почек (2 (4,4%)). В контрольной группе в 36 (91,1%) случаях заболевание протекало без осложнений. Только у двух больных заболевание осложнилось церебральным отеком и еще у двух – острым коронарным синдромом (табл. 9).
Были оценены показатели углеводного обмена. У пациентов основной группы отмечался достоверно повышенный уровень глюкозы в периферической крови. Его среднее значение составило 8,7 ± 3,5 ммоль/л. У пациентов контрольной группы данный показатель составил 6,1 ± 2,1 ммоль/л (p ≤ 0,001). У 9 (24,4%) пациентов основной группы отмечался выраженный сдвиг гликемического профиля в сторону умеренной гипергликемии, у 20 (51,1%) – выраженная гипергликемия. В контрольной группе выраженная гипергликемия регистрировалась в 2,5 раза реже – 8 (20,0%) случаев (p ≤ 0,001). Умеренная гипергликемия имела место у 4 (11,1%) пациентов (табл. 10).
Показатели жирового обмена оценивали по уровню общего холестерина. Его уровень у умерших был достоверно выше, чем у выживших, – 5,1 ± 1,5 и 4,6 ± 1,1 ммоль/л соответственно (р ≤ 0,05). Сказанное относится и к гиперхолестеринемии – 18 (46,7%) и 8 (22,0%) пациентов соответственно (р ≤ 0,05) (табл. 11).
В качестве показателя функционирования почек анализировали значения креатинина в сыворотке венозной крови. В основной группе этот показатель был в 2,6 раза выше, чем в контрольной, – 256,6 ± 232,1 и 96,6 ± 43,5 мкмоль/л соответственно (р < 0,05).
Были проанализированы показатели гемостазиограммы и характер нарушения гемостаза по результатам исследования уровня фибриногена, протромбинового индекса (ПТИ) и других его показателей. В группе умерших уровень фибриногена и ПТИ существенно отличались от таковых в контрольной группе. Уровень фибриногена А у пациентов основной группы был в 1,3 раза выше, чем у пациентов контрольной группы, – 4950,1 ± 1697,8 и 3793,2 ± 964,5 мг/л соответственно (р ≤ 0,001). ПТИ составил 99,2 ± 17,3 и 91,2 ± 11,9% соответственно (р ≤ 0,001). У 17 (44,4%) умерших нарушения гемостаза сдвигались в сторону гиперкоагуляции и встречались в пять раз чаще, чем в группе выживших. В то же время гипокоагуляция в 3,5 раза чаще регистрировалась в контрольной группе – 9 (24,4%) случаев (р ≤ 0,001) (табл. 12).
Обсуждение
Полученные результаты свидетельствуют о значительной связи между большим объемом поражения и увеличением риска ранней госпитальной летальности. Так, у умерших пациентов достоверно чаще, чем у выживших, наблюдались большие очаги инфаркта, например один крупный инфаркт с одним лакунарным инфарктом или два больших инфаркта в двух разных бассейнах (р ≤ 0,01).
Предыдущие исследования также показали, что большие объемы поражений связаны с более тяжелым неврологическим дефицитом, задержкой восстановления и неблагоприятными функциональными исходами [8, 9]. Кроме того, у пациентов с большим объемом поражения выше вероятность развития осложнений, таких как геморрагическая трансформация и повышенное внутричерепное давление [10]. В нашем исследовании в основной группе достоверно чаще, чем в контрольной, наблюдалась грубая неврологическая симптоматика, проявлявшаяся сочетанием общемозговой, очаговой или менингеальной симптоматики, а также грубыми (сопор) нарушениями сознания (р ≤ 0,001). У выживших пациентов неврологическая симптоматика проявлялась чаще фокальными неврологическими симптомами без нарушения сознания или с его легким угнетением (оглушение) (р ≤ 0,001). У лиц, у которых инсульт завершился летальным исходом, достоверно чаще развивались осложнения, например комбинация интрацеребральных и экстрацеребральных осложнений, церебральный отек и геморрагическая трансформация (р ≤ 0,001).
У 44,4% умерших отмечалась гипертермия с первого дня наблюдения, тогда как у всех выживших температура тела за время госпитализации оставалась в пределах нормы (р ≤ 0,001).
В более ранних работах установлено, что повышение температуры головного мозга до и после ишемического инсульта увеличивает общий объем инфаркта [11]. Другие авторы сообщают о гипертермии у 18–61% пациентов после ишемического инсульта [12]. Показано, что возраст, тип инсульта, топография и объем поражения, тяжесть инсульта, инфекции и системная воспалительная реакция (вторичная по отношению к инфаркту) могут быть определяющими факторами повышения температуры тела после инсульта [13]. По нашему мнению, при наличии всех указанных факторов у пациентов с острым ИИ агрессивные меры профилактики и лечения гипертермии способны улучшить клинические исходы.
В нашем исследовании у умерших пациентов чаще диагностировались признаки дыхательной недостаточности (ДН), которые клинически проявлялись гипоксемией, тахипноэ и сопутствующей тахикардией. В других исследованиях при развитии патологических паттернов дыхания также регистрировались высокие показатели госпитальной летальности, которые были неизменны и колебались в пределах 50–90% [14]. Сопутствующие ДН низкий уровень сознания по шкале Глазго при госпитализации или перед интубацией, утрата стволовых рефлексов и признаки неврологического ухудшения – предикторы летального исхода.
Снижение уровня сознания делает пациентов с инсультом более восприимчивыми к аспирационной пневмонии, нарушенному клиренсу слизи из дыхательных путей и развитию вентилятор-ассоциированной пневмонии [10]. В нашем исследовании 44,4% умерших остро нуждались в ИВЛ. Недавнее исследование показало, что у пациентов с инфратенториальным поражением головного мозга ранняя трахеостомия позволяет сократить продолжительность ИВЛ и срок пребывания в отделении интенсивной терапии [16].
Другим важным предиктором крайне неблагоприятного клинического исхода при ИИ, роль которого в исходе инсульта еще недостаточно изучена, является гиперкреатинемия. В нашем исследовании у пациентов основной группы отмечалось статистически значимое (2,5-кратное) увеличение креатинина в венозной крови по сравнению с пациентами контрольной группы (р ≤ 0,05). Как показывает анализ данных литературы, у 27% пациентов после острого инсульта наблюдается повреждение почек, на что влияют тяжесть инсульта, исходный уровень креатинина, сердечная недостаточность и подтип инсульта [17]. Во избежание развития повреждения почек (возникшего как впервые, так и вследствие декомпенсации уже имевшегося) крайне важны интенсивный мониторинг, отказ от применения потенциальных нефротоксичных лекарственных средств и вмешательств, адекватная гидратация, контроль АД, коррекция любых электролитных нарушений и кислотно-щелочного равновесия.
Нами были проанализированы лабораторные предикторы (гипергликемия, гиперхолестеринемия и гиперкоагуляция) на основании данных гемостазиограммы. Пациенты основной группы характеризовались достоверно повышенными уровнями сахара в периферической крови (р ≤ 0,001). Как показывают результаты недавних исследований, у большой части пациентов, перенесших острый инсульт, может развиться гипергликемия, даже в отсутствие ранее диагностированного сахарного диабета. Данные клинических и экспериментальных исследований демонстрируют, что гипергликемия не является доброкачественным состоянием и связана с высоким риском смертности. На животных моделях инсульта продемонстрировано, что снижение уровня глюкозы с помощью инсулина уменьшает ишемическое повреждение головного мозга. Это позволяет предположить, что гипергликемия, вызванная инсультом, служит модифицируемым фактором риска повреждения головного мозга [18]. Фибриноген является важным предиктором восстановления после инсульта: как низкие, так и высокие его уровни ухудшают результаты реабилитационных мероприятий после инсульта [10].
Выводы
Полученные результаты подтверждают важность стратификации групп риска летального исхода с мониторингом описанных параметров для подбора индивидуального плана ведения пациента, перенесшего церебральный инсульт. Более агрессивный контроль факторов сосудистого риска, включая гипертонию, диабет и гиперлипидемию, на догоспитальном уровне является профилактикой не только самого инсульта, но и его осложненных форм, что в конечном счете влияет на заболеваемость инсультом и смертность.
Необходимы дальнейшие исследования потенциальных механизмов, лежащих в основе этих связей, и разработка целевых вмешательств для улучшения результатов лечения.
Ограничения исследования. Исследование было одноцентровым. Как известно, госпитальная летальность во многом связана с уровнем медицинского обслуживания – обеспеченностью стационара высокоточным лечебным и диагностическим оборудованием, медикаментами с доказанной эффективностью, соответствующей подготовленностью медперсонала к ведению инсультных больных. Кроме того, исследование является ретроспективным. Для более надежной интерпретации его результатов необходимы дальнейшие проспективные когортные исследования.
Kh. Musaeva, E.M. Mamytova, PhD, L.R. Akhmadeeva, PhD, Prof., D.I. Bakaeva, A.M. Mamytov
I.K. Akhunbayev Kyrgyz State Medical Academy
Bashkir State Medical University
Contact person: Leila R. Akhmadeeva, Leila_ufa@Mail.ru
Identifying predictors that forecast hospital mortality among patients with ischemic stroke is crucial for ensuring timely and appropriate treatment and for improving its outcomes.
Purpose – to investigate predictors associated with early hospital mortality in patients with ischemic stroke. We examined the relationship between various clinical, laboratory, and neuroimaging factors and clinical outcomes.
Material and methods. Study design – retrospective, comparative, analytical, cohort study, including the analysis of medical records of 80 patients aged 18 and older diagnosed with ‘ischemic stroke’, who were admitted to the stroke unit of a large tertiary-level multi-profile hospital. All patients were divided into two groups – the deceased group (n = 40) and the surviving group (n = 40).
Results. In patients who comprised the main study group (deceased individuals from ischemic stroke or its complications), hospital mortality was associated with the initial severity of the condition due to reduced consciousness (31 (69%); p ≤ 0.001), a short hospital stay (27 (60%); p ≤ 0.001), unstable hemodynamics and respiratory failure (25 (55.5%); p ≤ 0.001), necessitating the use of mechanical ventilation (20 (44.4%); p ≤ 0.001) and a urological catheter (45 (100%); p ≤ 0.001), hypercreatinemia (238 ± 232 mmol/L; p ≤ 0.05), hyperglycemia (23 (51.1%); p ≤ 0.001), and hyperthermia (20 (44.4%); p ≤ 0.001), as well as signs of increasing brain edema with manifestations of displacement (17 (37.7%); p ≤ 0.001).
Conclusion. Results emphasize the importance of risk stratification of fatal outcomes, having in mind the calculated prognostic predictors for individual management for decreasing the chances for death in patients with ischemic stroke.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.