Клинические и параклинические характеристики при остром геморрагическом инсульте, связанные с ранней госпитальной летальностью
- Аннотация
- Статья
- Ссылки
- English
Цель – ретроспективно проанализировать потенциальные предикторы раннего летального исхода у пациентов с острым геморрагическим инсультом в стационаре.
Материал и методы. Выполнено ретроспективное исследование по типу «случай – контроль». В анализ вошли истории болезни 71 взрослого пациента с диагнозом «геморрагический инсульт», госпитализированного в инсультное отделение крупного многопрофильного стационара Бишкека (Национальный госпиталь при Министерстве здравоохранения Кыргызской Республики) с января по июнь 2021 г. Все пациенты были разделены на две группы – первую (выжившие) и вторую (умершие).
Результаты. Средний возраст пациентов во второй группе составил 59,8 ± 15,5 года, лиц мужского пола насчитывалось 44,8%. Наиболее значимыми предикторами, ассоциированными с ранним летальным исходом (по сравнению с показателями в первой группе), были изначальная тяжесть инсульта из-за выраженных нарушений сознания (кома) (66 и 5,7% соответственно; p < 0,001), нарушения функционирования жизненно важных органов (гипоксемия – 62 и 11,4%; p < 0,001; тахикардия – 51 и 14,3%; p < 0,006), необходимость в искусственной вентиляции легких и катетеризации мочевого пузыря (100 и 0%; p < 0,001), согласно данным нейровизуализационного исследования, угрожающий отек мозга с признаками вклинения (50 и 20%; p < 0,006) и экспансией гематомы в желудочковую систему (60 и 20%; p < 0,006), нарушение углеводного обмена (гипергликемия) (65 и 16,7%; p < 0,001) и терморегуляции (гипертермия) (55 и 2,9%; p < 0,001), нарушение функционирования почек (нефротический синдром, гиперкреатинемия) (65 и 16,7% соответственно; p < 0,001).
Заключение. При госпитализации пациенты второй группы отличались от пациентов первой группы тем, что неблагоприятному исходу способствовали тяжелое исходное состояние, сочетание внутримозгового и внутрижелудочкового кровоизлияния, нарастающий отек мозга с явлениями компрессии и дислокации, мультиорганная недостаточность.
Цель – ретроспективно проанализировать потенциальные предикторы раннего летального исхода у пациентов с острым геморрагическим инсультом в стационаре.
Материал и методы. Выполнено ретроспективное исследование по типу «случай – контроль». В анализ вошли истории болезни 71 взрослого пациента с диагнозом «геморрагический инсульт», госпитализированного в инсультное отделение крупного многопрофильного стационара Бишкека (Национальный госпиталь при Министерстве здравоохранения Кыргызской Республики) с января по июнь 2021 г. Все пациенты были разделены на две группы – первую (выжившие) и вторую (умершие).
Результаты. Средний возраст пациентов во второй группе составил 59,8 ± 15,5 года, лиц мужского пола насчитывалось 44,8%. Наиболее значимыми предикторами, ассоциированными с ранним летальным исходом (по сравнению с показателями в первой группе), были изначальная тяжесть инсульта из-за выраженных нарушений сознания (кома) (66 и 5,7% соответственно; p < 0,001), нарушения функционирования жизненно важных органов (гипоксемия – 62 и 11,4%; p < 0,001; тахикардия – 51 и 14,3%; p < 0,006), необходимость в искусственной вентиляции легких и катетеризации мочевого пузыря (100 и 0%; p < 0,001), согласно данным нейровизуализационного исследования, угрожающий отек мозга с признаками вклинения (50 и 20%; p < 0,006) и экспансией гематомы в желудочковую систему (60 и 20%; p < 0,006), нарушение углеводного обмена (гипергликемия) (65 и 16,7%; p < 0,001) и терморегуляции (гипертермия) (55 и 2,9%; p < 0,001), нарушение функционирования почек (нефротический синдром, гиперкреатинемия) (65 и 16,7% соответственно; p < 0,001).
Заключение. При госпитализации пациенты второй группы отличались от пациентов первой группы тем, что неблагоприятному исходу способствовали тяжелое исходное состояние, сочетание внутримозгового и внутрижелудочкового кровоизлияния, нарастающий отек мозга с явлениями компрессии и дислокации, мультиорганная недостаточность.


Введение
Тенденция к увеличению бремени неинфекционных хронических заболеваний, включая инсульт, в развивающихся странах вызывает большую озабоченность [1]. По оценкам Всемирной организации здравоохранения (ВОЗ), к 2030 г. 80% всех инсультов случится у людей, проживающих в странах с низким и средним уровнем дохода, – 7,9% смертей в структуре общей смертности [2].
Среди причин смертности в Кыргызской Республике болезни системы кровообращения находятся на первом месте [3]. Заболеваемость инсультом, по данным регистра мозгового инсульта г. Бишкек, составляет 2,6–2,67 случая на 1000 населения, смертность – 1,17, госпитальная летальность – 14,3%, летальность на дому – 51,3% [3].
Заболеваемость ишемическим инсультом составляет 1,87 на 1000 населения (мужчины – 1,64, женщины – 2,06), тогда как геморрагическим инсультом (ГИ) – 0,54 на 1000 населения. По сравнению с ишемическим инсультом процент смертности от ГИ выше [4]. В Кыргызстане он составляет 54,4% [3].
При сравнении данных за 2007–2011 и 2017–2018 гг. отмечается положительная динамика показателей заболеваемости, смертности и госпитальной летальности. Согласно данным мозгового регистра г. Бишкек [3, 5], в 2007–2011 и 2017–2018 гг. имела место следующая эпидемиологическая картина. Показатели заболеваемости и смертности от инсульта остались на прежнем уровне. Тем не менее доля умерших в стационаре снизилась почти вдвое – с 25,7 до 14,3%. Это свидетельствует о том, что, во-первых, в Кыргызской Республике меры первичной и вторичной профилактики недостаточны. Во-вторых, число тяжелых форм инсульта, приводящих к смерти (в основном за счет геморрагического инсульта), по-прежнему велико и плохо поддается контролю. В-третьих, уровень госпитальной помощи инсультным больным улучшается, несмотря на то, что не введены повсеместно в государственные больницы современные методы лечения инсульта, включая малоинвазивные и эндоскопические, а реабилитация недоступна значительной части пациентов.
Следовательно, в ближайшее время возрастающее бремя инсульта в регионе будет ресурсозатратным для перегруженной организации системы здравоохранения.
В развивающихся странах, таких как Кыргызстан, ресурсов для лечения и реабилитации пациентов после инсульта недостаточно, особенно в медицинских учреждениях первичного и вторичного звена здравоохранения [3]. Между тем эксперты ВОЗ подчеркивают важность разработки надежных национальных стратегий по контролю и мониторингу заболеваемости и исходов инсульта, прежде всего в развивающихся странах [6, 7].
Цель – ретроспективно проанализировать клинико-анамнестические, лабораторно-инструментальные данные и последующие события, имевшие место на госпитальном этапе у больных ГИ, и их влияние на исход заболевания.
Материал и методы
Выполнено ретроспективное исследование по типу «случай – контроль» медицинских записей (историй болезни) инсультного отделения в период с января по июнь 2021 г. для анализа предикторов ранней госпитальной летальности среди пациентов с геморрагическим инсультом в больнице третичного уровня Бишкека (Национальный госпиталь (НГ) при Министерстве здравоохранения Кыргызской Республики). Больница представляет собой крупное (республиканского масштаба) лечебно-профилактическое учреждение третичного уровня, расположенное в столице Кыргызстана. Она принимает пациентов из всех регионов страны и предоставляет им медицинскую помощь по всем нозологиям. В большинстве случаев лечение покрывается страховкой обязательного медицинского страхования населения согласно программе госгарантий.
Были проанализированы истории болезни выживших (первая группа) и умерших (вторая группа), госпитализированных в НГ по линии скорой помощи, при самообращении либо переводе из учреждений вторичного уровня республики в течение 24 часов после появления симптомов ГИ, соответствовавших определению ВОЗ (быстро развивающиеся клинические признаки очагового или глобального нарушения функционирования мозга, продолжающиеся более 24 часов или до смерти, в отсутствие какой-либо другой несосудистой причины, лежащей в основе их появления [8], что подтверждено результатами нейровизуализационного исследования).
Критерии включения в исследование:
- нахождение в отделении на лечении по поводу ГИ или смерть в стационаре, причиной которой прямо или вследствие развития осложнений стал ГИ;
- случаи ГИ, подтвержденные результатами нейровизуализационного исследования мозга;
- возраст ≥ 18 лет;
- первый или повторный инсульт;
- отсутствие других тяжелых патологий или их осложнений, которые могли стать причиной смерти.
Критерии исключения:
- смерть в течение 24 часов в стационаре до того, как была проведена нейровизуализация;
- ишемический инсульт, в том числе с геморрагической трансформацией;
- кровоизлияние в опухоль мозга;
- кровоизлияние вследствие черепно-мозговой травмы;
- смерть в стационаре, причиной которой были (прямо или вследствие развития осложнений) другие тяжелые заболевания;
- возраст младше 18 лет.
Были собраны социальные, демографические, а также клинические характеристики, в том числе уровень артериального давления (АД) и частота сердечных сокращений, данные социального и семейного анамнеза, информация о тяжести инсульта, функциональной способности до инсульта. Оценивались тяжесть состояния по функционированию жизненно важных органов [9] и неврологический статус, показатели по шкале комы Глазго (ШКГ). Компьютерная или магнитно-резонансная томография выполнялись всем пациентам в течение первых 24 часов с момента развития симптомов. Типы ГИ были дифференцированы либо как внутримозговое кровоизлияние (ВМК), либо как субарахноидальное. Лечение проводилось по общепринятым международным стандартам ведения больных ГИ.
Осуществлена статистическая обработка данных. Достоверность различий показателей определяли исходя из параметрического t-критерия Стьюдента. Нулевую гипотезу отвергали при р < 0,05. Статистический анализ данных проводили с помощью программы SPSS 23.
Результаты
Ретроспективно проанализирована 71 история болезни пациентов с окончательным диагнозом ГИ (отделение ангионеврологии НГ), госпитализированных с января по июнь 2021 г. Клинико-демографическая характеристика выживших и умерших на момент первичного осмотра представлена в табл. 1 и 2. Как видим, исследуемые группы репрезентативны.
Основные клинико-демографические показатели выживших и умерших были схожими, цифровые значения статистически не отличались.
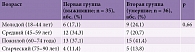
Средний возраст в группе умерших (16 (55,2%) женщин) составил 59,8 ± 15,5 года.
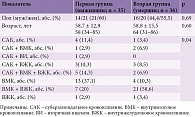
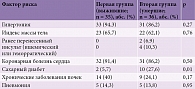
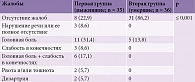
Гипертония, коронарная болезнь сердца и избыточная масса тела были наиболее распространенными факторами риска инсульта как среди умерших, так и среди выживших. Реже встречались хронические заболевания почек и легких. Статистически достоверной разницы между исследуемыми группами по данным факторам риска не отмечалось (табл. 3). Между тем выявлена статистически достоверная разница между частотой встречаемости сахарного диабета (СД) среди умерших и выживших. Сахарный диабет 2-го типа ассоциировался с летальным исходом у 10 (27,6%) пациентов (p ≤ 0,01). Среди выживших СД имел место только в 2 (5,7%) случаях.
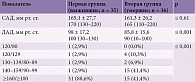
Необходимо отметить различия между двумя группами пациентов в отношении повышения уровня АД, разницы между уровнями систолического АД (САД) и диастолического АД (ДАД) на момент поступления в отделение (табл. 4). Так, при сравнении уровней САД и ДАД между группами установлено, что у пациентов второй группы при госпитализации фиксировались достоверно более низкие цифры диастолического АД – 85,8 ± 15,6 мм рт. ст. (p ≤ 0,001). Во второй группе по сравнению с первой отмечался большой разброс градаций АД согласно классификации AHA-2017 (Американская ассоциация кардиологов). Если у большинства пациентов первой группы (31 (88,6%)) при госпитализации наблюдались высокие показатели АД, а именно ≥160/≥100 мм рт. ст., то у пациентов второй группы – относительно невысокие (p ≤ 0,001).
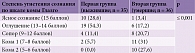
У пациентов с ГИ второй группы (табл. 5) на момент поступления в отделение отсутствовали жалобы из-за нарушенного сознания – 31 (86,2%) случай. В 5 (13,8%) случаях пациенты жаловались только на головную боль. У пациентов первой группы зафиксированы жалобы иного характера: нарушение речи, слабость в конечностях, тошнота и/или рвота либо их сочетание – 27 (77,1%) случаев. В 8 (22,9%) случаях отсутствие жалоб объяснялось выраженной общемозговой симптоматикой (p ≤ 0,001).
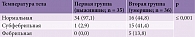
Гиперергическая реакция в виде лихорадки в дебюте заболевания наблюдалась у 20 (55,2%) пациентов второй группы, у 15 (41,4%) из них температура достигала субфебрильных цифр (до 38 °С), а у 5 (13,8%) – фебрильных. Нормальная температура тела отмечалась у 16 (44,8%) больных. В то же время в первой группе температура достигла субфебрильных значений только у 1 (2,9%) пациента. В 34 (97,1%) случаях дебют заболевания происходил на фоне нормальной температуры тела. Зарегистрирована статистически достоверная разница между группами по данному показателю (табл. 6).
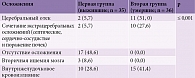
Функции жизненно важных органов были значимо нарушены у пациентов с ГИ, степень их отклонения достоверно отличалась от степени нарушений в группе выживших. Такие симптомы дыхательной и сердечно-сосудистой недостаточности, как тахипноэ, гипоксемия и тахикардия, во второй группе встречались в три-четыре раза чаще, чем в первой (табл. 7).
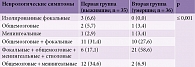
В неврологическом статусе пациентов обеих групп наблюдались четыре вида симптомокомплексов: общемозговой, очаговый, менингеальный и вторичный стволовой. Установлена статистически достоверная межгрупповая разница в частоте развития неврологических симптомов. У пациентов второй группы достоверно чаще выявлялась грубая неврологическая симптоматика, которая в 21 (58,6%) случае проявлялась сочетанием общемозговых, очаговых, менингеальных симптомов, иногда стволовыми симптомами. В первой группе сочетанная симптоматика имела место лишь у 6 (17,1%) пациентов. Что касается особенностей неврологической картины у выживших, наиболее часто у них сочетались либо общемозговые и фокальные симптомы – 11 (31,4%) случаев, либо общемозговые и менингеальные симптомы – 12 (34,6%) случаев. Изолированные неврологические синдромы регистрировались значительно реже (табл. 8).
Первое место в клинической картине ГИ в нашей выборке занимала общемозговая симптоматика в виде нарушения сознания, причем во второй группе отмечалась статистически достоверная разница в глубине его нарушения. Так, у 29 (79,3%) пациентов этой группы имело место грубое угнетение сознания до степени сопора или комы, тогда как у 29 (82,9%) пациентов первой группы сознание либо не нарушалось, либо нарушалось до степени оглушения с учетом баллов по ШКГ (табл. 9). Этот показатель крайне информативен в аспекте прогнозирования клинического исхода.
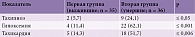
Один из важных показателей тяжести состояния и нарушения сознания – потребность в применении урологического катетера. Он был установлен 36 (100%) пациентам второй группы и 11 (31,4%) – первой (≤ 0,001).
Еще более грозным показателем тяжести инсульта является необходимость в искусственной вентиляции легких (ИВЛ). В ИВЛ нуждались 27 (75,8%) пациентов второй группы, при этом сроки подключения к аппарату ИВЛ были разные. По данному параметру обнаружена высокая степень достоверности различий между группами: ИВЛ не потребовалась ни одному пациенту первой группы (≤ 0,001) (табл. 10).
При анализе церебральных и экстрацеребральных осложнений инсульта выявлены статистически достоверные различия между группами (≤ 0,001). Так, у умерших самым частым осложнением было внутрижелудочковое кровоизлияние – 15 (41,4%) случаев, более редким – церебральный отек – 11 (31%). В 10 (27,6%) случаях имела место комбинация экстрацеребральных осложнений (септических, сердечно-сосудистых и поражение почек). У 17 (48,6%) пациентов первой группы заболевание протекало без осложнений. Самым частым осложнением в первой группе, равно как и во второй, было внутрижелудочковое кровоизлияние – 10 (28,6%). В единичных случаях наблюдались церебральный отек – 2 (5,7%), комбинированные осложнения – 2 (5,7%) и вторичная ишемия мозга – 3 (8,6%) пациентов (табл. 11).
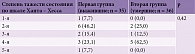
У 21 пациента с субарахноидальным кровоизлиянием не отмечалось статистически достоверной разницы между группами при оценке тяжести состояния по шкале Ханта – Хесса. У 5 (62,5%) пациентов второй группы имела место 4-я степень тяжести состояния, тогда как у 6 (46,2%) пациентов первой – более легкая, 2-я (табл. 12).
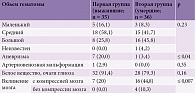
Объем излившейся крови в головном мозге у пациентов обеих групп варьировался. Наблюдались малые (до 30 мм3), средние (30–50 мм3) и крупные (более 50 мм3) кровоизлияния. Во второй группе преобладали кровоизлияния большого (16 (45,8%)) и среднего объема (15 (41,7%)), в первой группе – среднего объема. По данному параметру между группами не получено статистически достоверных различий. Артериовенозные мальформации диагностированы только у 1 (2,9%) пациента первой группы. Очаги глиоза в белом веществе встречались у большинства исследуемых с небольшим преобладанием в первой группе – 32 (91,4%) случая. Статистически достоверной разницы между группами не выявлено. Вклинение мозга как с компрессией (16 (44,8%)), так и без нее (4 (10,3%)) встречалось у 55,1% пациентов второй группы. В первой группе компрессия мозга наблюдалась на томограммах значительно реже – 7 (20%) случаев (табл. 13).
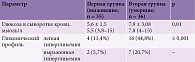
В процессе анализа оценивались параметры углеводного обмена. Уровень глюкозы в периферической крови был достоверно выше у пациентов второй группы. Его средние значения составили 7,9 ± 3,08 ммоль/л. В первой группе среднее значение концентрации глюкозы оставалось в пределах референсной нормы – 5,6 ± 1,5 ммоль/л. Гликемический профиль также отличался у пациентов обеих групп, что выражалось в более частом отклонении гликемического профиля в сторону легкой гипергликемии (164 (4,8%)) у пациентов второй группы. Выраженная гипергликемия наблюдалась реже – 7 (20,7%) случаев. У пациентов первой группы легкая и выраженная гипергликемия регистрировались значительно реже – 4 (11,4%) и 2 (5,7%) случая соответственно (табл. 14).
Уровень креатинина в сыворотке венозной крови был выше референсной нормы как у пациентов второй группы (180,6 ± 101 мкмоль/л), так и у пациентов первой (98,2 ± 37,8 мкмоль/л). Отклонения в показателях почечных тестов в сторону повышения, к которым отнесены также уровень мочевины и остаточного азота, наблюдались достоверно чаще во второй группе – 24 (65,5%) пациента. В первой группе нарушение функционирования почек наблюдалось только в 4 (11,4%) случаях (табл. 15).
Обсуждение
Геморрагический инсульт является одной из основных причин смерти и инвалидизации в мире. Кыргызстан – не исключение [3, 10].
Показано, что 35% пациентов с ГИ умирают в течение семи дней после него, а около 50% пациентов – в течение 30 дней. Большинство больных попадают в отделения интенсивной терапии. Раннее прогнозирование летальности и выявление факторов, связанных с ней, способны повлиять на уровень выживаемости за счет целевых вмешательств [11]. Не случайно целью настоящего исследования стал анализ клинико-анамнестических, лабораторно-инструментальных данных и последующих событий, имевших место во время лечения, и степени их влияния на исход больных ГИ.
В нашем исследовании как умершие, так и выжившие в 4/5 случаев имели гематомы среднего и большого размера, которые и вызвали острое начало неврологических синдромов (общемозговой, очаговой, менингеальной, стволовой).
Несмотря на одинаковое соотношение пациентов с гематомами среднего и большого размера, симптомы в группах отличались. Так, у пациентов второй группы достоверно чаще регистрировались грубые нарушения сознания в виде сопора или комы (79,3% случаев), тогда как пациенты первой группы достоверно чаще (82,9% случаев) имели ясное сознание или его негрубое угнетение (оглушение). На связь нарушения сознания с неблагоприятным клиническим исходом указывали и другие авторы [12], наблюдавшие неблагоприятные исходы у пациентов с гематомами большого размера. Нарушение сознания – следствие повышения внутричерепного давления со сдавлением или деформацией ретикулярной активирующей системы, таламуса и ствола головного мозга [13].
Кроме того, у пациентов второй группы достоверно чаще наблюдались признаки нарушения функционирования жизненно важных органов и обмена веществ вследствие таких состояний, как тахипноэ, гипоксия, тахикардия, артериальная гипертензия и гипертермия с гипергликемией. Появление подобных нарушений объясняется вовлечением в патологический процесс центров вегетативного контроля вследствие либо непосредственного топического соседства самой гематомы со структурами лимбико-ретикулярного комплекса, либо прогрессирующим отеком головного мозга и ущемлением жизненно важных центров, расположенных в стволе головного мозга [14]. Быстрая клиническая эволюция симптомов может происходить в течение нескольких часов с развитием острой реактивной внутричерепной гипертензии, которая особенно заметна при гематомах средней и большой величины [15].
Выраженная гипоксемия и грубое угнетение сознания также стали причиной подключения 80% пациентов второй группы к аппарату ИВЛ в разные сроки после госпитализации. На связь между необходимостью использования аппарата ИВЛ и высокой летальностью указывали и другие авторы. Так, японские ученые провели ретроспективное исследование влияния ИВЛ на внутрибольничную летальность у пациентов в коме с неоперабельным ВМК [16]. Летальность коматозных больных, подключенных к аппарату ИВЛ, по данным японских исследователей, составила 80% [16]. В то же время другие исследователи отмечали большой разброс частоты данного фактора – 57–90% [6].
Патологические паттерны дыхания – хорошо известное явление у коматозных пациентов с ВМК. У таких больных респираторный дистресс-синдром возникает в день госпитализации либо в раннем постинсультном периоде [17].
По данным ряда авторов, летальный исход часто ассоциируется с респираторным дистресс-синдромом (и последующим подключением к аппарату ИВЛ) и с такими факторами, как внутрижелудочковое кровоизлияние, компрессия ствола мозга и патологическая реакция зрачков на свет [18].
Некоторые авторы выделяют такое состояние, как «синдром внезапной смерти при мозговом инсульте». Его патогенез детально не изучен, но в его основе лежат в том числе нейрогенные причины: прогрессирующий отек головного мозга с развитием рострокаудального повреждения, острая окклюзионная гидроцефалия после субарахноидального кровоизлияния, геморрагическая трансформация зоны инфаркта и вторичный стволовой синдром. Перечисленные причины усиливают явления отека головного мозга и вызывают компрессию его жизненно важных центров [14].
Самым частым церебральным осложнением у пациентов второй группы была экспансия гематомы во внутрижелудочковое пространство, за ней следовал прогрессирующий отек головного мозга с дислокацией срединных структур и компрессией мозга.
Самым частым экстрацеребральным осложнением было сочетание септических и сердечно-сосудистых нарушений с поражением почек по данным лабораторных и инструментальных исследований. Связь высокой госпитальной летальности с септическими, сердечно-сосудистыми осложнениями и острым поражением почек отражена в работах ряда исследователей [8, 9, 19]. По мнению авторов этих работ, взаимосвязь мозга с мочевыделительной системой опосредована вегетативной нервной системой, например ее симпатической частью, а также нейроэндокринной системой при участии воспалительного и иммунного ответа [20]. Тем не менее влияние ГИ на функцию почек не до конца изучено. Острое повреждение почек сочетается с гиперосмолярностью крови на фоне назначения маннитола для снижения внутричерепного давления, старшим возрастом, сопутствующей гипертонией. Почти 30% пациентов с ВМК имеют хроническую болезнь почек. В основном это пациенты старшей возрастной группы, женщины с сопутствующими заболеваниями, например сахарным диабетом. В большинстве случаев почечная дисфункция после ВМК – преходящее явление, редко требующее гемодиализа [21].
Подобные осложнения могут возникать в рамках синдрома мультиорганной недостаточности, считающегося ведущей причиной смерти у реанимационных пациентов. Синдром определяется как прогрессирующая дисфункция двух и более органов с нарушением системного гомеостаза. Он имеет место у 14% поступающих в блок интенсивной терапии и ответствен за 80% смертей. Во время первых недель у пациентов с тяжелым инсультом развивается неадекватный генерализованный воспалительный ответ, который создает благоприятные условия для присоединения медицинских осложнений, таких как отек мозга, пневмония, инфекция мочевыводящих путей, сердечная недостаточность, стрессовые язвы, тромбозы вен [22, 23].
Выводы
Как показывают результаты нашего исследования, распространенными предикторами раннего летального исхода у больных ГИ могут быть грубые нарушения сознания, экспансия гематомы в желудочковую систему, прогрессирующий отек головного мозга с дислокацией срединных структур и ущемлением мозга, присоединение мультиорганной недостаточности. Часть из них схожа, а часть отличается от тех, которые были получены нами в аналогичной работе с участием пациентов с ишемическим инсультом [24].
Ограничения исследования. Данное исследование было одноцентровым. Как известно, госпитальная летальность может быть связана с недостаточным уровнем медицинского обслуживания – обеспеченностью стационара высокоточным лечебным и диагностическим оборудованием, медикаментами с доказанной эффективностью, квалификацией медицинского персонала в отношении ведения инсультных больных. Исследование было ретроспективным. Для более надежной интерпретации и импликации его результатов на другие лечебно-профилактические учреждения необходимы дальнейшие проспективные когортные исследования.
D.I. Bakaeva, E.M. Mamytova, PhD, L.R. Akhmadeeva, PhD, Prof., Kh. Musaeva, E.K. Zholdoshev, M.O. Isrofilov, PhD
I.K. Akhunbayev Kyrgyz State Medical Academy
Bashkir State Medical University
Academy of Sciences of Bashkortostan Republic
Abuali ibni Sino Tajik State Medical University
Contact person: Leila R. Akhmadeeva, Leila_ufa@Mail.ru
There is limited data on predictors of early hospital mortality in patients with hemorrhagic stroke in low-income countries, such as the Kyrgyz Republic.
Purpose to conduct a retrospective analysis of predictors of early mortality taken from the data of medical records of deceased in-patients with hemorrhagic stroke.
Material and methods. Research design – retrospective, ‘case – control’. The analysis included the case histories of 71 adults diagnosed with hemorrhagic stroke who were treated in the stroke department of a large multidisciplinary hospital (National Hospital under the Ministry of Health of the Kyrgyz Republic) in Bishkek in the period from january to june 2021. All patients were divided into 2 groups: deceased and survivors.
Results. The average age of patients in the group of deceased was 59.8 ± 15.5 years; males – 44.8%. The results of our study showed that the most significant predictors of mortal outcomes were the initial severity of stroke due to severe disorders of consciousness (coma) (accordingly 66 and 5.7%; p < 0.001), impaired functioning of vital organs (hypoxemia – 62 and 11.4%; p < 0.001; tachycardia – 51 and 14.3%; p < 0.006), the need for artificial ventilator and catheterization of the bladder (100 and 0%; p < 0.001), neuroimaging picture of threatening cerebral edema with signs of its insertion (50 and 20%; p < 0.006) and expansion of hematoma into the ventricular system (60 and 20%; p < 0.006), impaired carbohydrate metabolism (hyperglycemia) (65 and 16.7%; p < 0.001) and thermoregulation (hyperthermia) (55 and 2.9%; p < 0.001), as well as impaired kidney function (nephrotic syndrome, hypercreatinaemia) (accordingly 65 and 16.7%; p < 0.001).
Conclusion. Patients who were included in the main study group (deceased persons from hemorrhagic stroke or its complications) were notable for the fact that a severe initial condition, a combination of intracerebral and intraventricular hemorrhage, increasing swelling of the brain with the phenomena of its compression and dislocation, the development of multiorgan insufficiency could lead to an unfavorable outcome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.