Фармакотерапия коморбидной инсомнии у пациентов с ноктурией или хронической болью
- Аннотация
- Статья
- Ссылки
- English



Введение
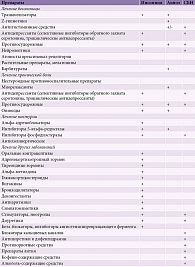
Каждый пятый российский пациент, который обращается за медицинской помощью, предъявляет жалобы на бессонницу [1]. Распространенность инсомнии среди пожилых пациентов составляет 32,9% [2]. В группе неврологических пациентов коморбидность инсомнии достигает 83,3% [3]. В 90% случаев выявленная бессонница носит вторичный характер на фоне психических, соматических или сомнологических заболеваний. Как правило, инсомния сопровождает психические, сердечно-сосудистые, неврологические, гастроинтестинальные, дыхательные и урологические расстройства (табл. 1) [4]. Болевые синдромы, входящие в топ-5 самых распространенных причин обращения к врачу вместе с нарушениями сна [5], сочетаются с инсомнией у 48% пациентов [4]. Ноктурия, характерная для трети лиц в возрасте 30 лет и как минимум для 60% пациентов старше 60 лет [6], является ведущей причиной ночных пробуждений в 40–77% случаев [6]. Кроме того, наличие инсомнии существенно повышает риск ухудшения или развития коморбидных расстройств (табл. 2).
В то же время нельзя забывать о влиянии собственно лекарственных препаратов: лечение основного заболевания может вызвать или усугубить нарушение сна (табл. 3) [7–11]. Например, использование миорелаксантов и транквилизаторов при миофасциальном синдроме в сочетании с инсомнией может спровоцировать апноэ во сне и фрагментацию сна. Применение антидепрессантов при нейропатической боли в сочетании с инсомнией способно вызывать или усиливать синдром беспокойных ног и проявления инсомнии. В связи с этим терапия должна быть направлена на устранение не только ведущей причины бессонницы, но и собственно нарушений сна. Понимание механизмов влияния инсомнии, а также методов профилактики и лечения нарушений сна позволит существенно повысить контроль, безопасность и эффективность лечения пациентов с коморбидной бессонницей.
Взаимовлияние инсомнии и коморбидных состояний
Патогенетические механизмы коморбидности инсомнии целесообразно рассматривать с позиции влияния не только основного заболевания на формирование бессонницы, но и собственно нарушений сна на развитие коморбидного состояния.
Проанализировав коморбидность хронической боли и инсомнии, исследователи предположили, что не столько боль нарушает сон, сколько нарушенный сон способствует возникновению хронической боли [12]. Одним из механизмов развития нарушений сна при длительном течении болевого синдрома считается стрессовое воздействие боли с активацией гипоталамо-гипофизарно-надпочечниковой системы. В результате баланс системы поддержания сна вентролатерального ядра, выделяющего ГАМК и галанин, смещается в сторону системы поддержания бодрствования, которая опосредует влияние через нейромедиаторы гистамин (регулирует активность коры и бодрствование), орексин, ацетилхолин, норэпинефрин, серотонин, допамин. Именно этим объясняется спектр препаратов, назначаемых при бессоннице. Эффекты центро-латерального ядра ингибируются посредством норадреналина и ацетилхолина. Поэтому стрессовая реакция с характерным повышением уровня адренокортикотропного гормона, норадреналина и кортизола закономерно нарушает процесс засыпания, непрерывность сна и процесс последующего бодрствования [13]. Кроме того, активация гипоталамо-гипофизарно-надпочечниковой оси запускает гиперсекрецию цитокинов и провоспалительных факторов, что влечет за собой изменение иммунной активности и нарушение баланса нейромедиаторов антиноцицептивной реакции, в частности серотонина и допамина. Таким образом, боль как стрессовая реакция и инсомния поддерживают друг друга. Это находит подтверждение в научных работах. Показано, что непродолжительный сон или его полная депривация повышает чувствительность к боли [14]. Длительное использование опиоидов способно нарушать структуру сна и тем самым способствовать усилению боли [15]. Как показали результаты изучения структуры сна, расстройство сна может фактически подавлять процесс облегчения боли.
В случае коморбидности ноктурии и инсомнии имеют место сходные с хронической болью механизмы активации стрессовой реакции в ответ на фрагментацию сна из-за ночного пробуждения для мочеиспускания. Увеличение уровня катехоламинов сопровождается не только микроактивациями со снижением качества сна или макропробуждениями со сложностью повторного засыпания, но и стимуляцией альфа-адренорецепторов гладких мышц нижних мочевыводящих путей и сокращением мочевого пузыря, что в свою очередь способствует поддержанию ноктурии. Таким образом, инсомния наряду с уменьшением емкости мочевого пузыря и суточной и ночной полиурией считается самостоятельной причиной ноктурии [16].
Следует отметить, что ночная полиурия также может быть обусловлена нарушением сна. При сочетании инсомнии и апноэ во сне включается дополнительный механизм формирования ноктурии. Периодические остановки дыхания с десатурацией и нарушением структуры сна, характерные для апноэ, чередуются с усиленными попытками восстановления дыхания. Это повышает внутригрудное давление и давление в правом желудочке, рефлекторную продукцию предсердного натрийуретического гормона и экскрецию натрия и воды в отсутствие должного повышения антидиуретического гормона, что обусловливает ночную полиурию [17].
Мочеиспускание с полным мочевым пузырем при апноэ отличает ночное мочеиспускание со слабой и/или прерывистой струей при доброкачественной гиперплазии предстательной железы (ДГПЖ). Тем не менее отсутствие лечения апноэ во сне ухудшает функцию детрузора мочевого пузыря и в 2–5 раз повышает риск развития ДГПЖ в старшей возрастной группе, что также способствует развитию гиперактивного мочевого пузыря (ГАМП) и усугубляет ноктурию [18, 19].
Итак, сочетание нарушений сна и ноктурии или хронической боли широко распространено в популяции. Учащение мочеиспускания и усиление боли приводят к снижению качества сна и его фрагментации, а нарушения сна повышают интенсивность симптомов основного заболевания и приводят к его хронизации. Так формируется замкнутый круг. Сказанное подтверждает роль коррекции нарушений сна в качестве самостоятельного облигатного направления лечения основного заболевания.
Принципы лечения нарушений сна
Согласно консенсусу сомнологов всего мира, сегодня первой линией лечения хронической инсомнии, особенно рефлекторного и психофизиологического генеза, является когнитивно-поведенческая терапия (КПТ) [20–22]. Успех КПТ зависит от сохранности когнитивных функций пациента и количества проведенных сессий. Тем пациентам, которым данный вид лечения недоступен или эффективность КПТ в течение месяца недостаточна, рекомендуется назначение фармакотерапии.
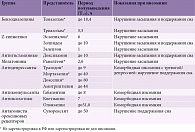
Медикаментозная терапия бессонницы предполагает использование фитопрепаратов, мелатонинов и агонистов мелатониновых рецепторов, бензодиазепинов, небензодиазепиновых Z-гипнотиков, антагонистов орексиновых рецепторов, противоэпилептических препаратов. В России также широко применяются психотропные препараты седативного действия (антигистаминные средства, четырехциклические, трициклические и ингибирующие обратный захват серотонина антидепрессанты), нейролептики (табл. 4) [7, 20–22].
Общая тенденция последних пяти лет сводится к сокращению как длительности курса (до 2–4 недель), так и действия самого препарата при лечении хронической бессонницы. Предпочтение отдается средствам с более коротким периодом полувыведения и возможностью минимизации дневной сонливости и рисков зависимости, в том числе за счет титрации дозы. Наличие информации о времени действия препаратов позволяет прицельно подходить к их выбору (либо исключительно для улучшения сна, либо для решения проблемы пробуждений в течение всего периода сна), а также прогнозировать вероятность проявления дневной сонливости в случае применения медикаментов, период действия которых превышает длительность сна (табл. 4) [7, 20–22]. Не меньшее значение при выборе препарата имеет возможность улучшения качества сна с сохранением глубокого сна. Например, таким свойством характеризуются антигистаминные препараты [23, 24].
Особое внимание уделяется группам пациентов, у которых применение фармакотерапии ассоциируется с высоким риском развития осложнений. Речь, в частности, идет о беременных, у которых фармакотерапия ограничена растительными средствами и антигистаминными препаратами ввиду приоритетов в отношении безопасности матери и плода. Особый подход необходим и к группе пожилых пациентов, у которых лекарственная терапия сопряжена с удлинением сроков элиминации ряда препаратов и увеличением риска травматизации под воздействием лекарственных средств. В исследованиях отмечалось повышение риска падения в 4,3 раза на фоне приема золпидема пожилыми пациентами [21, 25]. Кроме того, в зоне внимания находятся коморбидные пациенты. Риск побочных эффектов лекарственных средств и сопутствующая патология существенно затрудняют выбор терапии в такой группе больных.
Особенности лечения хронического болевого синдрома и ноктурии в аспекте нарушений сна
Хроническая боль
Лечение хронической боли по патогенетическому принципу подразумевает подавление хронического воспаления и повреждения костных и хрящевых структур, снижение периферической и центральной сенситизации. С этой целью помимо нестероидных противовоспалительных средств, анальгетиков и нейротропных витаминов в практике широко используются миорелаксанты, транквилизаторы-анксиолитики, антидепрессанты, антиконвульсанты, нейролептики, имеющие выраженные побочные эффекты в отношении сна.
Большинство препаратов с миорелаксирующим и седативным действием подавляют дыхательную функцию на центральном и/или периферическом уровне. Наиболее ярко это проявляется у представителей группы бензодиазепинов и опиатов. Высокая распространенность апноэ во сне показана у пациентов, длительно принимающих опиоидные препараты. В то же время отмечается повышение риска апноэ во сне на фоне хронической боли независимо от приема опиоидов [15]. Для пациентов с высоким риском остановки дыхания во сне или уже имеющимся ночным апноэ это сопряжено не только с фрагментацией сна для восстановления дыхания и ноктурии, но и с увеличением летальных и нелетальных осложнений в несколько раз. К таким последствиям относятся аритмия, инфаркт миокарда и инсульт [26].
Ингибиторы Н1-гистаминовых рецепторов в группе седативных препаратов выглядят более выигрышно. Как и любые седативные средства, они способны оказывать угнетающее действие на дыхательную функцию. Между тем в двойном слепом перекрестном плацебоконтролируемом исследовании влияния 15 мг доксиламина (Донормил) не наблюдалось ухудшения шкал апноэ во сне у испытуемых, 49% из которых отмечали храп [27].
Кроме того, психотропные препараты (антидепрессанты, противосудорожные, нейролептики), применяемые при хронической боли, способны вызывать или усиливать чувствительно-двигательные расстройства по типу синдрома беспокойных ног, периодических движений ног или злокачественного нейролептического синдрома. При этом периодические движения ног во сне могут уже присутствовать в клинической картине пациента с хронической болью на фоне полинейропатии или радикулопатии.
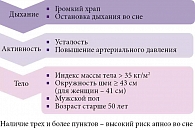
В отсутствие объективных данных о сне пациента (осмотра сомнолога, исследования сна) рекомендуется проводить скрининг с целью выявления риска нарушений дыхания во сне и двигательных расстройств (рисунок, врезка) [28, 29].
Ноктурия
В случае коморбидности ноктурии и бессонницы, особенно в сочетании с нарушениями дыхания во сне, речь идет не столько о влиянии на сон методов лечения ночных пробуждений для мочеиспускания, сколько возможностях коррекции нарушений сна в отношении повышения эффективности и безопасности лечения в долгосрочной перспективе.
Как правило, медикаментозная терапия ноктурии длительная, у многих пациентов пожизненная. Применение селективных альфа-адреноблокаторов при ДГПЖ устраняет сердечно-сосудистый риск, связанный с приемом неселективных препаратов, но не решает проблему нарушения сексуальной функции и эякуляции, что критично для активных пациентов. При этом около 30–40% пациентов не достигают стойкого эффекта от лекарственной терапии в отношении ноктурии, что является одним из показаний для хирургического лечения инфравезикальной обструкции [30]. Оперативное вмешательство, особенно у пожилых пациентов, сопряжено с высоким сердечно-сосудистым периоперационным риском и урологическими осложнениями после хирургического вмешательства. После устранения инфравезикальной обструкции до 55% пациентов нуждаются в продолжении медикаментозного лечения урологических симптомов [31]. В то же время коррекция инсомнии способствует улучшению ноктурии у 25–32% пациентов с эффективностью когнитивно-поведенческой терапии инсомнии около 31% [32], ПАП-терапия (Positive Airway Pressure – положительное давление в дыхательных путях) с целью устранения апноэ во сне – до 42,3% случаев коморбидной ноктурии [33].
В ряде небольших исследований зафиксировано улучшение всех урологических симптомов: полное устранение ночной полиурии – 100% пациентов, эректильной дисфункции – 42,6%, частичное улучшение симптомов эректильной дисфункции – 57,4% пациентов после восстановления дыхания во сне [34].
Возможности фармакологического лечения коморбидной инсомнии
Детальное изучение лекарственных средств позволяет выделить их преимущества и недостатки в каждом конкретном случае. При лечении коморбидной инсомнии важно понимать, на что именно и как долго должен влиять препарат. Рассмотрим эти возможности на примере доксиламина (Донормила).
Донормил – представитель группы антигистаминных средств обладает основным свойством ингибирования Н1-гистаминовых рецепторов и М-холинорецепторов с периодом полувыведения 10,3 часа.
Блокада Н1-гистаминовых рецепторов реализует седативный и снотворный эффекты, позволяя сократить время засыпания, улучшить качество сна без существенного влияния на его структуру. Продолжительность периода полувыведения доксиламина подходит пациентам с физиологической длительностью сна более 6–10 часов. Сонливость после пробуждения может отмечаться у более коротко спящих пациентов. Однако применять этот препарат можно не только при инсомнии засыпания, но и сложностях с поддержанием сна, стрессовой фрагментации сна. В результате снижаются симпатикотония и ее влияние на ноктурию и хроническую боль.
Возможное противоаллергическое действие антигистаминных средств помогает улучшить носовое дыхание у пациентов с аллергическим ринитом (фактор риска апноэ во сне). Тем самым снижается потенциальный риск доксиламина, как и любого седативного средства, ухудшения дыхания во сне. Кроме того, блокада Н1-гистаминовых рецепторов в центральной нервной системе способствует снижению центральной сенситизации на фоне длительного персистирования болевого синдрома и усилению действия анальгетиков, бензодиазепинов и нейролептиков при лечении хронической боли.
Ингибирование М-холинорецепторов провоцирует сухость во рту и снижение продукции мочи, что ограничивает применение доксиламина у пациентов с риском острой задержки мочи (почечная недостаточность, обструкция мочевыводящих путей, ДГПЖ), закрытоугольной глаукомой, но позволяет снижать рвотный рефлекс у беременных. В то же время М-холиноблокаторы являются препаратами первого выбора у пациентов с ГАМП, для которых также характерна ноктурия.
Исследований доксиламина не проводилось, но можно предположить, что его выраженное холинолитическое действие также будет проявляться в отношении симптомов ГАМП и ночных пробуждений из-за позывов на мочеиспускание у пациентов с коморбидной инсомнией. Продолжение обсуждения в диалоге со специалистами в области урологии может быть интересно и актуально для врачей, в меньшей степени сталкивающихся в практической деятельности с симптомами нижних мочевыводящих путей.
Таким образом, понимая механизм действия и точки приложения различных препаратов, можно составить индивидуальную схему лечения коморбидной инсомнии и ноктурии или хронической боли, повысив не только контроль терапии, но и ее безопасность и эффективность в отношении качества сна, жизни и здоровья пациента.
Заключение
Нарушения сна, ноктурия и хроническая боль – частые и социально значимые состояния, характеризующиеся высоким риском коморбидности. Лечение пациентов с коморбидными состояниями без учета влияния на сон может спровоцировать или значимо ухудшить качество сна и течение основного заболевания. В то же время на фоне терапии коморбидной инсомнии отмечаются повышение качества сна и жизни пациента, облегчение ведущих симптомов, снижение риска прогрессирования и хронизации болевых синдромов и урологических заболеваний. Группа пациентов, у которых терапия основного заболевания не дала должного эффекта либо которые лишены возможности коррекции коморбидной инсомнии, достаточно многочисленна. Поэтому изучение данного вопроса может существенно облегчить жизнь таких пациентов и предотвратить сопутствующие медицинские и бытовые риски.
Коморбидную инсомнию следует рассматривать как самостоятельный фактор риска формирования и развития хронической боли и ноктурии, а ее лечение – как облигатный компонент комплексной терапии пациента. Фармакологическое лечение должно проводиться с учетом влияния препаратов на качество сна, дыхание и двигательную активность во время сна. Доксиламин может занять достойное место в схеме индивидуальной терапии коморбидной бессонницы у беременных, лиц с аллергическим ринитом, хронической болью и ночными пробуждениями для мочеиспускания на фоне инсомнии с подтвержденным отсутствием риска острой задержки мочи.
Ye.V. Tsareva
Unison LCC
The International Society of Stress and Stressinduced Disorders Learning and Effective Control
Contact person: Yelena V. Tsareva, tsareva.ev@unisongroup.ru
Comorbidity of insomnia and nocturia or chronic pain syndromes is widespread in the general population and in general therapeutic practice patients. Comorbidity of insomnia and nocturia or chronic pain is explained by common pathogenetic mechanisms, which promote the development of the closed circle and chronization of the comorbid disease and sleep disorders. Pharmacotherapy for comorbid insomnia should take into account the duration of the drug effects and the risks of breating and movement disorders during sleep. Correction of sleep disorders is necessary to improve the safety and effectiveness of treatment of the underlying disease and the quality of life of comorbid patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.