Роль коррекции сомнологических расстройств в комплексной терапии акне у женщин
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить роль коррекции сомнологических расстройств в комплексной терапии акне у женщин.
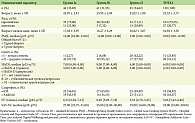
Материал и методы. Проведено проспективное одноцентровое наблюдательное исследование (с 2023 по 2024 г.) на 130 женщинах с акне легкой и средней степени тяжести, период наблюдения составил 16 недель. Тяжесть дерматоза определяли с помощью индекса GAGS; качество сна оценивали при помощи PSQI; психологическое тестирование проводили с использованием опросников HADS и SAS-SV; подсчет экранного времени осуществляли при помощи встроенных приложений для iOS ‘Screen Time’ и Android ‘Digital Wellbeing’; наличие метаболических нарушений включало подсчет индекса массы тела (ИМТ) (кг/м2) и IGF-1 (нг/мл).
Результаты. В исследовании выявлены факторы, прямо достоверно коррелирующие со степенью тяжести акне (GAGS) с PSQI, экранным временем, зависимостью от смартфона и ИМТ. Слабая корреляция наблюдалась с уровнем тревоги и депрессии. Тяжесть акне по GAGS на 16-й неделе снизилась во всех исследуемых группах по сравнению с исходным уровнем, наибольший регресс высыпаний зарегистрирован у пациентов, получавших 3 мг мелатонина, в группе Ia ‘poor sleepers’ на 59,00% и в группе II ‘good sleepers’ на 46,82% соответственно; в Ib группе ‘poor sleepers’ по GAGS снизился на 45,43%.
Заключение. Результаты исследования свидетельствуют о необходимости своевременной проверки на наличие расстройств сна и факторов, оказывающих влияние на качество сна у пациентов с акне легкой и средней степени тяжести. Раннее начало коррекции нарушений сна поможет повлиять на успешный исход терапии и улучшить качество жизни больных.
Цель исследования – оценить роль коррекции сомнологических расстройств в комплексной терапии акне у женщин.
Материал и методы. Проведено проспективное одноцентровое наблюдательное исследование (с 2023 по 2024 г.) на 130 женщинах с акне легкой и средней степени тяжести, период наблюдения составил 16 недель. Тяжесть дерматоза определяли с помощью индекса GAGS; качество сна оценивали при помощи PSQI; психологическое тестирование проводили с использованием опросников HADS и SAS-SV; подсчет экранного времени осуществляли при помощи встроенных приложений для iOS ‘Screen Time’ и Android ‘Digital Wellbeing’; наличие метаболических нарушений включало подсчет индекса массы тела (ИМТ) (кг/м2) и IGF-1 (нг/мл).
Результаты. В исследовании выявлены факторы, прямо достоверно коррелирующие со степенью тяжести акне (GAGS) с PSQI, экранным временем, зависимостью от смартфона и ИМТ. Слабая корреляция наблюдалась с уровнем тревоги и депрессии. Тяжесть акне по GAGS на 16-й неделе снизилась во всех исследуемых группах по сравнению с исходным уровнем, наибольший регресс высыпаний зарегистрирован у пациентов, получавших 3 мг мелатонина, в группе Ia ‘poor sleepers’ на 59,00% и в группе II ‘good sleepers’ на 46,82% соответственно; в Ib группе ‘poor sleepers’ по GAGS снизился на 45,43%.
Заключение. Результаты исследования свидетельствуют о необходимости своевременной проверки на наличие расстройств сна и факторов, оказывающих влияние на качество сна у пациентов с акне легкой и средней степени тяжести. Раннее начало коррекции нарушений сна поможет повлиять на успешный исход терапии и улучшить качество жизни больных.




Актуальность
Акне оказывает выраженное влияние на качество жизни пациентов вне зависимости от степени тяжести заболевания [1], пациенты имеют высокий риск развития тревожных и депрессивных состояний, нарушения самооценки, социальной дезадаптации, формирования дисморфофобии [2–4], что часто приводит к нарушению сна. Исследования, проведенные I.K. Altunay и соавт. в 2020 г. и M. Szepietowska и соавт. в 2023 г., демонстрируют, что женщины более подвержены тревожным расстройствам, чем мужчины [2, 5].
В современном мире неуклонно растет процент дерматологических пациентов с нарушениями сна [6]. Ряд исследований, проведенных на дерматологических пациентах, указывает на то, что существует двунаправленная связь между сном и кожными заболеваниями [7–10]. На качество сна могут оказывать влияние различные эндогенные и экзогенные факторы, в том числе источники синего света в виде различных цифровых устройств, таких как ноутбуки, смартфоны, которые способны нарушать циркадные ритмы и снижать синтез мелатонина [11–12]. Стоит отметить, что смартфон относится к одним из самых популярных портативных устройств, используемых человеком в течение дня, и может являться одной из причин, приводящих к нарушениям сна [13]. Женский пол в большей степени подвержен развитию диссомнии в любом возрастном периоде начиная с детства [14], кроме того, преимущественно женщины значительно чаще проводят время за экраном смартфона c возможным формированием зависимости от мобильного устройства [15].
В этом исследовании нашей основной целью являлась оценка роли коррекции расстройств сна в комплексной терапии акне у женщин. В задачи исследования входило определение распространенности диссомний и метаболических нарушений у женщин с акне, влияния психосоциальных факторов и длительности экранного времени смартфонов на качественные характеристики сна у женщин, страдающих акне, а также проведение сравнительной оценки динамики клинических симптомов акне у женщин в результате комплексной терапии с использованием мелатонина.
Материал и методы
Для оценки роли коррекции сомнологических расстройств у женщин в комплексной терапии акне было проведено проспективное одноцентровое наблюдательное клиническое исследование c 2023 г. по 2024 г., на базе кафедры кожных и венерических болезней ФГБОУ ВО «Российского университета медицины» Минздрава России.
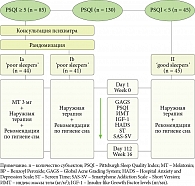
В исследование было включено 130 женщин с диагнозом акне легкой и средней степени тяжести, которые не получали специфического лечения на протяжении одного месяца. Тяжесть дерматоза определяли с помощью Global Acne Grading System (GAGS), где показатель 1–18 баллов означает легкую степень, от 19 до 30 баллов – среднюю, от 31 до 38 – тяжелую и свыше 38 баллов – очень тяжелую степень акне [16]. Средний возраст больных составил 23,32 ± 2,75 года. Пациенты были разделены на две сравниваемые группы (рис. 1). В качестве наружной терапии пациенты получали фиксированную комбинацию адапалена (0,1%) и бензоила пероксида (2,5%) один раз в день на ночь на чистую сухую кожу. Рекомендации по гигиене сна представлены в табл. 1 [17, 18].
Для определения уровня тревоги и депрессии использовали Hospital Anxiety and Depression Scale (HADS), состоящую из 14 вопросов, семь из которых оценивают тревожность (HADS-A) и семь определяют депрессию (HADS-D); набранные баллы означали: 0–7 – отсутствие симптомов, 8–10 – субклиническое течение, >11 – клинически выраженная тревога или депрессия [19]. Для подсчета среднего времени, проведенного за экраном смартфона в течение последней недели (ч/день), были использованы данные личных телефонов пациентов: приложение Screen Time для пользователей телефонов на платформе iOS, Digital Wellbeing для пользователей Android [20, 21]. Определение зависимости от смартфона проводилось при помощи опросника Smartphone Addiction Scale – Short Version (SAS-SV), утвержденного в Южной Корее M. Kwon и соавт. в 2013 г. Анкета состоит из 10 вопросов, оценка определяется по шестибалльной шкале (1 – полностью не согласен, 6 – полностью согласен). Женщины считаются зависимыми от смартфона при наборе > 33 баллов; высокий риск зависимости – от 22 до 33 баллов [22].
Индекс массы тела (ИМТ) рассчитывали путем деления веса (кг) на рост (м) в квадрате (кг/м2) [23]. Избыточную массу тела констатировали у пациенток европеоидной расы при ИМТ > 25,0, ожирение — при ИМТ ≥ 30,0; у азиатов – при ИМТ > 23,0 и ≥ 27,5 соответственно [24]. Уровень IGF-1 (нг/мл) определяли в образцах сыворотки крови больных акне с помощью прямого иммуноферментного анализа.
Критерии включения: в исследование вошли пациентки от 18 лет с акне легкой и средней степени тяжести, подписавшие согласие на участие в исследовании.
Критерии невключения: возраст участников менее 18 лет; наличие тяжелого соматического заболевания в стадии декомпенсации, онкологической патологии; инфекционных и гнойных заболеваний в области головы и шеи; пациенты с признаками манифестного психоза, поражения центральной нервной системы, тревожно-депрессивных расстройств тяжелой степени; отказ от участия в исследовании; предварительное лечение пациентов с использованием системных ретиноидов, антибиотиков, снотворных или психотропных препаратов за последние шесть месяцев. Из нашего исследования были исключены больные с тяжелой и очень тяжелой степенью тяжести заболевания, так как данная когорта пациентов, основываясь на клинических рекомендациях, в качестве терапии должна получать системную терапию в виде изотретиноина или пероральных антибиотиков [25] Побочные эффекты, вызванные системной терапией в виде повышенной сухости кожи, депрессии и возникновения внутричерепной гипертензии у предрасположенных лиц могут привести к нарушению качественных характеристик сна и повлиять на результаты исследования [25–27].
Описательная статистика представлена в виде числа и процента для категориальных переменных и в виде среднего значения и стандартного отклонения (SD) для числовых переменных при нормальном распределении, интерквартильный размах и медиана использовались при ненормальном распределении. Сравнения между двумя независимыми группами проводились с использованием U-критерия Манна – Уитни, когда они не были нормально распределены. Более двух независимых сравнений групп проводились с использованием однофакторного дисперсионного анализа (ANOVA), когда они были нормально распределены, и с использованием критерия Краскела – Уоллиса при ненормальном распределении признака. Категориальные переменные сравнивали с использованием критерия χ2. Для анализа связи между числовыми переменными использовали тест коэффициента корреляции Спирмена. Все различия считались статистически значимыми при p < 0,05. Анализ проводили с использованием программы Microsoft Excel (Redmond, WA, USA) и Jamovi version 2.3.28.
Результаты
Всего на прием обратились 234 женщины, 130 из которых согласно критериям включения/невключения были отобраны в качестве участниц исследования. Демографические и исходные клинические данные для данной популяции пациенток представлены в табл. 2.
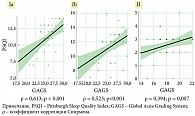
В представленном исследовании на 0-й неделе была зарегистрирована прямая сильная достоверная корреляционная связь у всех пациенток между степенью тяжести дерматоза по GAGS и PSQI (ρ = 0,839; p < 0,001); ST (ρ = 0,855; p < 0,001); средняя корреляционная связь с зависимостью от смартфона SAS-SV (ρ = 0,451; p < 0,001); слабая корреляционная связь наблюдалась с уровнем тревоги HADS-A (ρ = 0,222; p = 0,011) и депрессии HADS-D (ρ = 0,263; p = 0,022). Сомнологические расстройства, рассчитанные при помощи PSQI, прямо и достоверно коррелировали с ST (ρ = 0,924; p < 0,001); слабая корреляционная связь наблюдалась с SAS-SV (ρ = 0,374; p < 0,001).
Корреляционный анализ в исследуемых группах демонстрирует, что пациентки с нарушением сна имели более тяжелое течение дерматоза: Ia (ρ = 0,613; p < 0,001), Ib (ρ = 0,523; p < 0,001), чем пациентки из II группы good sleepers (ρ = 0,394; p < 0,001) (рис. 2).
Пациентки с зарегистрированными метаболическими расстройствами, основанными на подсчете ИМТ и IGF-1, имели более тяжелую степень дерматоза и отклонения в качественных характеристиках сна. Больные с избыточной массой тела на 0-й неделе имели достоверную прямую корреляционную связь со степенью тяжести дерматоза GAGS: в Ia группе (ρ = 0,526; p < 0,001), Ib группе (ρ = 0,525; p < 0,001), при этом отсутствовала корреляционная зависимость во II группе больных (ρ = 0,109; p = 0,478); сильная корреляционная связь c нарушением сна PSQI: в Ia группе (ρ = 0,894; p < 0,001), Ib группе (ρ = 0,867; p < 0,001), во II группе (ρ = 0,536; p < 0,001). Показатели ИМТ на 0-й неделе исследования предствлены в табл. 3. Была выявлена сильная корреляционная связь между BMI и ST (ρ = 0,653; p < 0,001), слабая корреляционная связь между BMI и SAS-SV (ρ = 0,206; p = 0,018).
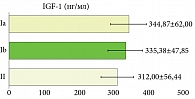
Показатели IGF-1 были выше в группе пациенток poor sleepers и отмечалась слабая корреляционная связь со степенью тяжести дерматоза в группе Ia poor sleepers (M = 344,87; SD = 62,00; ρ = 0,371; p = 0,013) и в группе II good sleepers (M = 312,00; SD = 56,44; ρ = 0,429; p = 0,003); отсутствовала корреляционная связь в группе Ib (M = 335,38; SD = 47,85; ρ = 0,030; p = 0,851) (рис. 3).
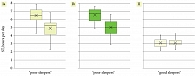
Данные по динамике индекса PSQI на 0-й и 16-й неделях представлены на рис. 4.
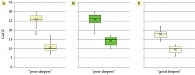
На начальном этапе было установлено, что среднее значение GAGS на 0-й неделе (χ² = 79,29; p < 0,001) в группе Ia составило 26,00 [IQR: 25,00–27,25]; в группе Ib – 26,00 [IQR: 24,00–28,00]; в группе II – 18,00 [IQR: 16,00–19,00]. На 16-й неделе GAGS (χ² = 64,84; p < 0,001) большая скорость регрессии элементов акне была зарегистрирована у пациенток группы Ia на 59,00%, 10,00 [IQR: 9,75–12,00], получавших 3 мг МТ за 30 минут до сна, и группы II на 46,82%, 10,00 [IQR: 8,00–11,00]; у пациенток группы Ib с расстройствами сна, получивших совместно со стандартной терапией акне общие рекомендации по гигиене сна, динамика GAGS составила 45,43%, 15,00 [IQR: 12,00–16,00] (рис. 5).
Результаты опросников HADS и SAS-SV для пациенток групп Ia и Ib – poor sleepers в сравнении с контрольной группой II без нарушений сна – good sleepers – представлены в табл. 4. Субклиническая тревога (HADS-A) наблюдалась у 41,54% (n = 54), клинически выраженная тревога – у 1,54% (n = 2); субклиническая депрессия (HADS-D) – у 9,23% (n = 12), признаки клинической депрессии отсутствовали у всех групп больных. На 16-й неделе исследования признаки субклинической тревожности сохранились у 0,77% (n = 1) пациенток из группы Ib, признаки депрессии отсутствовали во всех группах. Зависимость от смартфона по шкале SAS-SV была зарегистрирована у 4,62% (n = 6) на начальном этапе, и данный показатель присутствовал только у пациенток группы I: в группе Ia – 27,00 [IQR: 22,75–31,00] и в Ib – 25,00 [IQR: 22,00–30,00].
Экранное время было выше в группе пациенток с нарушенным качеством сна: в группе Ia медиана 6,53 [IQR: 6,04–7,13 ч/день]; Ib – 6,69 [IQR: 5,89–7,19 ч/день]; во II группе 3,10 [IQR: 2,70–3,45 ч/день (p < 0,001 по отношению к группам Ia и Ib)]. Была выявлена прямая достоверная корреляционная связь между качеством сна и ST в группе Ia (ρ = 0,740; p < 0,001), и в группе Ib (ρ = 0,789; p < 0,001), во II группе (ρ = 0,642; p < 0,001). На 16-й неделе ST сократилось у пациенток групп Ia и Ib на 24,29 и 23,52% соответственно, в группе II значительных изменений по ST зарегистрировано не было (рис. 6).
Выявлена разница в динамике степени тяжести акне между тремя изучаемыми группами (F = 36,834; p < 0,001). Апостериорные сравнения с использованием критерия Тьюки показали, что пациентки из группы Ia, получившие МТ 3 мг, и из группы II имели больший регресс элементов акне (SE = 0,499; t = -14,605; p < 0,001), чем пациентки группы Ib; между пациентками групп Ia и Ib сравнение составило: SE = 0,618; t = 4,073; p < 0,001, групп Ib и II: SE = 0,697; t=-6,859; p<0,001.
Показатели PSQI уменьшились у пациенток с нарушениями сна на 16-й неделе в группе Ia на 40,24%, 4,00 [IQR: 4,00–11,00] и в группе Ib на 10,48%, 12,00 [IQR: 8,00–13,00].
Обсуждение
Сон является важным процессом, нарушение которого оказывает влияние на качество жизни пациентов с хроническими кожными заболеваниями и является важным диагностическим критерием изменения качества жизни больных [6]. Нарушение сна не только оказывает пагубное воздействие на дневную работоспособность и самочувствие пациентов, но и может выступать в качестве провоспалительного фактора, способствуя обострению и пролонгации воспалительных заболеваний кожи, что подчеркивает важность раннего лечения нарушений сна дерматологических пациентов [28]. В исследовании A. Harlim и соавт. (2020) показано, что поздний отход ко сну приводит к его недостатку, усиливает выработку воспалительных цитокинов и влияет на течение и обострение акне [29]. По данным L. Misery и соавт. (2015), акне увеличивает ежедневный стресс в 2,4 раза, затрудняет сон и вызывает инертность сна [30].
В настоящее время активно изучается влияние метаболических расстройств на течение акне. L.E. Anaba и соавт. сообщают о более высокой распространенности акне у лиц с более высоким ИМТ [31]. Исследование, проведенное R. Gayen и соавт. (2021), выявило, что не существует связи между акне и ожирением, а метаболический синдром не был напрямую связан с тяжестью акне [32]. В работе, проведенной M. Cappel и соавт., было констатировано, что повышенный уровень IGF-1 в сыворотке коррелирует с количеством очагов акне у женщин [33].
В ранее опубликованных работах отмечается, что больные акне часто испытывают психологические проблемы, которые могут существенно повлиять на социальное взаимодействие, межличностные отношения и психическое здоровье [1]. В исследовании, проведенном A.S.M. Morshed и соавт. (2023), было продемонстрировано, что пациенты с акне имеют высокий уровень психологического стресса, который оказывает влияние на качество жизни [34]. A.S. Basfar et al. показали, что повышение уровня стресса коррелирует с ухудшением тяжести акне у значительной части пациентов [35]. В исследовании L. Lukaviciute и соавт. сообщалось, что пациенты с акне имеют более высокий процент по тревоге – 38,4%, чем по депрессии – 23,1% [36]. C. Öztekin и соавт. в 2020 г. определили, что депрессия является важным индикатором заболевания и продемонстрировали высокую распространенность по сравнению с контрольной группой [37]. В работе M. Szepietowska и соавт. (2023) демонстрируется, что у женщин с акне заметна более высокая тревожность, чем у мужчин [5].
В исследовании, проведенном D. Mayerhofer и соавт., показано, что время, проведенное перед экраном (≥ 5 ч/день), было связано с дистрессом, плохим самочувствием или одиночеством [38]. S.Y. Sohn и соавт. определили, что использование смартфонов имеет множество последствий в отношении психологического здоровья: так, ненадлежащее использование смартфонов связано с развитием депрессии, тревоги, нарушениями сна и стрессом [39, 40].
Мы проанализировали влияние сомнологических расстройств на течение дерматоза у 130 пациенток с акне легкой и средней степени тяжести. В нашем исследовании у 65,38% женщин было выявлено нарушение качественных характеристик сна, при этом наличие нарушений сна прямо и достоверно коррелировало со степенью тяжести акне, экранным временем и шкалой зависимости от смартфона.
Избыточная масса тела и ожирение у обследованных пациенток коррелировали со степенью тяжести дерматоза и превалировали в группе с сомнологическими расстройствами. Показатели IGF-1 в сыворотке крови, взятой натощак, были выше в группе больных с нарушенным качеством сна и коррелировали с более высокими баллами по GAGS.
В нашем исследовании больные с акне с нарушением сна имели более высокие баллы HADS: субклиническая тревога была зарегистрирована в группе Ia у 43,18% пациенток и в группе Ib у 51,22%, клиническая тревога наблюдалась у двух пациенток в группе I poor sleepers; признаки субклинической депрессии были определены в группах Ia у 9,09%, Ib – у 9,76%, II – у 8,89% пациенток; клинической депрессии нами зарегистрировано не было.
Пациентки с неудовлетворительными характеристиками качества сна проводили больше часов за экранами мобильных устройств в сутки в среднем на 3,38 ± 0,63 ч/день по сравнению с группой пациенток с удовлетворительными характеристиками качества сна. Зависимость от смартфона превалировала в группе I poor sleepers и достоверно коррелировала с экранным временем. В нашем исследовании мы также зарегистрировали прямую достоверную корреляционную связь между ИМТ пациенток с акне легкой и средней степени тяжести и экранным временем, проведенным за смартфоном.
Данные, полученные в ходе нашей работы, позволили выявить триггерный фактор в виде цифрового источника синего света смартфона, оказывающего влияние на степень тяжести хронического кожного заболевания и участвующего в формировании сомнологических расстройств у пациенток с акне, что диктует необходимость введения оценки качества сна, подсчета экранного времени и определения зависимости от смартфона для регистрации анамнестических данных. В заключение стоит отметить, что пероральный прием MT в дозировке 3 мг в течение 16 недель у больных акне легкой и средней степени тяжести с нарушением сна хорошо переносился пациентками и демонстрировал положительную динамику регресса высыпаний по данным индекса GAGS и улучшения качества сна по данным индекса PSQI по сравнению с группой пациентов, получивших стандартную терапию и общие рекомендации по гигиене сна.
Ограничением данного исследование является то, что выборка пациентов была небольшой, испытуемые были женщины, не был проведен физиологический метод измерения качества сна, например полисомнография.
Заключение
Своевременное выявление факторов, приводящих к сомнологическим расстройствам, в частности использования цифровых устройств, излучающих синий спектр длины волн, и раннее начало коррекции нарушений сна у дерматологических пациентов с акне являются важной задачей, способной повлиять на успешный исход терапии и улучшить качество жизни больных с акне.
Авторы заявляют об отсутствии конфликта интересов.
Yu.N. Perlamutrov, PhD, Prof., K.B. Olkhovskaya, PhD, E.N. Yakovleva
Russian University of Medicine
Contact person: Evgenia N. Yakovleva, en_yakovleva@list.ru
Sleep disorders affect various aspects of the quality of life of dermatological patients. The impact of sleep disorders on patients suffering from acne is currently not well understood. Sleep disorders in patients with acne can lead to a more severe course of dermatosis and a slow response to therapy.
Objectives. To evaluate the role of correction of sleep disorders in complex therapy of acne in women.
Material and methods. The prospective single-center observational study (from 2023 to 2024) was conducted on 130 women with mild to moderate acne; the observation period was 16 weeks. The severity of dermatosis was determined using the GAGS index; sleep quality was assessed using the PSQI; psychological testing was carried out using questionnaires – HADS and SAS-SV; screen time was counted using the built-in iOS applications ’Screen Time’ and Android ’Digital Wellbeing’; the presence of metabolic disorders included the calculation of BMI (kg/m2) and IGF-1 (ng/ml).
Results. The study identified factors that directly and reliably correlated with the severity of acne (GAGS) with PSQI, screen time, smartphone addiction, and BMI. A weak correlation was observed with the level of anxiety and depression. The severity of acne, measured by the GAGS score, at week 16 decreased in all study groups compared to baseline. The greatest regression in breakouts was recorded in group Ia ’poor sleepers’ who were receiving 3 mg of melatonin by 59,00% and in group II ’good sleepers’ by 46,82%, respectively; in group Ib ’poor sleepers’ the GAGS score decreased by 45,43%.
Conclusions. The results of our work indicate the need for timely testing for sleep disorders and factors affecting sleep quality in patients with mild to moderate acne. Early correction of sleep disorders will help influence the successful outcome of therapy and improve the quality of life of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.