Фундаментальные основы формирования абдоминальной боли у пациентов с синдромом раздраженного кишечника
- Аннотация
- Статья
- Ссылки
- English
из-за отсутствия полного представления о патогенезе заболевания. При этом очевидно, что СРК достаточно гетерогенное заболевание и его клинические проявления весьма вариабельны. Особую сложность в клинической практике представляет купирование абдоминальной боли – основного клинического симптома СРК, отличающего его от других функциональных расстройств кишечника.
В статье представлены основные механизмы формирования абдоминальной боли при СРК, включая висцеральную гиперчувствительность, изменения кишечной микробиоты, повышенную кишечную проницаемость и воспаление «низкой степени активности».
из-за отсутствия полного представления о патогенезе заболевания. При этом очевидно, что СРК достаточно гетерогенное заболевание и его клинические проявления весьма вариабельны. Особую сложность в клинической практике представляет купирование абдоминальной боли – основного клинического симптома СРК, отличающего его от других функциональных расстройств кишечника.
В статье представлены основные механизмы формирования абдоминальной боли при СРК, включая висцеральную гиперчувствительность, изменения кишечной микробиоты, повышенную кишечную проницаемость и воспаление «низкой степени активности».

Cиндром раздраженного кишечника (СРК) является наиболее распространенной патологией желудочно-кишечного тракта среди лиц молодого возраста. СРК не повышает риск инвалидизации и смерти в популяции, но приводит к значительному снижению качества жизни пациентов и ограничению трудоспособности. Упорное, длительное течение заболевания часто сопряжено с повторными визитами к врачам, необоснованным дообследованием, а значит, еще большим снижением качества жизни и существенными экономическими затратами.
Перечень лекарственных препаратов, которые могут быть назначены больным СРК, достаточно широк. Тем не менее, согласно международным и национальным рекомендациям, управлять течением заболевания (табл. 1) сложно.
Эффективность предложенных в настоящее время схем терапии СРК, направленных исключительно на купирование отдельных симптомов, не превышает 25–40%. Это требует выделения различных фенотипов больных СРК и разработки индивидуализированных, персонифицированных схем терапии.
Особую сложность в клинической практике представляет контроль над ключевым симптомом, отличающим СРК от других функциональных расстройств кишечника, – абдоминальной болью. Это обусловлено прежде всего отсутствием четких представлений о патогенезе абдоминальной боли при СРК. Соответствующие исследования малочисленны, носят в основном экспериментальный характер, и их результаты весьма противоречивы.
Нейроанатомия абдоминальной боли при СРК
С клинической точки зрения абдоминальная боль при СРК относится к висцеральной, то есть возникающей при раздражении болевых рецепторов кишечника (ноцицепторов), расположенных в мышечной стенке [1].
Восприятие висцеральной боли и ее психологическая обработка отличаются от таковых при соматической боли. Висцеральная боль не связана с повреждением внутренних органов, носит диффузный характер и обычно ощущается в местах, расположенных на удалении от самого органа, а также сопряжена с различными моторными нарушениями и вегетативными реакциями [1, 2]. Паттерн болевого ощущения при данном типе боли может быть сходным для разных органов. То есть расстройства кишечника, мочевого пузыря и других внутренних органов воспринимаются как общая боль в животе, тазовая боль или боль в спине. Нередко конкретную локализацию определить не удается [1–3].
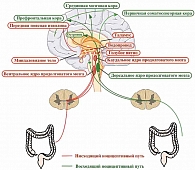
Сенсорная информация в центральную нервную систему (ЦНС) от пищевода до поперечной ободочной кишки передается через афферентные пути в составе блуждающего нерва (nervus vagus), от оставшейся части толстой кишки – через тазовые нервы чревного сплетения (plexus coeliacus). Небольшая группа афферентов в составе внутренностных нервов (nn. splanchnic), клеточные тела которых возникают из грудного отдела симпатического ствола, иннервируют весь пищеварительный тракт [3].
Обработка сигналов, поступающих из кишечника, в основном происходит в ядре солитарного тракта продолговатого мозга и ганглиях дорсальных корешков T2–L2 и S1–5 [4]. Афференты висцерального отдела проникают в спинной мозг и образуют синапсы с нейронами дорсальных рогов, противоположных участку входа, затем восходят к таламусу и среднему мозгу, формируя спиноталамический, спиноретикулярный и спинномозговой тракты [4, 5]. В результате возникает обширная диффузная активация ЦНС. Показано, что области мозга, иннервируемые этими путями, такие как миндалевидное тело, префронтальная кора и таламус, объединенные в так называемую мозговую модель «матрицы боли», активируются в ответ на колоректальную стимуляцию у больных СРК [5]. Возбуждение миндалевидного тела в ответ на болевой стимул ассоциировано с формированием эмоций, а префронтальной коры – с модификацией поведенческих реакций. При этом ключевая роль в функционировании «матрицы боли» отводится лимбической системе, а именно центральному ядру миндалевидного тела, в которое в большинстве своем поступают болевые сигналы от кишечника [3–5].
Кроме того, компоненты лимбической системы имеют прямые синаптические взаимодействия с норадренергическими нейронами голубого пятна ствола мозга – частью ретикулярной формации, отвечающей за физиологическую реакцию на тревогу, что подчеркивает роль стресса в развитии абдоминальной боли при СРК [1, 4]. Миндалевидное тело также получает сенсорную информацию от кишечника через афферентные волокна спинного мозга в составе спино-(тригемино-)парабрахио-миндалевидного пути, участвующего в антиноцицепции и нисходящем механизме подавления боли [1, 3, 4]. Возникновение абдоминальной боли при СРК связывают не только с усилением восприятия боли в головном мозге за счет избыточной восходящей афферентной импульсации, но также с нарушением работы антиноцицептивной системы и недостаточным нисходящим ингибированием висцеральных болевых сигналов [6].
В последнее десятилетие в контексте ноцицепции внимание исследователей было также направлено на изучение микроглии – совокупности специализированных глиальных клеток мезенхимального происхождения, резидентных макрофагов, которые представляют собой первую линию защиты ЦНС, выступая в качестве датчиков патологических событий [7]. На экспериментальных моделях СРК показано, что психологический стресс приводит к активации микроглии в поясничном отделе спинного мозга, что сопровождается развитием висцеральной гиперчувствительности кишечника – основного патогенетического феномена, лежащего в основе развития абдоминальной боли при СРК [1, 7].
Особую роль в регуляции основных функций кишечника играет энтеральная нервная система (ЭНС). Основным каналом связи ЭНС с головным мозгом является блуждающий нерв. При этом около 90% сигналов по блуждающему нерву поступают не сверху (от головного мозга), а снизу (от ЭНС) [8]. Все звенья рефлекторных путей ЭНС начинаются и заканчиваются на уровне кишечника, что лежит в основе формирования своеобразных «механизмов памяти», способствующих хронизации симптомов при СРК [9].
Многокомпонентная интеграция ноцицептивной информации (рис. 1) объясняет изменчивость восприятия и обработки абдоминальной боли при СРК, а следовательно, трудности в подборе эффективной фармакологической терапии.
Биохимические посредники абдоминальной боли при СРК
Висцеральные ноцицептивные сигналы, идущие от периферии к ЦНС, опосредуются действием нейротрансмиттеров, нейропептидов и цитокинов. Ряд медиаторов и их рецепторов, включая нейротрансмиттерные рецепторы (ацетилхолиновые, каннабиноидные, опиоидные, GABA, глутаматные ионотропные и метаботропные, глюкокортикоидные), воспалительные рецепторы (брадикининовые, холецистокининовые, цитокиновые, лейкотриеновые, простаноидные, тахикининовые, липоксигеназные) и рецепторы ионных каналов (ваниллоидные TRPV, пуринергические P2X, кальциевые CaV, калиевые KV, натриевые NaV), участвуют в обработке висцеральной абдоминальной боли [1]. Из-за огромного количества посредников и путей формирования абдоминальной боли при СРК ее четкая патофизиология до сих пор не установлена.
Наиболее изученным трансмиттером, участвующим в передаче ноцицептивных сигналов при СРК, является серотонин (5НТ). Известно, что 95% всего 5НТ в организме локализовано на уровне ЭНС [8]. При изменении внутрипросветного давления энтерохромаффинные клетки кишечника и серотонинергические нейроны межмышечного сплетения ЭНС выделяют 5НТ, под действием которого активируются специфические 5НТ-рецепторы на первичных афферентных нейронах и формируется восходящий сенсорный импульс. В качестве стимулов, инициирующих высвобождение 5НТ в кишечнике, могут выступать различные компоненты пищи и бактериальные метаболиты. После обработки поступивших сигналов в соматосенсорной коре возникают различные ощущения, в том числе болевые. В ответ на это может появляться эфферентный нервный импульс, идущий к гладкой мускулатуре кишечника и изменяющий моторику органа [10].
Впервые cвязь между 5НТ, симптомами СРК и психологическими особенностями личности была описана через парадигму истощения триптофана J. Shufflebotham и соавт. в 2006 г. [11]. Сегодня становится очевидным, что данная связь имеет более сложные механизмы развития.
Для поддержания динамического равновесия инактивация 5НТ так же важна, как и его высвобождение. Определенную роль в метаболизме 5НТ играет натрий-зависимый транспортер (SERT), физиологическая функция которого сводится к захвату и транспорту 5НТ из синаптической щели обратно в выделивший его пресинаптический нейрон [4]. В силу существенных различий в используемой методологии, неоднородности выборок пациентов результаты исследований, содержания SERT у больных с СРК достаточно противоречивы [12, 13]. Тем не менее в большинстве работ продемонстрировано, что у пациентов с СРК значительно ниже уровень экспрессии SERT в слизистой оболочке кишечника и способность энтероцитов поглощать 5НТ [12, 14]. Кроме того, показана статистически значимая обратная корреляционная связь между уровнем 5НТ и экспрессией SERT.
Экспрессия SERT регулируется транскрипционными и посттрансляционными механизмами. В настоящее время активно изучается ассоциация между полиморфизмом гена SERT и риском развития СРК. Имеющиеся данные достаточно разнородны и зависят от региона и принадлежности к конкретной этнической группе [15]. Вместе с тем экспрессия SERT, а следовательно, концентрация 5НТ могут изменяться под действием кишечной микробиоты. Эта гипотеза была проверена экспериментально методом трансплантации фекальной микробиоты от лиц с функциональной патологией кишечника мышам, чья микробиота была ослаблена антибиотикотерапией [16]. Мыши, получившие трансплантат, быстро демонстрировали изменение экспрессии SERT в толстой кишке, концентрации серотонина и аномальные параметры дефекации.
Дисбаланс серотонина в организме тесно связан с психическими расстройствами, которые широко распространены среди пациентов с СРК [17]. Неудивительно, что антидепрессанты, в частности селективные ингибиторы обратного захвата серотонина (СИОЗС), давно и прочно вошли в стандарты терапии больных СРК. Между тем данные об их эффективности весьма противоречивы. Так, систематический обзор и метаанализ, выполненный A.C. Ford и соавт. в 2014 г., показали высокую эффективность антидепрессантов у пациентов с СРК [18]. Однако метаанализ C. Xie и соавт., опубликованный спустя год в журнале PLoS One, напротив, продемонстрировал отсутствие положительного клинического результата от применения СИОЗС в когорте больных СРК [19].
В качестве еще одного медиатора абдоминальной боли рассматривается глутамат, обнаруженный в спинномозговых афферентных нервных волокнах [1, 20]. По своей химической структуре глутамат является аминокислотой, которая синтезируется 40% нейронов головного и спинного мозга. Глутамат относится к возбуждающим медиаторам, то есть всегда вызывает возбуждение в синапсах и запускает передачу нервного импульса в отличие от серотонина, ацетилхолина, норадреналина, оказывающих разнонаправленное действие в зависимости от ситуации [20]. Хотя прямые доказательства связи между глутаматом и висцеральной ноцицепцией отсутствуют, имеется информация о том, что антагонисты ионотропных глутаматных N-метил-D-аспартат-рецепторов (NMDA-рецепторы) снижают чувствительность толстой кишки к действию механических раздражителей [21]. На модели СРК показано, что активация NMDA-рецепторов в толстой кишке уменьшает висцеральную гипералгезию, а также вызывает высвобождение пептида, связанного с геном кальцитонина, и субстанции P, которые играют важную роль в лечении хронической и выраженной боли [20, 21].
Метаботропные глутаматные рецепторы (mGlu), за исключением рецептора mGlu6, экспрессируются во всех областях «матрикса боли». Действие рецепторов mGlu может быть ноцицептивным или антиноцицептивным в зависимости от подтипа и места действия [1, 22]. В эксперименте антагонист рецептора mGlu5 снижал повышение частоты сердечных сокращений и артериального давления, вызванное колоректальным расширением [23]. Кроме того, установлено, что стимуляция толстой кишки увеличивает количество Fos-позитивных нейронов в дорсальных рогах грудного и поясничного отделов спинного мозга, вовлеченных в процессы формирования долговременной памяти [24].
Из-за негативных побочных эффектов, в первую очередь психомиметической активности, наблюдаемых при модуляции ионотропных глутаматных рецепторов, соединения, которые нацелены на агонизм с ними, не подходят для длительного лечения боли. Для контроля трансмиссии глутамата с целью антиноцицепции более перспективной представляется разработка ингибиторов его обратного захвата. R.D. Gosselin и соавт. показали, что селективное ингибирование транспортеров глутамата с помощью dl-Трео-бета-бензилоксиаспартата и дигидрокаината вызывает дозозависимое снижение обусловленной стрессом висцеральной гиперчувствительности у наивных крыс [25].
Патофизиология СРК указывает на то, что стресс – один из наиболее значимых факторов риска его развития. С повышенным риском СРК чаще всего связан стресс, перенесенный в раннем детском возрасте: физическая травма, потеря родителя, жестокое обращение. Предшествовать дебюту СРК могут и такие острые стрессорные события, как сексуальное насилие, угрожающая жизни травма, военные действия. Хронический стресс может изменять индивидуальные реакции организма и играть важную роль в обострении симптомов при СРК [26]. При этом реакции людей на стресс весьма вариабельны, а стрессоустойчивость как феномен представляет огромный интерес для всех областей клинической психологии и психиатрии.
Основной осью стресса у млекопитающих является ось «гипоталамус – гипофиз – надпочечники» (ГГН), анатомические структуры которой расположены как в ЦНС, так и на периферии. Основные компоненты системы ГГН локализуются в паравентрикулярном ядре гипоталамуса, передней доле гипофиза и надпочечниках. В ответ на стресс кортикотропин-рилизинг-гормон (КРГ) высвобождается и перемещается в переднюю долю гипофиза, где связывается со своими рецепторами (CRHR1 и CRHR2), приводя к высвобождению адренокортикотропного гормона (АКТГ) в системную циркуляцию. АКТГ стимулирует выработку корой надпочечников кортизола – основной эффекторной молекулы реакции на стресс, который регулирует физиологическую адаптацию организма. Экспериментально показано, что хронический стресс может вызывать дезадаптивные изменения в виде снижения экспрессии CRHR 1 в передней доле гипофиза [27]. Считается, что нарушение регуляции оси ГГН посредством ее неадекватной или чрезмерной активации способствует развитию широкого спектра не только функциональных, но и соматических заболеваний [28].
СРК чаще встречается у женщин (соотношение женщин и мужчин ~ 2:1). Не случайно на протяжении многих лет активно изучается вклад половых гормонов в развитие заболевания. Действительно, во многих клинических исследованиях сообщается о половых различиях в реакции на стресс и вызванной стрессом модуляции боли [29–31]. Однако подобная закономерность не подтверждена экспериментально, что отчасти связано с использованием самцов грызунов в большинстве доклинических испытаний, посвященных оценке роли стресса в развитии висцеральной гиперчувствительности [32]. Кроме того, изучение гендерных различий при СРК сопряжено со значительными трудностями. Из-за подавляющего числа женщин, у которых диагностировано данное функциональное расстройство и которые в большей степени подвержены стрессу, часто числа мужчин в группе сравнения недостаточно для выявления статистически значимых различий.
Тем не менее генез гендерных различий в восприятии висцеральной боли, вероятно, является многофакторным и предполагает не только психологическое, но и биологическое (гормональное) воздействие. Установлено, что циклическое изменение секреции половых гормонов, прежде всего эстрогена и прогестерона, в течение менструального цикла, а также снижение функции яичников во время и после наступления менопаузы в значительной степени ассоциированы с нарушениями моторной функции кишечника и висцеральной гиперчувствительностью [31]. Это продемонстрировано в ряде исследований, подтверждающих влияние менструального цикла на возникновение гастроинтестинальных симптомов, в том числе абдоминальной боли при СРК [31, 33]. Более того, у многих женщин с СРК наблюдается усиление не только абдоминальной боли, но и нарушений стула во время поздней лютеиновой фазы и фазы менструаций по сравнению с другими фазами цикла [31]. Определенную сложность при проведении подобных клинических исследований и интерпретации их результатов представляет применение женщинами различных фармакологических агентов (комбинированные оральные контрацептивы, заместительная гормональная терапия), влияющих на менструальный цикл и связанные с ним функции.
Как известно, базальные и стрессовые уровни АКТГ и кортизола у женщин выше, чем у мужчин [31, 33]. При этом имеющиеся данные свидетельствуют о том, что женские половые гормоны, в частности эстрогены, служат важными регуляторами деятельности оси ГГН и при активации рецепторов эстрогена увеличивается экспрессия КРГ [33]. Кроме того, у женщин более высокие уровни КРГ, АКТГ и кортизола во время проэструса – фазы овариального цикла, характеризующейся самым высоким уровнем эстрадиола [1, 31, 32]. Колебания концентрации эстрадиола во время менструального цикла также могут приводить к нарушениям взаимодействия между серотонинергической и глутаматергической нейротрансмиттерными системами, что влияет на возникновение и выраженность абдоминальной боли при СРК [31].
На сегодняшний день связь между уровнем половых гормонов и висцеральной гиперчувствительностью кишечника не вызывает сомнений, однако противоречивые результаты доклинических и клинических испытаний подчеркивают сложность интерпретации данной ассоциации, которая требует дальнейшего изучения.
Висцеральная гиперчувствительность
В патогенезе абдоминальной боли при СРК центральное место отводится висцеральной гиперчувствительности. С современных позиций висцеральная гиперчувствительность признана своеобразным биологическим маркером СРК и рассматривается как основной субстрат для развития абдоминальной боли при данном заболевании [9, 26].
Феномен висцеральной гиперчувствительности впервые был обнаружен и описан W.E. Whitehead в 1980 г. у больных СРК при использовании баллонно-дилатационного теста, который до сих пор, несмотря на все ограничения в использовании, считается эталонным методом объективизации боли и определения уровня болевого порога при СРК [6]. Установлено, что у больных с СРК висцеральная гиперчувствительность может проявляться в виде снижения порога болевой чувствительности (висцеральной гипералгезии) или повышения чувствительности при нормальном пороге восприятия (аллодинии) [9].
Микробиота, повышенная кишечная проницаемость и воспаление «низкой степени активности»
Состав кишечной микробиоты у пациентов с СРК значимо отличается от такового у здоровых лиц, а добавление пробиотиков к схемам лечения СРК уменьшает выраженность клинических проявлений [34].
В доклинических исследованиях заселение кишечника так называемыми полезными бактериями рода Bifidobacterium или Lactobacillus способствует обратному развитию висцеральной гиперчувствительности.
Показано, что смесь из восьми пробиотических штаммов (VSL № 3) оказывает протективное действие в отношении развития висцеральной гиперчувствительности у экспериментальных особей в модели отделения новорожденных от матери. Кроме того, при введении VSL № 3 уменьшается экспрессия гена TPH1, кодирующего синтез фермента триптофан-гидроксилазы, который участвует в продукции серотонина – ключевого нейротрансмиттера при СРК [35]. К тому же в эксперименте смесь VSL № 3 снижала висцеральную гиперчувствительность, вызванную инстилляцией 4%-ной уксусной кислоты в толстую кишку [36].
Отдельные штаммы Lactobacillus и Bifidobacterium, в частности B. infantis 35624, эффективны в уменьшении индуцированной стрессом висцеральной гипералгезии. Бактерии рода Bifidobacterium способны ингибировать активность сериновых протеаз, которые в большом количестве обнаруживаются в биоптатах слизистой оболочки толстой кишки у больных СРК [34]. Как известно, сериновые протеазы раздражают нейроны ЭНС, способствуя формированию афферентных ноцицептивных импульсов.
Выявление феномена антибиотик-ассоциированной висцеральной гиперчувствительности также подтверждает роль кишечной микробиоты в патофизиологии абдоминальной боли. Возможно, именно с этим связан положительный клинический эффект полусинтетического, неабсорбируемого антибиотика рифаксимина у больных СРК [37].
Нарушение состава кишечной микробиоты способствует повышению межклеточной проницаемости слизистой оболочки кишечника, которая уже давно является объектом пристального внимания как исследователей, так и клиницистов [6]. Еще в 1907 г. И.И. Мечников предположил, что разрушение и старение тканей – следствие «кишечной аутоинтоксикации», возникающей в результате проникновения через эпителий кишечника в системный кровоток токсичных продуктов жизнедеятельности бактерий [38].
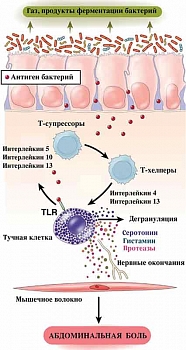
В настоящее время установлено, что эпителий кишечника представляет собой своеобразную динамическую систему, необходимую для поддержания гомеостаза организма. Целостность эпителиального кишечного барьера обеспечивается взаимодействием белков плотных контактов (tight junctions, TJ) [39]. Расширение межэпителиальных пространств вследствие дисфункции TJ приводит к проникновению бактериальных антигенов и продуктов микробного метаболизма через слизистую оболочку кишечника с последующей активацией иммунных клеток, запуском воспалительного каскада, раздражением афферентных нервных окончаний подслизистого нервного сплетения и возникновением абдоминальной боли (рис. 2).
В ряде исследований показана связь между выраженностью абдоминальной боли и степенью повышения проницаемости кишечника [39, 40]. Определенную сложность в реальной клинической практике представляет отсутствие диагностически значимых биологических маркеров кишечной проницаемости. Тройной сахарный тест, основанный на изучении соотношения содержания лактулозы, маннитола и сукралозы в моче, низкоспецифичен и крайне трудоемок [40]. Различные методы оценки уровня экспрессии TJ непосредственно в слизистой оболочке кишечника требуют проведения инвазивных диагностических процедур. Поэтому сегодня ведется активный поиск серологических биомаркеров измененной кишечной проницаемости с целью последующей разработки индивидуализированных подходов к терапии различных заболеваний пищеварительного тракта, в том числе СРК.
В качестве потенциальных маркеров повышенной межэпителиальной кишечной проницаемости при СРК рассматривается зонулин – человеческий аналог zonula occluden токсина vibrio cholerae, который является эндогенным модулятором запирающих межклеточных контактов, и цитозольного белка, связывающего кишечные жирные кислоты (I-FABP) [41, 42].
В недавно опубликованном исследовании P. Singh и соавт. продемонстрировано, что для больных СРК независимо от типа нарушения кишечной моторики характерно повышение уровня зонулина и снижение I-FABP в сыворотке крови [42]. Несмотря на то что в данной работе не установлена корреляция между данными серологическими маркерами и степенью выраженности абдоминальной боли, выявлена прямая связь между уровнем зонулина и частотой стула у больных СРК с преобладанием диареи, сопоставимая с таковой при активной целиакии.
Установлено, что психоэмоциональный стресс – один из многих факторов агрессии, приводящих к повышению проницаемости слизистой оболочки пищеварительного тракта [6, 43]. При изучении кишечной проницаемости с использованием тройного сахарного теста у здоровых добровольцев T. Vanuytsel и соавт. показали, что публичное выступление в незнакомой аудитории сопровождается повышением кишечной проницаемости в той же степени, как и прием нестероидного противовоспалительного препарата индометацина [43]. Кроме того, в группе лиц после публичного выступления наблюдалось повышение уровней кортизола в слюне и КРГ в сыворотке крови, которые коррелировали со степенью кишечной проницаемости. Интересно, что проницаемость эпителиального кишечного барьера нормализовалась под действием стабилизаторов мембран тучных клеток, а прием кромоглициевой кислоты перед публичным выступлением предупреждал изменение кишечной проницаемости. Авторы пришли к выводу, что связь между кишечной проницаемостью и психологическим стрессом объясняется активацией тучных клеток, опосредованной действием оси ГГН.
Безусловно, иммунная система играет важную роль в поддержании гомеостаза в кишечнике, поэтому роль воспаления в патофизиологии СРК изучается уже на протяжении многих лет. V.S. Chadwick и соавт. при иммуногистологическом исследовании обнаружили увеличение числа активированных иммунокомпетентных клеток, в том числе Т-лимфоцитов, нейтрофилов и тучных клеток в колонобиоптатах пациентов с СРК [44]. Последующие исследования продемонстрировали, что наиболее специфичным маркером воспаления при СРК является увеличение количества тучных клеток в слизистой оболочке кишечника [1, 45]. Тучные клетки при дегрануляции высвобождают ряд воспалительных медиаторов, в результате чего в слизистую оболочку кишечника привлекаются другие воспалительные клетки, участвующие в формировании висцеральной гиперчувствительности желудочно-кишечного тракта. Показано, что увеличение числа тучных клеток в колонобиоптатах у пациентов с СРК коррелирует с выраженностью абдоминальной боли и вздутием живота [44].
Другим открытием стало наличие активированных Т-лимфоцитов в биоптатах слизистой оболочки толстой кишки, полученных от пациентов с СРК [1, 44]. Результаты ряда исследований показали распространение воспалительного инфильтрата, состоящего из мононуклеарных клеток, вплоть до межмышечного нервного сплетения у пациентов с СРК по сравнению со здоровыми лицами [45]. Кроме того, пациенты с СРК имеют больше активированных Т-клеток не только непосредственно в кишке, но и в образцах крови [44].
Видимо, именно воспаление «низкой степени активности» лежит в основе развития СРК-подобных симптомов, прежде всего абдоминальной боли, у пациентов с воспалительными заболеваниями кишечника в фазе клинико-эндоскопической ремиссии [46].
Роль воспаления в патогенезе СРК подтверждает тот факт, что нередко дебют СРК наблюдается после перенесенного бактериального гастроэнтерита, так называемый постинфекционный СРК (ПИ-СРК) [47]. Появление симптомов, характерных для СРК, у больного после перенесенной тяжелой кишечной инфекции впервые было описано G.T. Stewart в 1950 г. [48]. Известно, что большинство пациентов с инфекционным гастроэнтеритом выздоравливают в течение 3–5 дней, но приблизительно у 10% пациентов гастроинтестинальные симптомы (чаще абдоминальная боль и диарея) сохраняются в дальнейшем.
В метаанализе M. Thabane и соавт. показан повышенный в шесть-семь раз риск развития СРК у пациентов с указанием в анамнезе на наличие эпизода острого гастроэнтерита [47].
Воспаление «низкой степени активности» признано основным патофизиологическим механизмом формирования ПИ-СРК. M. El-Salhy и соавт. сообщили, что у пациентов с ПИ-СРК после перенесенного Campylobacter-ассоциированного гастроэнтерита увеличивается количество лейкоцитов, лимфоцитов и тучных клеток в биоптатах слизистой оболочки прямой кишки. При этом степень воспалительной инфильтрации коррелирует с выраженностью абдоминальной боли [49]. ПИ-СРК может развиваться не только в исходе гастроэнтерита бактериальной природы, но и после перенесенной вирусной инфекции [50].
Имеются доказательства прямой связи между воспалительными и иммунными клетками и нейроэндокринной системой кишечника, контролирующей сенсорно-моторную функцию желудочно-кишечного тракта. Так, S.P. Dunlop и соавт. обнаружили корреляцию между выраженностью абдоминальной боли, тревоги, депрессии и степенью гиперплазии энтерохромаффинных клеток, воспалительной инфильтрации, а также повышенной проницаемостью слизистой оболочки кишечника у пациентов с ПИ-СРК [51]. Секреторные продукты иммунных клеток снижают продукцию серотонина энтерохромаффинными клетками, в результате чего происходит их компенсаторная гиперплазия. В свою очередь изменение содержания серотонина во внеклеточном пространстве сопровождается развитием абдоминальной боли, нарушений моторики кишечника и изменений психического статуса по типу тревоги и депрессии.
Немаловажная роль в функционировании иммунной системы кишечника отводится Toll-подобным рецепторам (TLR), распознающим структуры микроорганизмов и активирующих клеточный иммунный ответ. Передача сигналов от TLR осуществляется двумя путями: MyD88-зависимым путем, ведущим к провоспалительному ответу, и MyD88-независимым путем, ассоциированным с гиперпродукцией интерферона бета и созреванием дендритных клеток. MyD88-зависимый путь является общим для всех TLR, кроме TLR3 [52].
Имеются сообщения об участии TLR4 в формировании абдоминальной боли у пациентов с СРК. Экспрессия TLR4 обнаружена в ЭНС, микроглии и ганглиях дорсальных корешков спинного мозга, что указывает на роль TLR4 в передаче сенсорной информации из желудочно-кишечного тракта. В исследованиях in vivo и in vitro показано, что одновременно с TLR4 активируются опиоидные (мю, каппа, дельта) рецепторы ЭНС [53]. Это позволяет рассматривать TLR в качестве потенциальной терапевтической мишени для купирования абдоминальной боли при СРК.
Генетические факторы
Генетическая предрасположенность наряду с факторами окружающей среды лежит в основе развития абдоминальной боли у пациентов с СРК. В крупномасштабном эпидемиологическом исследовании среди моно- и дизиготных близнецов показано, что вклад генетики в развитие СРК составляет 33% [54].
В качестве потенциальных генов-кандидатов, связанных с формированием абдоминальной боли при СРК, рассматриваются гены, ответственные за синтез транспортера 5НТ (SLC6A4), нейротрансмиттерных рецепторов, TLR и цитокинов (табл. 2).
Наиболее изученным считается ген SLC6A4, локализующийся в хромосоме 17q11.2. SLC6A4 содержит 14 экзонов и в итоге кодирует белок, состоящий из 603 аминокислот. Существует ряд полиморфных областей, способных влиять на экспрессию или функцию SERT и изменять обратный захват 5HT [15].
Показано, что генотип SLC6A4 с низкой экспрессией транспортера 5НТ может лежать в основе генетической предрасположенности к СРК, а полиморфизм 5-HTTLPR гена ассоциирован с выраженностью абдоминальной боли. Транскрипционная активность генотипа L/L полиморфизма 5-HTTLPR выше по сравнению с генотипами L/S и S/S. Генотип L/L характеризуется повышенной экспрессией SERT в кишке и чаще выявляется у пациентов с СРК, предъявляющих жалобы на наличие выраженной абдоминальной боли. Аллель S, приводящая к снижению транскрипции SLC6A4 и экспрессии SERT, способствует уменьшению обратного захвата 5HT и более высокому содержанию 5HT во внеклеточном пространстве, что коррелирует с низкой интенсивностью абдоминальной боли при СРК [55]. A. Sikander и соавт. и C. Pata и соавт. независимо друг от друга установили, что генотип S/S чаще встречается у пациентов с СРК с запорами в индийской и турецкой популяции соответственно [56, 57]. В то же время I. Wendelbo и соавт. пришли к выводу, что повышенное содержание SERT в эпителии подвздошной кишки характеризуется низкой интенсивностью абдоминальной боли при СРК независимо от типа нарушения кишечного транзита [13].
Метаанализ 25 клинических исследований с участием свыше тысячи больных СРК выявил этнические различия в отношениях между полиморфизмом 5-HTTLPR и развитием симптомов СРК. Так, генотип L/L, или скорее аллель L, были более релевантными в восточноазиатской популяции [58].
Другой метаанализ показал, что полиморфизм SLC6A4 связан с низким риском развития СРК в американской и азиатской популяциях [15].
Заключение
Патофизиология абдоминальной боли при СРК является многофакторной и с современных позиций рассматривается в контексте роли висцеральной гиперчувствительности, изменений состава кишечной микробиоты, повышенной кишечной проницаемости и воспаления «низкой степени активности».
Кишечная микробиота тесно связана с основным патофизиологическим феноменом формирования абдоминальной боли при СРК – висцеральной гиперчувствительностью посредством экспрессии ферментов, участвующих в синтезе нейромедиаторов, и продуктов бактериальной ферментации. К тому же дисбиоз способствует повышению кишечной проницаемости, проникновению бактериальных антигенов, развитию воспаления «низкой степени активности», сенсибилизации афферентных волокон ЭНС и возникновению абдоминальной боли.
Авторы заявляют об отсутствии конфликта интересов.
Информация о финансовой поддержке: грант Президента РФ для государственной поддержки молодых российских ученых (МК-1679.2020.7) (соглашение № 075-15-2020-138 от 17 марта 2020 г.) «Разработка превентивной индивидуализированной стратегии ведения больных с синдромом раздраженного кишечника».
O.V. Gaus, PhD, M.A. Livzan, MD, PhD, Prof.
Omsk State Medical University
Contact person: Olga V. Gaus, gaus_olga@bk.ru
Irritable bowel syndrome (IBS) is widespread in the population. IBS leads to a significant decrease in the quality of life like bronchial asthma, coronary heart disease, and diabetes. In some patients, severe clinical symptoms are accompanied by a limited ability to work. Currently treatment strategies for patients with IBS remain unsatisfactory. The development of new therapeutic agents is complicated by the lack of detailed knowledge basic mechanisms of development IBS. IBS is a rather heterogeneous disease and its clinical manifestations are highly variable. Of particular difficulty in clinical practice is the treatment of abdominal pain. Abdominal pain is the main symptom of IBS distinguishing it from other functional bowel disorders.
This article presents the main mechanisms for formation of abdominal pain in IBS, including visceral hypersensitivity, changes in intestinal microbiota, increased intestinal permeability and inflammation of ῾low degree of activity’.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.