Оценка эффективности комбинированной терапии препаратом глюкозамина сульфата кристаллического (ДОНА) у пациентов с остеоартритом коленного сустава
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включено 200 пациентов с ОА коленного сустава первой – третьей степени согласно классификации Kellgren – Lawrence.
Общая продолжительность исследования составила 146 дней (90 дней – период лечения, 56 дней – динамическое наблюдение). Все пациенты получали комбинированную терапию препаратом ДОНА.
Результаты. Через 90 дней от начала терапии отмечалось статистически значимое увеличение индекса здоровья – с 0,26 ± 0,03 до 0,52 ± 0,03 (p ≤ 0,01). Изменение индекса здоровья на фоне проводившейся терапии соответствовало удовлетворительному терапевтическому эффекту (Δ EQ-5D – 0,26). Аналогичное соотношение сохранилось и через восемь недель после завершения терапии.
Кроме того, через 90 дней наблюдалось статистически достоверное улучшение суммарного индекса Лекена (с 12,4 ± 0,4 до 8,8 ± 0,3 балла, p ≤ 0,001) и снижение боли (с 5,6 ± 0,2 до 4,2 ± 0,2 балла, p ≤ 0,01). По остальным показателям (средняя дистанция ходьбы, функциональные нарушения) статистически значимых различий не получено (3,2 ± 0,1 vs 2,4 ± 0,2, p = 0,05 и 3,6 ± 0,3 vs 2,2 ± 0,1, p = 0,05). Через восемь недель после окончания лечения показатели оставались стабильными.
На фоне проводившейся терапии нежелательных реакций зафиксировано не было.
Материал и методы. В исследование включено 200 пациентов с ОА коленного сустава первой – третьей степени согласно классификации Kellgren – Lawrence.
Общая продолжительность исследования составила 146 дней (90 дней – период лечения, 56 дней – динамическое наблюдение). Все пациенты получали комбинированную терапию препаратом ДОНА.
Результаты. Через 90 дней от начала терапии отмечалось статистически значимое увеличение индекса здоровья – с 0,26 ± 0,03 до 0,52 ± 0,03 (p ≤ 0,01). Изменение индекса здоровья на фоне проводившейся терапии соответствовало удовлетворительному терапевтическому эффекту (Δ EQ-5D – 0,26). Аналогичное соотношение сохранилось и через восемь недель после завершения терапии.
Кроме того, через 90 дней наблюдалось статистически достоверное улучшение суммарного индекса Лекена (с 12,4 ± 0,4 до 8,8 ± 0,3 балла, p ≤ 0,001) и снижение боли (с 5,6 ± 0,2 до 4,2 ± 0,2 балла, p ≤ 0,01). По остальным показателям (средняя дистанция ходьбы, функциональные нарушения) статистически значимых различий не получено (3,2 ± 0,1 vs 2,4 ± 0,2, p = 0,05 и 3,6 ± 0,3 vs 2,2 ± 0,1, p = 0,05). Через восемь недель после окончания лечения показатели оставались стабильными.
На фоне проводившейся терапии нежелательных реакций зафиксировано не было.

Введение
Остеоартрит (ОА) – одно из наиболее распространенных ревматических заболеваний, особенно среди лиц старшей возрастной группы.
В связи с увеличением продолжительности жизни населения заболеваемость ОА в XXI в. достигла масштабов эпидемии [1, 2]. По данным разных авторов, встречаемость ОА в популяции колеблется от 5 до 18%. Так, в США патология диагностирована у 20 млн взрослых, при этом рентгенологические признаки заболевания наблюдались практически у 70% лиц старше 65 лет. В Российской Федерации, согласно данным статистики, зарегистрировано 3 млн 700 тыс. больных. Первичная заболеваемость возросла более чем на 20%, что составляет 745 тыс. новых случаев ежегодно.
В последние годы сустав принято рассматривать не как анатомическую совокупность суставных поверхностей, хрящевых структур, суставной капсулы и связочного аппарата, а как единый орган с воспалительными, иммунными, метаболическими и функциональными составляющими [2]. В этой связи представления о патогенезе ОА претерпели значительные изменения. Если ранее патологию хряща считали следствием возрастных дегенеративных изменений и повышенной статико-динамической нагрузки на сустав, в настоящее время ключевая роль в развитии и прогрессировании ОА отводится воспалению и нарушению метаболизма хряща и субхондральной кости, что приводит к нарушению баланса между анаболическими и катаболическими процессами в последних с формированием хондрита, синовита и остеита [3]. При этом делается акцент на том, что ОА – это группа патогенетически близких заболеваний, имеющих разную этиологию, факторы риска, клинические проявления, приводящих к прогрессирующей потере гиалинового хряща, а также патологическому ремоделированию субхондральной кости [4].
Многообразие механизмов возникновения и течения заболевания позволяет обсуждать существование определенных фенотипических вариантов, отличающихся патофизиологическими процессами и клинической картиной. На сегодняшний день выделено семь фенотипов ОА: посттравматический, генетически детерминированный, метаболический, возраст-зависимый, эстроген-зависимый, кристаллический и болевой [2, 4]. Так, возраст-зависимый фенотип ОА обусловлен повреждением хондроцитов и внеклеточного матрикса, уменьшением толщины и плотности субхондральной кости, саркопенией и снижением репаративной способности хряща, жесткостью сухожилий, повышением нестабильности суставов с возрастом. Наличие генов, ассоциированных с развитием ОА, низкая костная масса и особенности формы скелета связаны с генетически детерминированным фенотипом заболевания. Необходимо отметить, что от определенных генов также зависят объем хряща и степень прогрессии ОА. Известно, что снижение уровня эстрогенов вследствие менопаузы обусловливает интенсивный костный обмен в субхондральной кости, снижение костной массы, уменьшение мышечной массы и ее силы, повреждение хондроцитов и экстрацеллюлярного матрикса. Дефицит эстрогенов способствует повышению нестабильности суставов и увеличению массы тела, а повышенная жировая масса в свою очередь ассоциируется с высоким уровнем адипокинов. Вследствие указанных изменений развивается эстроген-зависимый ОА. Возникновение и прогрессирование кристаллического ОА может быть связано с нарушениями врожденного иммунитета, а также кристалл-индуцированным воспалением. Метаболический ОА развивается у пациентов с ожирением, атеросклерозом и другими метаболическими расстройствами. В большинстве случаев он отражает системные нарушения метаболизма. Одним из вариантов метаболического ОА является диабет-индуцированный ОА. Вследствие высокой глюкозотоксичности происходят накопление конечных продуктов гликирования и активация оксидативного потенциала на локальном уровне. Эти факторы обусловливают патологическое ремоделирование костной, суставной и синовиальной тканей, а также биохимические изменения, которые впоследствии приводят к клиническим проявлениям ОА [4].
Необходимо отметить, что при ОА значительно повышается риск развития коморбидных состояний. Как правило, у пациентов с ОА одновременно имеют место пять-шесть заболеваний. Так, U.T. Kadam и соавт., изучив данные общей практики в отношении пациентов старше 50 лет и сопоставив данные 11 375 больных с клиническими признаками ОА с данными 11 780 пациентов, не страдавших ОА, установили, что количество сопутствующих заболеваний существенно выше у пациентов с ОА. В основной группе преимущественно высокие (шесть и более болезней) и средние (четыре-пять болезней) показатели индекса болезни зафиксированы у 31 и 25% пациентов, в контрольной – у 21 и 22% соответственно [5].
В связи с многообразием клинико-фенотипических вариантов лечение ОА остается актуальной проблемой. Несомненно, оно должно быть комплексным. При выборе терапии следует учитывать локализацию и распространенность процесса, выраженность клинических проявлений, степень деструкции сустава, функциональной активности пациента, наличие коморбидных состояний [6].
В настоящее время при ОА применяют два класса препаратов: симптом-модифицирующие быстрого действия (анальгетики, нестероидные противовоспалительные препараты, глюкокортикостероиды внутрисуставно, трансдермальные терапевтические системы) и симптом-модифицирующие медленного действия (Symptomatic Slow-Acting Drugs in Osteoarthritis – SYSADOA) (хондроитина сульфат, глюкозамина сульфат, неомыляемые соединения авокадо, диацереин, препараты гиалуроновой кислоты). Первые уменьшают выраженность болевого синдрома и воспаления, вторые замедляют прогрессирование дегенеративных изменений в суставе [3].
Применение симптом-модифицирующих средств медленного действия является перспективным для долгосрочного контроля симптомов ОА. Установлено, что SYSADOA эффективны в отношении симптомов заболевания, а также обладают болезнь-модифицирующим потенциалом [4, 7]. Наиболее изучено действие глюкозамина сульфата (ГС), который является классическим представителем семейства гликозаминогликанов.
В настоящее время существует несколько международных руководств по управлению ОА. Представленные в них рекомендации основаны на данных доказательной медицины. Тем не менее приходится констатировать, что между руководствами отсутствует согласованность подходов к применению разных методов лечения. Основная причина разногласий – гетерогенность лекарственных форм и маркировки препаратов в разных странах и регионах мира. В частности, существуют рецептурный запатентованный кристаллический ГС (компании Rottapharm/Meda), а также его генерики, безрецептурные препараты ГС и диетические добавки, содержащие соли глюкозамина гидрохлорида. Генерические препараты глюкозамина, безрецептурные лекарственные средства и диетические добавки существенно отличаются от кристаллического ГС. Речь прежде всего идет о различии в молекулярной структуре, фармакокинетических свойствах и схеме дозирования.
Эксперты Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита, исходя из полученных в ходе клинических исследований данных, рекомендуют отличать кристаллический ГС от других препаратов глюкозамина [7].
На данный момент времени накоплена обширная доказательная база в отношении симптом-модифицирующего действия кристаллического ГС [6, 8–11]. Его эффективность в отношении снижения экспрессии маркеров воспаления подтверждена результатами клинических исследований. Клинически это проявлялось уменьшением выраженности боли и улучшением функции суставов, рентгенологически – сужением суставной щели. Анализ трех основных подгрупп Кокрановского обзора, включавшего 16 рандомизированных плацебоконтролируемых исследований глюкозамина сульфата, показал, что только кристаллический ГС достоверно превосходит плацебо по купированию боли, оцениваемой по индексу выраженности ОА Университетов Западного Онтарио и МакМастера и индексу Лекена [7, 8, 11]. Метаанализ двух долгосрочных клинических исследований, включавший 428 больных ОА с гиперхолестеринемией и гипергликемией, продемонстрировал отсутствие негативного влияния кристаллического ГС в дозе 1500 мг/сут на артериальное давление, уровень липидов и глюкозы в крови [12].
Широкое применение в клинической практике получил препарат ДОНА (кристаллический ГС). Он представлен в трех формах: раствор для внутримышечной инъекции, порошок для приготовления раствора и таблетки.
Целью данного исследования стала оценка эффективности и переносимости комбинированной терапии препаратом ДОНА (внутримышечные инъекции и пероральный прием) у пациентов с ОА коленного сустава.
Материал и методы
В исследование было включено 200 больных с ОА коленного сустава первой – третьей степени согласно классификации Kellgren – Lawrence. Диагноз был подтвержден результатами рентгенологического исследования.
Критериями включения в исследование стали:
- пациенты мужского и женского пола в возрасте от 18 до 70 лет включительно;
- ОА коленного сустава первой – третьей степени с клинически выраженной симптоматикой (боль, нарушение функции);
- общее удовлетворительное самочувствие или отсутствие сопутствующей патологии/терапии, которая могла бы повлиять на интерпретацию результатов;
- отрицательный тест на беременность у женщин с сохраненным репродуктивным потенциалом.
Критерии невключения:
- наличие любых реакций гиперчувствительности к препарату и его компонентам, аллергия на морепродукты (креветки, моллюски);
- тяжелая хроническая почечная недостаточность;
- фенилкетонурия;
- беременность или период лактации;
- женщины с сохраненным репродуктивным потенциалом, не использующие адекватные методы контрацепции;
- нарушение сердечной проводимости и острая сердечная недостаточность, эпилептиформные судороги в анамнезе, тяжелые нарушения функции печени.
Критериями исключения больных из исследования служили нежелательные явления или серьезные нежелательные явления, развившиеся на фоне проводившегося лечения, значительные нарушения протокола, наступление беременности, потеря пациента из-под наблюдения, а также административные причины.
Общая длительность исследования составила 146 дней, из них 90 дней – период лечения, 56 дней динамического наблюдения.
Дизайн исследования предполагал три визита: первый – скрининг и начало терапии, второй – через 90 дней от начала терапии, третий – через восемь недель после завершения курса лечения.
На всех этапах исследования проводилась оценка качества жизни и функционального статуса.
Все пациенты получали комбинированную (инъекционную и пероральную) терапию препаратом кристаллического ГС (ДОНА) по следующей схеме: внутримышечные инъекции в дозе 400 мг три раза в неделю в течение первых четырех недель, на третьей и четвертой неделе от начала терапии прием порошка в дозе 1500 мг/сут в дни, когда инъекции ДОНЫ не проводились, применение порошка продолжалось до окончания восьми недель терапии, после чего пациентов переводили на прием таблеток по 750 мг два раза в день.
Для оценки качества жизни использовали Европейский опросник оценки качества жизни по пяти компонентам (European Quality of Life Questionnaire – EQ-5D). Данный опросник состоит из двух частей. Первая часть предназначена для определения состояния здоровья по пяти критериям: подвижность (передвижение в пространстве), самообслуживание, активность в повседневной жизни, боль/дискомфорт и беспокойство/депрессия. Каждый компонент оценивается по трехбалльной системе: один балл – отсутствие нарушений, два балла – умеренные нарушения, три балла – выраженные нарушения.
Эффективность терапии определяли с помощью альго-функционального индекса Лекена. Данный индекс рекомендован экспертами Европейской антиревматической лиги для оценки эффективности SYSADOA при проведении клинических исследований у больных ОА (Всемирная организация здравоохранения, 1985). Он позволяет установить не только выраженность болевого синдрома, но и тяжесть состояния пациента. С помощью опросника пациенты сами могут установить выраженность симптомов гонартрита (функциональности). В опроснике содержится десять вопросов, распределенных по трем разделам. Первая субшкала (пять вопросов) позволяет оценить болевую симптоматику, вторая (один вопрос) – максимальную дистанцию ходьбы, третья субшкала (четыре вопроса) – функциональную активность и ограничение подвижности коленного сустава. Каждый признак оценивается в баллах, тяжесть состояния – по сумме баллов.
Оценка безопасности осуществлялась на протяжении всего исследования. При возникновении нежелательных реакций определяли их выраженность (легкая, средняя, выраженная), связь с назначенной терапией и необходимость приема сопутствующих препаратов.
Полученные результаты обрабатывали с помощью непараметрических и параметрических методов статистики. При этом использовали критерии Вилкоксона и Манна – Уитни. Различия считали статистически значимыми при р ≤ 0,05.
Результаты наблюдений обрабатывали с использованием программы Statistica 7.0.
Результаты
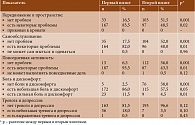
Согласно данным опроса, проведенного во время первого визита (EQ-5D), наличие проблем со здоровьем отметили все больные ОА. Таковые были охарактеризованы как средней степени тяжести. На момент первого визита сильную боль и дискомфорт испытывали 23 (11,5%) пациента, небольшую тревогу и депрессию – 36 (18%), отсутствие тревоги и депрессии – 163 (81,5%), проблемы с передвижением в пространстве – 167 (83,5%), с самообслуживанием – 164 (82%) больных. Среди опрошенных только пятеро (2,5%) не испытывали боли или дискомфорта (табл. 1).
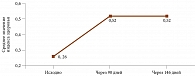
При расчете количественного индекса здоровья по показателям EQ-5D установлено, что исходно показатель индекса здоровья составил 0,26 ± 0,03. Через 90 дней от начала терапии отмечалось статистически значимое увеличение данного показателя – до 0,52 ± 0,03 (p ≤ 0,01). Изменение индекса здоровья на фоне проводимой терапии соответствовало удовлетворительному терапевтическому эффекту (Δ EQ-5D – 0,26). Аналогичное соотношение сохранилось и через восемь недель после завершения терапии (рисунок).
Оценка функциональной способности проводилась у всех включенных в исследование. Пациенты самостоятельно заполняли опросники во время первого и последующих визитов. На момент первого визита суммарный индекс Лекена составил 12,4 ± 0,4 балла, выраженность боли – 5,6 ± 0,2 балла, средняя дистанция ходьбы – 3,2 ± 0,1 балла, ограничение подвижности – 3,6 ± 0,3 балла. Через 90 дней терапии отмечалось статистически достоверное улучшение суммарного индекса Лекена (8,8 ± 0,3 балла, p ≤ 0,001) и снижение боли (4,2 ± 0,2 балла, p ≤ 0,01). По остальным показателям (средняя дистанция ходьбы, функциональные нарушения) статистически значимых различий не получено (3,2 ± 0,1 vs 2,4 ± 0,2 балла, p = 0,05, и 3,6 ± 0,3 vs 2,2 ± 0,1 балла, p = 0,05). Через восемь недель после окончания лечения показатели оставались практически такими же, как во время второго визита (табл. 2).
Нежелательных эффектов на фоне такой схемы терапии не зарегистрировано.
Заключение
Результаты исследования продемонстрировали эффективность комбинированной терапии препаратом ДОНА при лечении ОА. В частности, у пациентов улучшились показатели суммарного альго-функционального индекса Лекена, EQ-5D. При этом клинический эффект сохранялся в течение восьми недель после завершения курса лечения. Нежелательные реакции зарегистрированы не были. Полученные данные согласуются с данными других исследований, которые продемонстрировали благоприятные ближайшие и отдаленные эффекты применения кристаллических ГС [6, 8, 9, 11, 12].
Yu.V. Averkiyeva, PhD, T.A. Raskina, DM, Prof., I.A. Shafiyeva, PhD, N.S. Belousova, S.A. Polyakova, PhD, P.A. Soboleva, G.I. Malkova, L.Ye. Maksimenko, S.V. Mashchenko, Ye.V. Dobrovolskaya, Ye.A. Klinyshkov, N.V. Konshu, PhD
Kemerovo State Medical University
Samara State Medical University
Kemerovo Regional Clinical Tuberculosis Dispensary
LLC ‘Medical Practice’, Kemerovo
Kemerovo City Clinical Hospital № 2
Omsk Clinical Diagnostic Center
Clinical Cardiology Dispensary, Omsk
Omsk State Medical University
Contact person: Tatyana Alekseyevna Raskina, rassib@mail.ru
Research objective: to evaluate the efficacy and tolerability of combination therapy with DONA (intramuscular injection and oral administration) in patients with osteoarthritis (OA) of the knee joint.
Material and methods. The study included 200 patients with OA of the knee joint of the first-third degree according to the classification of Kellgren-Lawrence.
The total duration of the study was 146 days (90 days – the period of treatment, 56 days – dynamic observation). All patients received combination therapy with DONA.
Results. After 90 days from the start of therapy, statistically significant increase in the health index – from 0.26 ± 0.03 to 0.52 ± 0.03 (p ≤ 0.01) was observed. The change in the health index during therapy corresponded to a satisfactory therapeutic effect (Δ EQ-5D – 0.26). A similar ratio remained eight weeks after the therapy end.
In addition, after 90 days there was statistically significant improvement in the total Leken index (from 12.4 ± 0.4 to 8.8 ± 0.3 points, p ≤ 0.001) and the decrease in pain (from 5.6 ± 0.2 to 4.2 ± 0.2 points, p ≤ 0.01). For the other indicators (average distance walk, functional impairment) statistically significant differences were not obtained (3.2 ± 0.1 vs 2.4 ± 0.2, p = 0.05 and 3.6 ± 0.3 vs 2.2 ± 0.1, p = 0.05). Eight weeks after the end of treatment, the indicators remained stable.
No adverse reactions were recorded against the background of the therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.