Генитальные инфекции и патология шейки матки – новые возможности терапии
- Аннотация
- Статья
- Ссылки







Реабилитация пациенток с патологией шейки матки после деструктивных методов лечения
Прежде чем приступить к деструктивным методам лечения, нужно определиться с патологией шейки матки, которую необходимо подвергать деструкции. Проблема в том, что зачастую врачи неправильно используют терминологию в беседе с пациентом. Например, термин «эрозия шейки матки» медицинский работник употребляет не всегда обоснованно. При обследовании пациентки, заметив небольшое красное пятно, врач называет его эрозией и рекомендует женщине деструкцию этой патологии. Хотя данный метод бывает необоснован. Поэтому я предлагаю подробно рассмотреть заболевания шейки матки. Они бывают: доброкачественные, предраковые и рак.
К доброкачественным относятся: хронический или острый экзо-эндоцервицит, полип цервикального канала, эндометриоз ШМ, эрозия истинная. Последняя может появиться из-за деструктивных методов лечения. Такая эрозия не опасна, другое дело, если она сопровождает злокачественный процесс. Достаточно редкая ситуация, поэтому не стоит всем пациенткам говорить об эрозии шейки матки как о предраковом процессе. Также к доброкачественным относятся: старые рубцы, выворот, экстропион, лейкоплакия, кондилома, ретенционные кисты. Если говорить о предраковом процессе – это CIN I, CIN II, CIN III.
В настоящий момент в распоряжении врачей несколько различных морфологических классификаций неинвазивных и инвазивных заболеваний ШМ (таблица). Все они дают возможность ориентироваться в той субъективной оценке, которую проводит врач при обследовании. В зависимости от того, как доктор оценит ситуацию, будет выстроена тактика ведения пациента.
Причины развития патологии шейки матки всем хорошо известны. В первую очередь – это воспаление, затем травмы. Еще одна причина – локальная и общая иммуносупрессия, которая способствует активации вируса папилломы человека. Из этого вытекают все проблемы с развитием предракового процесса. Нарушение гормонального гомеостаза также значимо, потому что эпителий шейки матки является гормонально-зависимым.
При диагностике заболеваний шейки матки важная роль принадлежит цитологии, потому что данный метод дает возможность оценить состояние эпителия шейки матки. С помощью цитологии мы получаем быстрый результат. На втором месте кольпоскопия – этот метод помогает выявить фактор, который может воздействовать на состояние эпителия шейки матки, вызывать хроническое воспаление и предраковые процессы. Далее идет биопсия ШМ. Дополнительно к данному методу в некоторых случаях требуется соскоб из цервикального канала. Он проводится, когда граница стыков эпителия из зон трансформации уходит в цервикальный канал, и мы не можем увидеть, что там происходит. В такой ситуации дополнительно к биопсии необходимо сделать соскоб из цервикального канала. Последним пунктом я выделила морфологическое исследование.
После диагностики заболеваний ШМ врач выбирает тактику ведения пациента. ASCUS – (атипические клетки неясного значения) – данная тактика больше выжидательная, особенно, если ВПЧ высокоонкогенного типа не выявляются и данные Дайджин-теста указывают на низкий риск развития злокачественного процесса. LSIL – (низкая степень плоскоклеточного интраэпителиального поражения) – удаление патологически измененного участка ШМ. HSIL – (высокая степень плоскоклеточного интраэпителиального поражения) – эксцизия, конизация, частичная ампутация шейки матки. Выбор метода лечения во многом зависит от размера патологического участка, его места расположения, от возраста и репродуктивного анамнеза пациентки.
Лечение заболеваний шейки матки должно проходить поэтапно. Первое – это медикаментозное лечение. Оно включает в себя возможности терапии всех нарушений микробиоценоза влагалища. В последующем может быть использована радиоволновая хирургия аппаратом «Сургитрон». Если говорить о лазерной коагуляции или конизации, то данная терапия требует хороших, мощных хирургических навыков и уверенного владения лазерным аппаратом. Поэтому в широкой практике радиоволновой метод становится более предпочтительным. Радиоволновая хирургия приобретает несколько главенствующую роль за счет того, что позволяет удалить участок, с тем чтобы сохранить его для гистологического исследования. Что касается криодеструкции, то на данный момент этот метод не может гарантировать, что измененный участок эпителия полностью подвергся некрозу. Потому что глубину промерзания фактически контролировать невозможно. С другой стороны, метод прост в использовании, не требует особых навыков, легко переносится пациенткой. Фотодинамическая терапия широко используется там, где есть тяжелые поражения эпителия шейки матки. Использование данного метода оправдано особенно у молодых женщин, т.к. сохраняет анатомо-функциональную целостность шейки матки.
О процессе эпителизации достаточно много споров: когда проводить деструкцию, чтобы это было наиболее эффективно и сопровождалось наименьшим побочным воздействием. Я и мои коллеги выбрали сроки воздействия на ШМ сразу после менструации, до 10-го дня от начала цикла. Если наступает беременность малых сроков, то до менструации невозможно это определить. Поэтому в первые дни, практически сразу после менструации, мы проводим деструктивные методы воздействия. Сроки эпителизации колеблются от 4 до 8 недель, все зависит от того метода, который мы использовали для деструкции. Также учитывается, насколько хорошо мы подготовили пациентку, избавили ее от инфекционного компонента и нормализовали микробиоценоз влагалища. Кроме того, на сроки эпителизации влияют индивидуальные особенности организма больной, потому как привлекать какие-то методы на период до следующей менструации от момента коагуляции мы считаем нецелесообразным: каждое введение зеркал является травматичным, способствует преждевременному нарушению тех процессов репарации, которые естественно протекают на шейке матки. Поэтому нецелесообразно воздействовать на шейку раньше, чем через месяц после деструктивного метода воздействия.
Довольно часто возникают проблемы эпителизации – длительная эпителизация, которая сопровождается различными осложнениями. Например, очень опасна кровоточивость. В этом случае можно использовать банальные кровоостанавливающие препараты, гемостатическую губку, и добиться хорошего результата. Еще одна проблема – воспалительные процессы. Когда врач проводит деструктивные методы лечения, воспаление верхних отделов гениталий должно быть уже не в острой форме. Однако во влагалище могут остаться признаки бактериального вагиноза, который будет поддерживать картину хронического воспаления или наоборот. Такая ситуация нарушает процесс эпителизации. Кроме того, может возникнуть патология микробиоценоза, а также нарушение дифференцировки клеток. Самая неприятная проблема – это эндометриоз, которого врачи больше всего боятся, т.к. это заболевание может привести к бесплодию. Стоит также учитывать, что на эпителизацию влияет иммунодефицит и замедление репаративных процессов.
Чтобы избежать серьезных последствий, важно проводить профилактику осложнений. Во-первых, это адекватная подготовка пациентки к деструктивным методам лечения. Во-вторых, комплексное обследование. УЗИ необходимо для того, чтобы определить наличие распространенной формы эндометриоза. С помощью анализа крови можно выявить нарушения в системе свертывания крови, полученные данные помогут предотвратить обильные кровотечения, которые могут возникнуть во время проведения процедуры обследования. Биоценоз влагалища также значим, потому что ph среды влагалища влияет на процессы эпителизации, на их скорость. В целях профилактики во всех случаях необходимо проводить лечение инфекционно-воспалительного процесса до деструкции. При мероприятиях, направленных на ускорение процессов эпителизации, нормализации биоценоза, хорошо помогает препарат Депантол®.
Чтобы изучить эффективность и приемлемость препарата в постагуляционном периоде для ускорения процессов нормальной эпителизации шейки матки, было проведено исследование. В нем приняли участие 50 пациенток, которым провели деструктивные методы лечения. У всех женщин наблюдалась замедленная эпителизация шейки матки:
- I группа (20 пациенток) получала Депантол® 10 дней по 1 свече;
- II группа (20 пациенток) получала Депантол® 10 дней по 2 свечи;
- III группа контроля – 10 человек.
Схема применения использовалась следующая. Депантол® назначали пациенткам только в случае неполной эпителизации ШМ через месяц после проведенного деструктивного лечения. В группе контроля – наблюдали за естественной эпителизацией. При цитологическом исследовании до применения препарата Депантол® у всех пациенток выявлялась картина воспаления на фоне активной эпителизации, при бактериологическом исследовании нарушение микробиоценоза в сторону бактериального вагиноза.
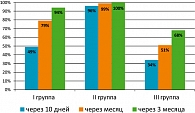
В результате при применении препарата Депантол® 2 раза в день полная эпителизация наступила у 96% пациенток сразу после 10-дневного курса лечения. При назначении Депантола 1 раз в день заживление происходило более длительно, полная эпителизация отмечалась у 94% пациенток через 3 месяца. В контрольной группе (без применения Депантола) через 10 дней эпителизация наблюдалась только у 34% пациенток, через 3 месяца эпителизация также наблюдалась лишь у 68% женщин (рисунок). Эффективность препарата Депантол® подтверждена данными кольпоскопии (нормализация кольпоскопической картины); цитологии (отсутствие воспалительной реакции, преобладание клеток поверхностного и промежуточного слоя и единичные комплексы цилиндрического эпителия); бактериоскопии и бактериологии (нормоценоз). Хочу сделать акцент на том, что препарат показал очень хорошую эффективность при использовании 2 свечей в течение 10 дней. Полиэтиленоксидная основа препарата обеспечивает эффект влагалищной ванночки с антисептическим и репаративным эффектом.
Сравнительная эффективность противорецидивной терапии препаратами Лавомакс и Ацикловир у женщин, страдающих генитальным герпесом
Генитальный герпес – это рецидивирующее пожизненное заболевание, вызываемое вирусом простого герпеса (ВПГ). Данная проблема является одной из наиболее социально значимых во всем мире.
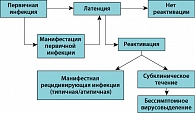
Существует схема естественного течения герпетической инфекции, в которой указано, что первичная инфекция может протекать тяжело (манифестация первичной инфекции). С другой, стороны инфекция может протекать бессимптомно. Оба варианта переходят в латентное состояние. Латенция может длиться пожизненно, но никогда не активироваться, не приобретать манифестаций. Однако латенция часто реактивируется. Реактивация может выражаться манифестными рецидивами. Причем клиника может быть как типичная, так и атипичная. Необходимо обратить внимание на то, что до 40% всех больных могут иметь субклиническое течение, то есть без развития типичной клиники, без пузырьковых высыпаний. Очень большой уровень инфекций – бессимптомное вирусовыделение. В этом случае отсутствуют прямые и косвенные симптомы, но вирус из половых органов выделяется. Он опасен в плане передачи инфекции как своему половому партнеру, так и (если это беременная женщина) своему потомству (рисунок).
Существуют различные подходы к лечению генитального герпеса (ГГ). Стратегия терапии зависит от типа инфекции. Первичная инфекция – терапия ациклическими нуклеозидами. В настоящий момент есть 3 группы препаратов: Ацикловир, Валацикловир и Фамцикловир. Другой вопрос – рецидивирующая инфекция. Существует 2 стратегии ведения пациентов с рецидивирующим ГГ – эпизодическая терапия и супрессивная терапия. Факторы, влияющие на выбор стратегии ведения пациентов с рецидивирующим герпесом:
- влияние болезни на качество жизни;
- психосоциальные/психосексуальные расстройства;
- частота и тяжесть рецидивов;
- отчетливая выраженность продромальных явлений.
Основа терапии генитального герпеса – этиотропные противовирусные пероральные препараты. Препараты, рекомендованные для терапии в Европе, России и других странах: Ацикловир, Валацикловир и Фамцикловир. Механизм действия данных препаратов – блокирование синтеза вирусной ДНК.
Согласно международным и российским стандартам лечения, при первом клиническом эпизоде ГГ рекомендуется пролонгировать лечение до 10 дней. При эпизодической терапии можно ограничиться сроком в 5 дней лечения. Эпизод рецидива купируется очень быстро. Супрессивная длительная терапия назначается ежедневно. При использовании Ацикловира устанавливается доза по 400 мг 2 раза в сутки, Фамцикловир назначают по 250 мг 2 раза в сутки, Валацикловир – по 500 мг 1 раз в сутки ежедневно.
Простой герпес – иммунодефицитное заболевание, развивающееся вследствие потери клеточным иммунитетом контроля над латентным состоянием хронически персистирующего в организме ВПГ. Отмечена взаимосвязь между клиническим течением заболевания и состоянием интерферонового статуса, что выражается в нарастании частоты рецидивов в зависимости от степени выраженности снижения синтеза α- и γ-интерферона, а также цитотоксичности естественных киллеров и факторов местного иммунитета.
Иммунный ответ организма в ответ на внедрение инфекции складывается из двух фаз. Фазу местного воспаления в месте локализации патогена контролирует интерферон-α, который нормализует местный иммунный ответ, ингибирует размножение внутриклеточных патогенов, обеспечивает защиту от возможного заражения неинфицированных клеток. Фазу системного воспаления (выход инфекции за пределы пораженного органа) контролирует интерферон-γ, который приводит к нормализации общего иммунного ответа, увеличивает активность клеток-киллеров, уничтожающих инфекцию, независимо от ее локализации.
В данный момент врачи не располагают широким выбором иммунотропных препаратов. Чтобы выявить наиболее оптимальный препарат, было проведено исследование. Первая цель – оценить эффективность противорецидивной терапии препаратом Лавомакс® в составе комплексной терапии больных часто рецидивирующим генитальным герпесом в сравнении с эффективностью стандартного супрессивного лечения Ацикловиром. Вторичной целью была оценка безопасности длительной (в течение 2 месяцев) терапии препаратом Лавомакс®.
В исследовании участвовали 30 женщин в возрасте от 21 до 42 лет, страдающих рецидивирующим генитальным герпесом, давностью от 1 до 13 лет, частотой рецидивов от 6 до 12 и более в год.
Пациенткам обеих групп проводилась одинаковая стандартная терапия Ацикловиром для купирования текущего эпизода (в течение 5 дней). 15 пациенткам контрольной группы для предупреждения следующих рецидивов проводилась длительная супрессивная терапия Ацикловиром в течение 6 месяцев. 15 пациенткам исследуемой группы проводилась противорецидивная терапия препаратом Лавомакс в течение 2 месяцев (в первые 2 суток по 125 мг, затем по 125 мг через 48 ч., 30 таблеток на курс).
Были использованы следующие методы клинических исследований: сбор анамнеза, осмотр больной, установление диагноза генитального герпеса на основании клинических проявлений, жалоб и результатов вирусологического, бактериологического и серологического исследований с целью исключения других инфекций, передаваемых половым путем.
При клиническом анализе учитывались анамнестические данные: длительность заболевания, продолжительность рецидивов в днях, частота возникновения рецидивов за предыдущий 12-месячный период, провоцирующие факторы, ранее проводимая терапия и ее эффективность. Принимались во внимание и другие признаки, свидетельствующие об активности вирусной инфекции: температурная реакция, наличие хронических воспалительных очагов в рото- и носоглотке, симптомы астении. Мы рассматривали их как проявления герпетической инфекции. В дальнейшем перечисленные показатели использовались в качестве критериев оценки течения рецидивирующего генитального герпеса.
При лабораторной идентификации ВПГ обнаружена ДНК 1 и 2 типа – методом полимеразной цепной реакции. Материалом для исследования служили содержимое пузырьков и эпителиальные клетки с поверхности эрозий.
График наблюдений предусматривал 6 визитов пациенток:
- нулевой (скрининговый) визит для оценки критериев включения, обследования и назначения терапии;
- 1-й визит через 5 дней для оценки результатов противовирусной терапии Ацикловиром;
- 2-й визит через 8 ± 2 дня для оценки регресса клинических проявлений текущего рецидива и назначения противорецидивной терапии;
- 3-й визит через 2 мес. после окончания противорецидивной терапии (в первой группе – Ацикловиром, во второй – Лавомаксом);
- 4-й визит через 6-7 мес. (для отслеживания новых рецидивов);
- 5-й визит – через год также для контроля рецидивов.
Исходя из результатов исследования, противорецидивная терапия женщин с часто рецидивирующим генитальным герпесом с применением Лавомакса в течение 2 месяцев снижала число следующих рецидивов болезни и увеличивала межрецидивный период в 3,5 раза. При длительном (в течение 2 мес.) приеме препарата не отмечено побочных эффектов и непереносимости Лавомакса.
Смешанные урогенитальные инфекции в гинекологической практике: взгляд дерматовенеролога
В мире ежегодно регистрируется более 250 млн новых случаев заражения инфекциями, передающимися половым путем. В частности, гонореи – 25 млн, хламидийной инфекции – 50 млн, трихомониаза – более 180 млн человек.
В настоящее время этиологическими агентами урогенитальных инфекционных заболеваний являются патогенные микроорганизмы и условно-патогенные микроорганизмы.
Лечение гонококковой инфекции осуществляется согласно приказу Минздрава № 415 «Об утверждении протокола ведения больных «Гонококковая инфекция». Основными лекарственными средствами, применяемыми в терапии данной инфекции, являются препараты группы цефалоспоринов (Цефтриаксон, Цефотаксим), фторхинолонов (Ципрофлоксацин, Офлоксацин, Спектиномицин).
Начиная с 2004 года Государственный научный центр дерматовенерологии Росмедтехнологий ежегодно проводит мониторинг уровня гонококковой инфекции к антимикробным препаратам. К сожалению, данные, которые мы получаем, вынудили нас значительно скорректировать эти приказы.
В ряде регионов, к сожалению, для диагностики трихомониаза очень широко применяются методы ИФА. Я и мои коллеги против применения ИФА из-за ложноотрицательных результатов в начале заболевания, недостаточной чувствительности тест-систем, которые не регламентированы для диагностики, для постановки диагноза трихомониаза. Часто выявляются ложноположительные результаты уже после перенесенного процесса.
Метод, который часто используется на территории РФ, но не включен в регламентирующие документы – метод полимеразной цепной реакции (ПЦР). В настоящее время он имеет сугубо исследовательский статус. Таким образом, юридической силы такой диагноз не имеет.
В настоящее время единственной группой лекарственных препаратов, которые эффективны в отношении возбудителя урогенитального трихомониаза, являются производные 5-нитроимидазолов (5НИМЗ) – высокоактивные антимикробные препараты широкого спектра действия для системного лечения инфекций, вызванных облигатными анаэробными бактериями, которые являются в большинстве случаев причиной многих инфекций, передаваемых половым путем.
В настоящее время в РФ зарегистрированы следующие препараты группы 5-нитроимидазолов: Метронидазол, Тинидазол, Орнидазол, Секнидазол, Ниморазол, Тернидазол. Однако за последнее десятилетие появились данные о неэффективности лечения трихомониаза Метронидазолом. По оценке CDC, около 5% клинических изолятор T. vaginalis, показали некоторую степень устойчивости к Метронидазолу и Тинидазолу. Механизмы развития устойчивости описаны – это снижение активности нитроредуктаз микробной клетки, которое приводит к снижению внутриклеточной биотрансформации препаратов. Снижается образование комплексов в ДНК, процессов образования свободных радикалов и концентрации цитотоксических продуктов метаболизма. Также нарушается транспортная система клетки (снижение проницаемости клеточной оболочки T. vaginalis).
Следующая инфекция, широко распространенная – урогенитальный хламидиоз (C. trachomatis). Опасность его заключается в бессимптомном течении. Последствия: внутриутробное инфицирование плода, риск эктопической беременности, трубного бесплодия и другие.
В настоящее время лабораторная диагностика хламидиоза регламентирована. Используются следующие методы: культуральное исследование, метод амплификации нуклеиновых кислот, метод прямой иммунофлуоресценции и метод ИФА.
Неосложненный урогенитальный хламидиоз лечится по схемам, рекомендованным ВОЗ: Доксициклин (100 мг 2 раза в сутки 7 дней); Джозамицин (500 мг 3 раза в сутки 7 дней); Азитромицин (1 г однократно).
Рассмотрим генитальные микоплазмы (M.genitalium). Показания к обследованию: воспалительные процессы мочеполового тракта, наличие осложнений со стороны репродуктивных органов, обследование полового партнера или пациента с выявленной инфекцией. Что касается диагностики, то это микроскопия, культуральный метод, ИФА. Схема лечения заболеваний, вызванных M.genitalium: Азитромицин (1 г однократно); Джозамицин (500 мг 3 раза в сутки 10 дней); Доксициклин (100 мг 2 раза в сутки 10 дней).
Хочу остановиться подробнее на очень важном принципе лечения – комплаенсе. Комплаенс – комплекс мероприятий, направленных на безукоризненное выполнение врачебных рекомендаций в целях максимальной эффективности лечения. Все мы знаем, что пациенты не достаточно тщательно выполняют требования врача. Нередко в этом виноваты мы сами, когда назначаем громоздкие непонятные схемы. По результатам проведенных исследований, если препарат назначался 1 раз в сутки, то соблюдение больным рекомендаций достигает практически 100%.
Я хочу представить новый лекарственный препарат – Сафоцид®. Он является в своем роде уникальным препаратом, потому что в нем (в одной упаковке) собрано 3 различных компонента: секнидазол, азитромицин и флуконазол. Показаниями к назначению Сафоцида являются сочетанные, неосложненные урогенитальные инфекционные заболевания: трихомониаз, хламидиоз, заболевания, вызванные M.genitalium, бактериальный вагиноз, урогенитальный кандидоз. Схема лечения Сафоцидом довольно проста: больной принимает однократно все 4 таблетки, входящие в состав блистера, либо за час до еды, либо через 2 часа после еды.
Чтобы изучить эффективность и безопасность препарата Сафоцид®, в Государственном научном центре дерматовенерологии Росмедтехнологий было проведено исследование, в котором приняли участие пациенты с различной патологией (уретрит, цервицит, вульвовагинит, цистит). В исследование также включили пациентов с гонококковой инфекцией.
Во всех случаях, когда мы выявляли абсолютных патогенов, эффективность достигала 100%. Что касается неспецифических урогенитальных заболеваний (кандидоз, бактериальный вагиноз), была достигнута клиническая лабораторная эффективность 92%. Таким образом, основными преимуществами препарата Сафоцид® являются: однодневный курс лечения (полное излечение микст-инфекций, передающихся половым путем за 1 день); удобство применения для пациента; удобство для врача; очевидные экономические преимущества; возможность синдромального подхода, хорошая переносимость препарата Сафоцид®.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.