Гиперпластические процессы эндометрия: новый взгляд на проблему
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрены новая классификация и алгоритмы ведения пациенток с гиперпластическими процессами эндометрия.
В статье рассмотрены новая классификация и алгоритмы ведения пациенток с гиперпластическими процессами эндометрия.


Введение
Гиперпластические процессы эндометрия – одна из наиболее часто встречающихся гинекологических патологий [1]. Согласно данным O. Ozdegirmenci и соавт., в развитых странах ежегодно регистрируется около 200 000 новых случаев гиперплазии эндометрия (ГЭ) [2]. Однако ученые полагают, что эти показатели значительно занижены из-за отсутствия единых подходов к статистическому учету заболеваний.
В соответствии с классификацией Всемирной организации здравоохранения (World Health Organization – WHO), предложенной в 1994 г. и пересмотренной в 2003 г., существует четыре вида ГЭ [3]: простая и сложная с атипией или без таковой. Необходимо отметить, что классификация нашла широкое применение в клинической практике, однако она не лишена существенных недостатков. Прежде всего это связано со значительной вариабельностью гистологических заключений – в зависимости от опыта патоморфолога, его субъективных установок при анализе гистологического материала [3].
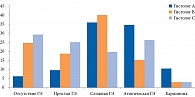
K.H. Allison и соавт. [4] установили, что при анализе гистологических срезов несколькими патоморфологами частота совпадения диагнозов в отсутствие гиперплазии эндометрия составляет 90,3%, при простой гиперплазии – 31,1%, при сложной – 51,1%, при атипической – 49,8%, при раке эндометрия – 57,5% (рисунок). Среди гистологов не было единства и в отношении наличия/отсутствия полипа эндометрия (p < 0,0001). Эти данные стали одной из предпосылок совершенствования диагностических критериев и классификации гиперпластических процессов эндометрия. В 2000 г. G.L. Mutter и соавт. предложили двухуровневую классификацию ГЭ, в рамках которой выделяют доброкачественную и атипическую гиперплазию (эндометриальная интраэпителиальная неоплазия (ЭИН)) [5]. Такая модернизация классификации была поддержана Европейской рабочей группой экспертов [6], а 2014 г. эксперты WHO внесли соответствующие изменения в классификацию опухолей женских репродуктивных органов [7], предварительно скорректировав терминологию и утвердив термин «эндометриоидная интраэпителиальная неоплазия». Новое название позволило подчеркнуть связь ЭИН с карциномами эндометриоидного типа и несерозными видами рака.
В отличие от классификации 1994 г. новая классификация имеет ряд клинико-патологических преимуществ, особенно в отношении воспроизводимости результатов диагностики. Так, J. Ordi и соавт. изучили 198 образцов тканей и сделали заключение в соответствии с четырех- и двухуровневой классификацией [8]. При использовании старой классификации полное согласие по диагнозу было достигнуто лишь в 28% случаев, новой – в 39–59%.
Согласно клиническим данным, у 40% пациенток с ЭИН в течение года после установления диагноза развивается рак эндометрия [9, 10]. Такие высокие цифры можно объяснить тем, что на момент первичного гистологического заключения раковые клетки уже находились в эндометрии, но не попали в изучаемый образец. В остальных случаях риск развития рака эндометрия в последующие годы повышался в 45 раз (по сравнению с контрольной группой) [9].
Новая классификация позволяет не только сделать более точное и воспроизводимое патоморфологическое заключение [8], но и спрогнозировать риск малигнизации (табл. 1). К микроскопическим критериям могут быть добавлены более объективные данные генетических и иммуногистохимических (ИГХ) исследований [11].
Новая классификация стала завоевывать популярность и мировое признание лишь в последние годы, что связано с недостатком стандартизованных подходов к ведению пациенток в рамках новых диагностических критериев и особенностями гинекологической практики в регионах.
Необходимо отметить, что эксперты Американского колледжа акушеров и гинекологов (American College of Obstetricians and Gynecologists – ACOG) рекомендуют использовать термин «эндометриоидная интраэпителиальная неоплазия», а не «атипическая гиперплазия», хотя результаты более поздних исследований доказали, что при атипической гиперплазии и ЭИН вероятность малигнизации в течение года сопоставима [12]. В 2016 г. впервые были опубликованы рекомендации по ведению пациенток с гиперпластическими процессами эндометрия Королевского колледжа акушеров и гинекологов Великобритании (Royal College of Obstetricians and Gynaecologists – RCOG) [13]. Согласно документу, термины «атипическая гиперплазия эндометрия» и «эндометриоидная интраэпителиальная неоплазия» признаны взаимозаменяемыми. Кроме того, в нем предложены алгоритмы ведения таких больных.
Доброкачественная гиперплазия эндометрия
Гиперплазия эндометрия является результатом длительного воздействия избыточного уровня эстрогенов на эндометрий. В начале процесс обратим, гистологически определяется нерезкое расширение желез на фоне нормального пролиферативного эндометрия. Данная форма изменения эндометрия получила название «пролиферативный эндометрий с нарушениями» [14]. Она не относится к формам железистой гиперплазии. Изменения происходят во всем эндометрии, при этом соотношение объема «железы – строма» существенно не изменяется.
Основными морфологическими признаками пролиферативного эндометрия с нарушениями считаются наличие желез пролиферативного типа с митотической активностью и кистозное расширение желез, возможны также псевдомногорядность расположения ядер, трубная метаплазия эпителия. Клинически это нарушение соответствует ановуляции, и при выскабливании определяется необильный соскоб эндометрия.
Вследствие более длительного влияния эстрогенов, которое не сменяется воздействием прогестерона, на фоне пролиферативного эндометрия с нарушениями развивается доброкачественная эндометриальная гиперплазия (активная фаза). Наблюдается непостоянная плотность расположения желез по всему объему. Появляются фокусы эндометрия, в которых объем желез превышает объем стромы, что и отличает доброкачественную эндометриальную гиперплазию от пролиферативного эндометрия с нарушениями. В дальнейшем в отсутствие компенсаторных эффектов прогестерона увеличиваются количество желез и объем стромы, появляются кистозные железы, развивается трубная метаплазия, в мелких сосудах образуются фибриновые тромбы, а в смежных участках происходят разрушение стромы и реактивные изменения эпителия [14]. При малом увеличении эндометрий представляется достаточно однородным, однако при среднем увеличении частота обнаружения кист и степень сближения желез изменяются от одного поля зрения к другому. Такое сочетание кажущейся однородности эндометрия при малом увеличении и ее отсутствия в отдельных полях зрения расценивается как важный диагностический признак и получило название «регулярный/нерегулярный эндометрий». Отличительной особенностью доброкачественной эндометриальной гиперплазии является идентичность цитологических признаков в участках эндометрия с разряженным и сближенным расположением желез [14].
Эндометрий реагирует на изменения гормонального фона даже при доброкачественной гиперплазии. Следовательно, при ГЭ могут наблюдаться морфологические изменения, отражающие динамические гормональные колебания, возникающие под воздействием как эндогенных, так и экзогенных ятрогенных факторов.
При постепенном сокращении количества эстрогенов митотическая активность эпителия в железах уменьшается. При быстром снижении их концентрации развивается деструкция стромы с геморрагической инфильтрацией. Такие изменения могут быть идентифицированы патоморфологом. В заключении их обозначают как «доброкачественная гиперплазия эндометрия в фазе истощения».
Прекращение стимулирующего воздействия эстрогенов приводит к апоптозу стромальных и эпителиальных клеток эндометрия и, как следствие, распространенному разрушению стромы и отторжению эндометрия. Клинически это проявляется массивным маточным кровотечением, чаще всего развивающимся после задержки менструации. Морфологическими признаками гиперпластического эндометрия в состоянии отторжения служат выраженные некробиотические изменения стромы, наличие характерных фибриновых тромбов, неопределенное строение желез, низкая/отсутствующая митотическая активность эпителия, наличие желез с эпителием секреторного типа, децидуоподобная реакция в строме [14]. При анализе гистологического материала трудно определить, что предшествовало этому состоянию – нормальный или патологически измененный эндометрий.
В некоторых случаях после длительного воздействия эстрогенов на эндометрий происходит отсроченная овуляция или введение прогестерона извне. Это вызывает типичные прогестерон-зависимые морфологические изменения, в том числе секреторные изменения эпителия желез и децидуоподобную перестройку стромальных элементов. Митотическая активность практически отсутствует. При патоморфологическом описании такого эндометрия используется термин «доброкачественная гиперплазия эндометрия с дополнительными эффектами прогестерона».
Согласно рекомендациям RCOG [13], после гистологического подтверждения диагноза «доброкачественная гиперплазия эндометрия» проводится оценка факторов риска. В их отсутствие можно ограничиться динамическим наблюдением и проведением контрольной биопсии через полгода. При наличии факторов риска, таких как ожирение, бесплодие, ановуляторные состояния, прием тамоксифена, назначают пероральные прогестины (ПП) в непрерывном режиме или содержащую левоноргестрел внутриматочную систему (ЛНГ-ВМС).
ЛНГ-ВМС – первая линия терапии вследствие более выраженного антипролиферативного эффекта. Это может быть объяснено тем, что при использовании внутриматочной системы локальное повышение концентрации левоноргестрела в эндометрии более значимо [15].
Согласно результатам метаанализа, ЛНГ-ВМС по сравнению с ПП более эффективно подавляет пролиферативную активность в эндометрии через три, шесть, 12 и 24 месяца лечения. Относительный риск (ОР) при 95%-ном доверительном интервале (ДИ) составил 2,30 (1,39–3,82), 3,16 (1,84–5,45), 5,73 (2,67–12,33) и 7,46 (2,55–21,78) соответственно. Пациентки, применявшие ЛНГ-ВМС, реже отмечали нерегулярные кровяные выделения и побочные эффекты терапии (уровень доказательности А), а также нуждались в проведении гистерэктомии (ОР 0,26 (95% ДИ 0,15–0,45)) [13].
Прогестины в непрерывном режиме (медроксипрогестерон 10–20 мг/сут или норэтистерон 10–15 мг/сут) следует назначать пациенткам, которым противопоказана ЛНГ-ВМС или которые отказываются от ее использования (уровень доказательности В). Назначать прогестины в циклическом режиме не рекомендуется из-за более низкой эффективности по сравнению с их применением в непрерывном режиме и использованием ЛНГ-ВМС (уровень доказательности А) [13].
Длительность лечения ЛНГ-ВМС должна составлять шесть месяцев (уровень доказательности В). При хорошей переносимости и потребности в контрацепции оно может быть продлено до пяти лет.
Оценка состояния эндометрия проводится с интервалом шесть месяцев. Наблюдение продолжается до получения двух отрицательных проб эндометрия (уровень доказательности Д). Пациентки должны быть проинформированы о симптомах ГЭ и необходимости незамедлительно обратиться к гинекологу в случае их появления. Для женщин группы риска в отношении рецидива заболевания (например, при индексе массы тела более 35 кг/м2) помимо двух биопсий с интервалом шесть месяцев рекомендовано ежегодно проводить исследование биоптатов эндометрия (уровень доказательности Д). Длительность наблюдения для каждой пациентки устанавливается индивидуально, с учетом клинической картины и факторов риска.
Радикальное хирургическое лечение, согласно вышеупомянутым рекомендациям, предлагается пациенткам, не нуждающимся в сохранении фертильности, в следующих случах:
- выявление атипической гиперплазии в период наблюдения;
- отсутствие регресса на фоне гормональной терапии, проводимой 12 месяцев;
- рецидив гиперплазии эндометрия по окончании курса гормональной терапии;
- сохраняющиеся маточные кровотечения на фоне проводимой терапии;
- отказ пациентки от медикаментозной терапии.
В период постменопаузы оптимальной считается лапароскопическая гистерэктомия с двухсторонней сальпингоовариоэктомией. В пременопаузе вопрос об удалении яичников в каждом конкретном случае решается индивидуально. Тубэктомия может быть рекомендована всем пациенткам, поскольку позволяет снизить риск злокачественных новообразований яичников. По нашему мнению, в качестве альтернативы может рассматриваться проведение гистерэктомии влагалища [16].
Аблация эндометрия не рекомендуется, так как ее выполнение не гарантирует радикальности удаления эндометрия, а формирующиеся внутриматочные синехии затрудняют оценку состояния полости матки.
Атипическая гиперплазия эндометрия
Эндометриоидная интраэпителиальная неоплазия представляет собой моноклональную неинвазивную генетически измененную неоплазму, которая фокально развивается из железистых клеток. В отличие от доброкачественной гиперплазии это предраковый процесс, который может приобретать злокачественный фенотип при дополнительных генетических повреждениях и переходить в эндометриоидную аденокарциному (тип 1). ЭИН характеризуется фокальным изменением желез. Величина фокуса должна быть не менее 1 мм в диаметре. Если фокус меньше 1 мм, постановка диагноза невозможна [14]. Патоморфолог должен дать лишь описательное заключение и рекомендовать повторное исследование эндометрия через три – шесть месяцев. Установление диагноза ЭИН возможно только при наличии двух ключевых признаков: уменьшения стромы менее чем на 45% и атипии эпителия. В дальнейшем фоновый эндометрий может замещаться неоплазированными железами, процесс становится диффузным.
При ЭИН смысл термина «атипия» отличается от общепринятого (полиморфизм, гиперхроматизм ядер и др.). Под таковой понимаются любые цитологические отличия эпителия желез неопластического фокуса от эпителия желез эндометриального фона. Фон в свою очередь может отражать любые доброкачественные изменения эпителия, обусловленные гиперэстрогенией, не компенсированной воздействием прогестерона.
Традиционные подходы к диагностике часто не позволяют определить переход гиперпластического процесса в неопластический, поэтому на основании компьютерной морфометрии были разработаны диагностические критерии ЭИН [17, 18]. Диагностически значимым является одновременное наличие критериев, представленных в табл. 2.
При ЭИН первой линией терапии признана гистерэктомия с сальпингоовариоэктомией или без таковой (уровень доказательности В). Предпочтительным доступом считается лапароскопический и вагинальный (уровень доказательности В). Преимущества срочного интраоперационного гистологического исследования или симультанной лимфаденэктомии не доказаны (уровень доказательности С). Аблация эндометрия при ЭИН, так же как и при доброкачественной гиперплазии, не рекомендуется.
Консервативное лечение возможно только при необходимости сохранить способность к деторождению в молодом возрасте и в отсутствие факторов риска [19]. Решение о применении органосохраняющей тактики должно быть принято коллегиально и основываться на серьезных аргументах. При назначении гормонального лечения следует обследовать пациентку на наличие рака эндометрия или яичников [19].
В качестве первой линии медикаментозной терапии рекомендуется ЛНГ-ВМС, второй – ПП [13]. В результате проведенного лечения в 75% случаев будет получен полный ответ на терапию с регрессом ЭИН. Однако у 35% этих пациенток возможен рецидив [19]. Четверть пациенток не ответит на такую терапию, и уже в первые три года наблюдения у них будет диагностирована персистенция/прогрессирование заболевания. При пролонгировании наблюдения до шести лет их процент увеличится до 51%, а через семь лет – до 72% [19]. Поэтому по завершении лечения и реализации репродуктивных задач пациенткам с ЭИН показано выполнение гистерэктомии. Частота живорождения у женщин с ЭИН, активно планирующих беременность, высока и может достигать 73% [19].
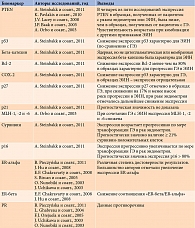
Для оценки потенциала эндометрия в отношении малигнизации возможно проведение ИГХ-исследования. В частности, изучение таких маркеров, как PTEN, p53, бета-катехин, Bcl-2, COX-2, p27, p21, MLH-1, -2 и -6, сурвивин, p16, экспрессия эстрогеновых и прогестероновых рецепторов (ER-альфа, ER-бета, PR) (табл. 3).
Согласно британским рекомендациям, при назначении гормонального лечения контрольное исследование эндометрия должно проводиться дважды с интервалом три месяца. При выявлении признаков прогрессирования или персистенции ЭИН хотя бы в одной из проб показана гистерэктомия. В случае получения двух отрицательных проб обследование эндометрия следует проводить один раз в полгода или год.
Эксперты ACOG (2015) указывают, что на сегодняшний день оптимальная длительность и режим терапии, так же как сроки и частота последующих наблюдений, не определены. Однако, согласно имеющимся данным, частота регресса ЭИН при системном введении прогестинов составляет 69% (95% ДИ), при локальном применении – 90% (ДИ 95%) [20, 21].
Заключение
Утвержденная в 2014 г. WHO новая классификация гиперпластических процессов эндометрия позволяет решить ряд важных клинических задач. Однако ее широкому применению препятствует одна нерешенная проблема – усовершенствование и уточнение алгоритмов ведения пациенток. В 2016 г. экспертами RCOG были предложены базовые протоколы ведения женщин с доброкачественной и атипической гиперплазией эндометрия.
В будущем целесообразно расширить понимание роли биомаркеров в диагностике и при динамическом наблюдении за профильными пациентками, определить оптимальную продолжительность лечения и возможные сроки возобновления менопаузальной гормональной терапии после эпизода ГЭ. Необходимо также оценить влияние снижения массы тела, в том числе после бариатрических операций, и изменения образа жизни на частоту рецидивов заболевания и возможность регресса гиперплазии.
V.V. Korennaya, Ye.Ye. Mass, Yu.A. Koloda, T.N. Poletova
Russian Medical Academy of Continuing Professional Education
Contact person: Vera Vyacheslavovna Korennaya, drkorennaya@mail.ru
Endometrial hyperplastic processes - one of the most common gynecological diseases. In 2014, the World Health Organization experts made fundamental changes in endometrial hyperplasia classification, highlighting its two variants: endometrioid intraepithelial neoplasia and benign hyperplasia. In 2016, for the first time, guidelines for the management of patients with hyperplastic endometrial processes were published by the Royal College of Obstetricians and Gynecologists of the UK.
The article describes and discusses a new classification and algorithms of patient management with endometrial hyperplastic processes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.