Патология эндометрия: возможности цитологических исследований в диагностике
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследовано 136 пациенток в возрасте 35–66 лет, у которых имелись показания для оценки состояния эндометрия. Проводили традиционное и жидкостное цитологические исследования, результаты которых сравнивали с результатами гистологического исследования. Из материала жидкостной цитологии готовили препарат для иммуноцитохимического исследования, которое выполняли непрямым иммуноферментным методом по протоколу с применением антител к p53, CEA, PTEN, p63 в системе детекции PrimeVizion.
Результаты. При использовании традиционного цитологического исследования диагноз совпадал с гистологическим в 83,9%, а при использовании жидкостной цитологии – в 75,8%. При этом при гиперплазии с атипией и аденокарциноме совпадение было полным в случае применения каждого из методов. Статистически значимое различие экспрессии иммуноцитологических маркеров между пациентками с доброкачественной патологией (гиперплазия без атипии) и предраковым состоянием и раком эндометрия имеет место в отношении СЕА. При гиперплазии без атипии чувствительность традиционной цитологии составила 68,4%, специфичность – 81,7%, чувствительность и специфичность жидкостной цитологии – 61,8 и 88,3% соответственно. При аденокарциноме аналогичные показатели составили соответственно 45,8 и 97,4% в случае традиционной цитологии и 66,7 и 97,4% – в случае жидкостной. В то же время при объединении пациенток с аденокарциномой и атипической гиперплазией в одну группу чувствительность обоих методов достигала 100%, специфичность – 97,2%.
Заключение. Анализ полученных результатов позволяет предположить, что точность цитологических исследований у пациенток при обследовании эндометрия можно увеличить за счет одновременного выполнения традиционной и жидкостной цитологии. Например, у пациенток с гиперплазией эндометрия без атипии прогностическая ценность положительного результата (PPV) для традиционной цитологии составила 82,5%, прогностическая ценность отрицательного результата (NPV) – 67,1% (хи-квадрат 33,8301, p (df = 1) < 0,0001). В той же группе пациенток для жидкостной цитологии PPV составил 87,0%, NPV – 64,6% (хи-квадрат 35,2597, p (df = 1) < 0,0001). Но при выполнении традиционной цитологии в комбинации с жидкостной PPV увеличился до 88,9%, а NPV – до 72,6% (хи-квадрат 51,8644, p (df = 1) < 0,0001).
Материал и методы. Обследовано 136 пациенток в возрасте 35–66 лет, у которых имелись показания для оценки состояния эндометрия. Проводили традиционное и жидкостное цитологические исследования, результаты которых сравнивали с результатами гистологического исследования. Из материала жидкостной цитологии готовили препарат для иммуноцитохимического исследования, которое выполняли непрямым иммуноферментным методом по протоколу с применением антител к p53, CEA, PTEN, p63 в системе детекции PrimeVizion.
Результаты. При использовании традиционного цитологического исследования диагноз совпадал с гистологическим в 83,9%, а при использовании жидкостной цитологии – в 75,8%. При этом при гиперплазии с атипией и аденокарциноме совпадение было полным в случае применения каждого из методов. Статистически значимое различие экспрессии иммуноцитологических маркеров между пациентками с доброкачественной патологией (гиперплазия без атипии) и предраковым состоянием и раком эндометрия имеет место в отношении СЕА. При гиперплазии без атипии чувствительность традиционной цитологии составила 68,4%, специфичность – 81,7%, чувствительность и специфичность жидкостной цитологии – 61,8 и 88,3% соответственно. При аденокарциноме аналогичные показатели составили соответственно 45,8 и 97,4% в случае традиционной цитологии и 66,7 и 97,4% – в случае жидкостной. В то же время при объединении пациенток с аденокарциномой и атипической гиперплазией в одну группу чувствительность обоих методов достигала 100%, специфичность – 97,2%.
Заключение. Анализ полученных результатов позволяет предположить, что точность цитологических исследований у пациенток при обследовании эндометрия можно увеличить за счет одновременного выполнения традиционной и жидкостной цитологии. Например, у пациенток с гиперплазией эндометрия без атипии прогностическая ценность положительного результата (PPV) для традиционной цитологии составила 82,5%, прогностическая ценность отрицательного результата (NPV) – 67,1% (хи-квадрат 33,8301, p (df = 1) < 0,0001). В той же группе пациенток для жидкостной цитологии PPV составил 87,0%, NPV – 64,6% (хи-квадрат 35,2597, p (df = 1) < 0,0001). Но при выполнении традиционной цитологии в комбинации с жидкостной PPV увеличился до 88,9%, а NPV – до 72,6% (хи-квадрат 51,8644, p (df = 1) < 0,0001).

В настоящее время диагностика и лечение доброкачественной патологии и рака эндометрия являются одними из наиболее актуальных проблем. Частота гиперплазии эндометрия составляет 133 на 100 тыс. женщин. При этом максимум заболеваемости приходится на возраст 50–54 года, минимум – на возраст до 30 лет. Атипическая гиперплазия эндометрия, при которой вероятность развития рака достигает 27,5%, диагностируется у 17 из 100 тыс. женщин. Рак эндометрия (18,8 на 100 тыс. населения) значимо «молодеет», среднегодовой темп прироста его частоты составляет 2,18% [1–3].
Золотым стандартом диагностики заболеваний эндометрия признана гистероскопия/офисная гистероскопия с биопсией эндометрия и последующим патоморфологическим исследованием. В отличие от него традиционная цитология (ТЦ) занимает более скромную позицию [4, 5]. В последнее время в цитологической диагностике дисплазии и рака шейки матки, рака мочевого пузыря и новообразований ряда других локализаций значительную роль стал играть метод жидкостной цитологии (ЖЦ) [6, 7].
Метод ЖЦ основан на приготовлении тонкослойных цитологических препаратов из материала, помещенного в специальную среду после забора. По сравнению с традиционными мазками на приготовление и последующий анализ тонкослойных препаратов значительно меньше влияет человеческий фактор [8, 9]. Тонкослойные препараты можно также использовать для иммуноцитохимического исследования [10–15]. Применение ЖЦ, а также комбинации ТЦ и ЖЦ ассоциируется с новыми возможностями в комплексной диагностике патологии эндометрия [16, 17].
Цель – уточнить возможности цитологического исследования в диагностике патологии эндометрия.
Материал и методы
Обследовано 136 пациенток в возрасте 35–66 лет, у которых имелись показания для оценки состояния эндометрия (аномальные маточные кровотечения, маточные кровотечения после менопаузы, эхографические признаки патологии эндометрия, а также необходимость предоперационного обследования по поводу других заболеваний). Материал для цитологического исследования был получен методом аспирации из полости матки. Ткань для гистологического исследования получали при раздельном кюретаже матки или после гистерэктомии. Материал для ТЦ сразу после получения наносили на предметные стекла и впоследствии окрашивали по Паппенгейму, для ЖЦ – помещали в виалу с консервантом. Сначала автоматизированным методом с использованием технологии фильтрации с последующей окраской по Папаниколау на приборе Эмкостейнер АФОМК готовили препарат для собственно цитологического исследования и оценки клеточности. Из оставшегося материала при достаточной клеточности (не менее 100 клеток в тонкослойном препарате) готовили препарат для иммуноцитохимического исследования (ИЦХИ). ИЦХИ выполняли непрямым иммуноферментным методом по протоколу с применением антител к p53, CEA, PTEN, p63 в системе детекции PrimeVizion, оценивая экспрессию маркеров качественно по наличию окрашивания зоны локализации антигена. При изучении экспрессии CEA оценивали мембранную и цитоплазменную реакции, для PTEN – окрашивание ядер и цитоплазмы, для p53 и p63 – ядерную реакцию. Гистологические исследования проводили по традиционной методике.
Статистическую обработку результатов исследования выполняли с применением пакета программ StatTech v. 2.6.2. Расчет диагностических показателей методов традиционной и жидкостной цитологии (чувствительности, специфичности, положительной прогностической ценности, отрицательной прогностической ценности) осуществляли методом бинарной логической регрессии с использованием четырехпольных таблиц сопряженности чувствительности. Статистически достоверными считались различия между сравниваемыми величинами при критическом уровне значимости p < 0,05.
Результаты
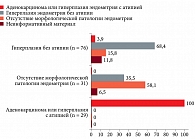
В группе пациенток, у которых при гистологическом исследовании препарата эндометрия была выявлена наиболее тяжелая патология (гиперплазия с атипией или рак эндометрия), во всех наблюдениях результаты гистологического исследования и ТЦ совпали (рис. 1). У пациенток с гиперплазией эндометрия без атипии или без патологии эндометрия, по данным морфологического исследования, имела место гипердиагностика при ТЦ. Так в 3,9% случаев при гиперплазии без атипии диагностирована атипическая гиперплазия или рак. В 11,8% наблюдений при гиперплазии без атипии исследуемый материал признан неинформативным. У пациенток с нормальным эндометрием при ТЦ ошибочно в 35,5% случаев диагностирована гиперплазия без атипии, а в 6,5% случаев материал оказался неинформативным.
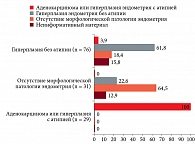
При выполнении ЖЦ (рис. 2) также имели место заключения о наличии неинформативного материала. Такое предварительное заключение давали при обнаружении в препарате менее пяти структур из клеток эндометрия. Но в таком случае методика позволяет приготовить препарат с большей концентрацией клеточного материала. Если и второй препарат не содержит достаточного количества клеток, материал признают неинформативным. При ЖЦ заключений о неинформативности материала было больше (11,8%), чем при ТЦ (8,1%). При анализе материала обоими методами такое заключение было дано только в 5,9% наблюдений. При ЖЦ также имела место гипердиагностика в группах пациенток с гиперплазией без атипии и в отсутствие патологии эндометрия.
В целом при использовании ТЦ у пациенток с информативным материалом диагноз совпал с гистологическим в 83,9% наблюдений, а при использовании ЖЦ – в 75,8%. При этом при гиперплазии с атипией и аденокарциноме совпадение было полным на фоне применения каждого метода. Следует отметить, что ЖЦ предоставляет лучшие условия для диагностики аденокарциномы. При ТЦ-анализе мешают «загрязнение» препарата и более выраженные некротические изменения в клетках. В препарате ЖЦ наличие полиморфных клеток с гиперхромными ядрами не вызывает сомнений в злокачественном характере процесса. По нашим наблюдениям, при ТЦ клетки выглядят крупнее, чем при ЖЦ, более выражены разрушения клеток, тогда как при ЖЦ лучше сохраняются как сами клетки, так и структура ядер. Вероятно, целесообразно применять комбинацию обоих методов.
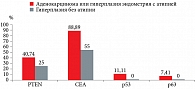
По нашим данным, статистически значимое различие экспрессии ИЦХ-маркера между пациентками с доброкачественной патологией (гиперплазия без атипии) и предраковым состоянием и раком эндометрия имеет место только в отношении СЕА, но не для других исследованных маркеров. Это позволяет рекомендовать исследование СЕА в комплексной диагностике рака эндометрия в цитологических исследованиях (рис. 3).
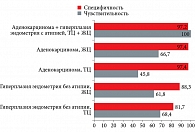
При гиперплазии без атипии чувствительность ТЦ составила 68,4%, специфичность – 81,7% (рис. 4), чувствительность и специфичность ЖЦ – 61,8 и 88,3%. При аденокарциноме для ТЦ эти показатели составили соответственно 45,8 и 97,4%, для ЖЦ – 66,7 и 97,4%. В то же время при объединении пациенток с аденокарциномой и атипической гиперплазией в одну группу чувствительность как ТЦ, так и ЖЦ достигла 100%, специфичность – 97,2%.
Анализ полученных нами результатов позволяет предположить, что точность цитологических исследований у пациенток при обследовании эндометрия можно увеличить за счет одновременного выполнения ТЦ и ЖЦ. Например, у пациенток с гиперплазией эндометрия без атипии прогностическая ценность положительного результата (PPV) для ТЦ составила 82,5%, прогностическая ценность отрицательного результата (NPV) – 67,1% (хи-квадрат 33,8301, p (df = 1) < 0,0001). В той же группе пациенток для ЖЦ PPV составил 87,0%, NPV – 64,6% (хи-квадрат 35,2597, p (df = 1) < 0,0001). Но при выполнении ТЦ и ЖЦ в комбинации PPV увеличился до 88,9%, а NPV – до 72,6% (хи-квадрат 51,8644, p (df = 1) < 0,0001) (рис. 5).
Заключение
Получение из полости матки материала для гистологической диагностики (гистероскопия + кюретаж) сопровождается хирургическим риском, достаточно значительным в некоторых группах больных (пациентки старческого возраста, с рубцом на матке, хроническим эндометритом и т.д.), а также риском, связанным с необходимостью обезболивания, достаточно существенным при сопутствующей соматической патологии.
Применение офисной гистероскопии не требует внутривенного обезболивания с сохранением спонтанного дыхания, являющегося стандартом при гистероскопии и раздельном кюретаже матки. В данном аспекте взятие материала без расширения канала шейки матки, как при цитологических исследованиях, более безопасно.
Другим, заслуживающим обсуждения обстоятельством, является то, что при гистероскопии (в том числе офисной) расширение полости матки раствором под некоторым давлением в той или иной степени сопровождается интравазацией и, вероятно, не рассматривается как абластичный метод. Сказанное относится и к кюретажу «вслепую». Видимо, аспирация из полости матки ассоциируется с меньшим риском.
Цитологическое исследование нуждается в совершенствовании. Одним из его направлений может быть одновременное выполнение ТЦ и ЖЦ (с ИЦХИ по показаниям). Важно, что во многих случаях из материала для ЖЦ при наличии в нем тканевых фрагментов можно приготовить клеточные блоки, то есть получить информацию о гистологическом строении. Если будет достигнута эффективность и точность, приближающая цитологическое исследование к золотому стандарту гистологического исследования, то сферой применения метода может стать как минимум контроль консервативного лечения патологии эндометрия. Интересно рассмотреть приемлемость выполнения цитологического исследования вместо кюретажа при контроле консервативного лечения атипической гиперплазии эндометрия у пациенток с репродуктивными планами, что предположительно уменьшит риск развития хронического эндометрита. Можно также обсуждать вопрос получения цитологического материала у пациенток с высоковероятным раком эндометрия (по данным ультразвукового исследования, магнитно-резонансной томографии) и принятия как минимум положительного заключения как окончательного вместо гистологического.
L.G. Sozaeva, PhD, I.P. Shabalova, PhD, Prof., A.Ye. Karpova, PhD, O.L. Glazkova, PhD, Ye.M. Kukovenko, PhD
Russian Medical Academy of Continuous Professional Education
V.F. Voino-Yasenetsky Scientific and Practical Center for Specialized Medical Care for Children
S.P. Botkin Moscow Multidisciplinary Scientific and Clinical Center
Contact person: Asel Ye. Karpova, aselique@gmail.com
Purpose is to clarify the possibilities of cytological examination in the diagnosis of endometrial pathology.
Material and methods. 136 patients aged 35–66 years were examined, who had indications for assessing the condition of the endometrium. Traditional and liquid cytological examinations were performed, the results of which were compared with the results of histological examination. A preparation was prepared from liquid cytology material for immunocytochemical examination, which was performed by an indirect enzyme immunoassay protocol using antibodies to p53, CEA, PTEN, p63 in the PrimeVizion detection system.
Results. When using traditional cytological examination, the diagnosis coincided with the histological one in 83.9%, and when using liquid cytology – in 75.8%. At the same time, in hyperplasia with atypia and adenocarcinoma, the coincidence was complete in the case of each of the methods. A statistically significant difference in the expression of immunocytological markers between patients with benign pathology (hyperplasia without atypia) and precancerous condition and endometrial cancer occurs in relation to CEA. In hyperplasia without atypia, the sensitivity of traditional cytology was 68.4%, specificity – 81.7%, sensitivity and specificity of liquid cytology – 61.8 and 88.3%, respectively. In adenocarcinoma, similar indicators were 45.8 and 97.4% in the case of traditional cytology and 66.7 and 97.4%, respectively, in the case of liquid cytology. At the same time, when combining patients with adenocarcinoma and atypical hyperplasia into one group, the sensitivity of both methods reached 100%, specificity – 97.2%.
Conclusion. The analysis of the obtained results suggests that the accuracy of cytological studies in patients during endometrial examination can be increased by simultaneous performance of traditional and liquid cytology. For example, in patients with endometrial hyperplasia without atypia, the prognostic value of a positive result (PPV) for traditional cytology was 82.5%, the prognostic value of a negative result (NPV) was 67.1% (χ2 = 33.8301, p (df = 1) < 0.0001). In the same group of patients for liquid cytology,
PPV was 87.0%, NPV was 64.6% (χ2 = 35.2597, p (df = 1) < 0.0001). But when performing traditional cytology in combination with liquid, PPV increased to 88.9%, and NPV – to 72.6% (χ2 = 51.8644, p (df = 1) < 0.0001).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.