Аномальные маточные кровотечения пубертатного периода и дисфункция щитовидной железы: клинические и прогностические аспекты
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено ретроспективное исследование 113 пациенток в возрасте от 12 до 17 лет, госпитализированных с диагнозом АМК пубертатного периода. У всех пациенток оценивали уровни тиреотропного гормона, свободного тироксина (Т4), свободного трийодтиронина и антител к тиреопероксидазе (АТ-ТПО) методом иммунохимического анализа. Кроме того, проводили ультразвуковое исследование органов малого таза.
Результаты. Гиперплазия эндометрия (М-эхо > 10 мм) выявлена в 32,3% случаев. Установлено, что уровень свободного Т4 статистически значимо ниже у пациенток с гиперплазией эндометрия (Me = 12,21 пмоль/л; Q1–Q3: 11,60–12,86) по сравнению с пациентками с нормальной толщиной эндометрия (Me = 12,77 пмоль/л; Q1–Q3: 12,03–13,51; p = 0,023). По результатам ROC-анализа пороговое значение свободного Т4 < 13,04 пмоль/л позволяет прогнозировать гиперплазию эндометрия с чувствительностью 82,9% и специфичностью 44,4%. Повышенные концентрации АТ-ТПО зарегистрированы у 58,3% пациенток с гиперплазией эндометрия и 41,7% пациенток без гиперплазии (p = 0,041). Более того, вероятность гиперплазии эндометрия у пациенток с повышенным уровнем АТ-ТПО в 3,9 раза превысила таковую у пациенток с нормальным уровнем антител (95%-ный доверительный интервал 1,116–13,506).
Заключение. Полученные результаты подтверждают клиническую значимость оценки гормонального статуса щитовидной железы у пациенток с АМК пубертатного периода. Уровень свободного Т4 и повышенные уровни АТ-ТПО продемонстрировали высокую прогностическую ценность в выявлении гиперпластических изменений эндометрия и предрасположенности к рецидивам кровотечений. Внедрение комплексной диагностики, включающей анализ уровней гормонов и аутоиммунных маркеров, направлено на улучшение стратификации рисков и обеспечение индивидуализированного подхода к выбору лечебной тактики.
Материал и методы. Проведено ретроспективное исследование 113 пациенток в возрасте от 12 до 17 лет, госпитализированных с диагнозом АМК пубертатного периода. У всех пациенток оценивали уровни тиреотропного гормона, свободного тироксина (Т4), свободного трийодтиронина и антител к тиреопероксидазе (АТ-ТПО) методом иммунохимического анализа. Кроме того, проводили ультразвуковое исследование органов малого таза.
Результаты. Гиперплазия эндометрия (М-эхо > 10 мм) выявлена в 32,3% случаев. Установлено, что уровень свободного Т4 статистически значимо ниже у пациенток с гиперплазией эндометрия (Me = 12,21 пмоль/л; Q1–Q3: 11,60–12,86) по сравнению с пациентками с нормальной толщиной эндометрия (Me = 12,77 пмоль/л; Q1–Q3: 12,03–13,51; p = 0,023). По результатам ROC-анализа пороговое значение свободного Т4 < 13,04 пмоль/л позволяет прогнозировать гиперплазию эндометрия с чувствительностью 82,9% и специфичностью 44,4%. Повышенные концентрации АТ-ТПО зарегистрированы у 58,3% пациенток с гиперплазией эндометрия и 41,7% пациенток без гиперплазии (p = 0,041). Более того, вероятность гиперплазии эндометрия у пациенток с повышенным уровнем АТ-ТПО в 3,9 раза превысила таковую у пациенток с нормальным уровнем антител (95%-ный доверительный интервал 1,116–13,506).
Заключение. Полученные результаты подтверждают клиническую значимость оценки гормонального статуса щитовидной железы у пациенток с АМК пубертатного периода. Уровень свободного Т4 и повышенные уровни АТ-ТПО продемонстрировали высокую прогностическую ценность в выявлении гиперпластических изменений эндометрия и предрасположенности к рецидивам кровотечений. Внедрение комплексной диагностики, включающей анализ уровней гормонов и аутоиммунных маркеров, направлено на улучшение стратификации рисков и обеспечение индивидуализированного подхода к выбору лечебной тактики.



Введение
Аномальные маточные кровотечения (АМК) пубертатного периода занимают одно из ведущих мест среди причин обращения девочек-подростков за специализированной гинекологической помощью [1]. Основным патогенетическим механизмом развития АМК у представителей указанной возрастной группы считается ановуляторная дисфункция, обусловленная незрелостью гипоталамо-гипофизарно-яичниковой оси, что приводит к нарушению циклической активности эндометрия. Вместе с тем роль других факторов остается недостаточно изученной. Речь, в частности, идет о функции щитовидной железы, хотя ее значение в регуляции процессов, определяющих состояние репродуктивной системы, хорошо известно.
Щитовидная железа играет центральную роль в регуляции метаболизма. Ее гормоны влияют практически на все клетки организма, активируя процессы клеточного дыхания в митохондриях. Этот процесс лежит в основе энергетического обеспечения организма, поскольку именно в митохондриях синтезируется аденозинтрифосфат – универсальный источник энергии. Гормоны щитовидной железы регулируют скорость обмена веществ, синтез тепла и энергообеспечение тканей, что особенно важно в условиях интенсивного роста и созревания в пубертатном периоде. Рецидивирующие АМК пубертатного периода, ассоциированные с нарушением функции щитовидной железы, способны приводить к развитию эндокринного дисбаланса и нарушению функций яичников, что в свою очередь повышает вероятность формирования гиперпластических процессов эндометрия. В результате возрастает вероятность нарушений процессов фолликулогенеза и бесплодия в будущем. Гормоны щитовидной железы играют ключевую роль в регуляции гипоталамо-гипофизарно-яичниковой оси, влияя на репродуктивные процессы на различных уровнях. Взаимодействие свободного трийодтиронина (Т3) и фолликулостимулирующего гормона (ФСГ) напрямую влияет на функции гранулезных клеток, формирование рецепторов лютеинизирующего гормона (ЛГ) и хорионического гонадотропина человека (ХГЧ), предотвращение апоптоза этих клеток [2]. Кроме того, гормоны щитовидной железы оказывают влияние на функцию яичников, снижая активность ароматазы в гранулезных клетках, ингибируя развитие предшественников фолликулов и воздействуя на активность синтазы оксида азота [3]. Присутствие рецепторов к гормонам щитовидной железы в развивающихся и зрелых ооцитах, а также выявление Т3, свободного тироксина (Т4) и антител к тиреопероксидазе (АТ-ТПО) в фолликулярной жидкости указывает на прямую роль щитовидной железы в регуляции фолликулогенеза и овуляции.
Материал и методы
В исследовании, проведенном на базе Российской детской клинической больницы – филиала Российского национального исследовательского медицинского университета им. Н.И. Пирогова, участвовало 113 пациенток с диагнозом АМК пубертатного периода, госпитализированных в 2022 г. Возраст пациенток составил 12–17 лет, медианный возраст – 14 лет (Q1–Q3 – 13–16 лет). Исследование носило ретроспективный характер. Лабораторная диагностика включала определение уровней тиреотропного гормона (ТТГ), свободного Т4, свободного Т3 и АТ-ТПО в сыворотке крови с использованием иммунохимического анализатора ARCHITECT i2000SR (Abbott, США). Статистическую обработку данных выполняли в программе StatTech v. 4.6.3 (ООО «Статтех», Россия). Для оценки распределения количественных переменных применяли критерии Шапиро – Уилка и Колмогорова – Смирнова. В случае отклонения от нормального распределения данные описывались с использованием медианы (Me) и квартильного размаха (Q1–Q3). Для сравнения двух групп применяли U-критерий Манна – Уитни, для многогруппового анализа – критерий Краскела – Уоллиса. Прогностическую значимость гормональных показателей оценивали с помощью ROC-анализа с определением порогового значения (cut-off), чувствительности и специфичности. Различия считались статистически значимыми при p < 0,05. Исследование одобрено локальным этическим комитетом ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Результаты
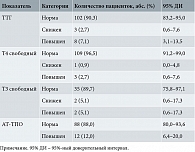
В рамках исследования у пациенток с АМК пубертатного периода изучали показатели функции щитовидной железы, а также их возможную взаимосвязь с рецидивами, гиперплазией эндометрия и используемыми методами лечения. У большинства пациенток показатели функции щитовидной железы, включая ТТГ, свободный Т4, свободный Т3 и АТ-ТПО, соответствовали референсным значениям (табл. 1).
Уровни ТТГ и свободного Т4 измеряли у всех 113 пациенток, в то время как Т3 и АТ-ТПО – у 39 и 100 пациенток соответственно (табл. 2).
Уровень ТТГ находился в пределах референсных значений у 102 из 113 пациенток, при этом отклонения зафиксированы у 11 пациенток: снижение – у трех, повышение – у восьми. Концентрация свободного Т4 соответствовала норме у 109 пациенток. У одной пациентки выявлено снижение показателя, у трех – повышение. Уровень свободного Т3 находился в пределах нормы у 35 пациенток, при этом отклонения в сторону снижения и повышения наблюдались у двух пациенток в каждом случае. АТ-ТПО в пределах нормальных значений зафиксированы у 88 пациенток, повышение – у 12.
В рамках исследования выполняли статистический анализ уровней ТТГ, Т4, Т3 и АТ-ТПО у пациенток с АМК пубертатного периода в зависимости от выбранной тактики лечения. Различий в уровнях ТТГ, свободного Т3 и АТ-ТПО между группами гормонального и консервативного лечения не выявлено (p = 0,699, p = 0,600 и p = 0,100 соответственно, U-критерий Манна – Уитни). Вместе с тем уровень свободного Т4 оказался статистически значимо ниже у пациенток группы гормонального гемостаза по сравнению с пациентками, получавшими консервативную терапию (табл. 3). В группу гормонального гемостаза вошли пациентки, у которых для остановки кровотечения применяли гормональную терапию, в группу консервативного лечения (без гормонального гемостаза) – пациентки, получавшие только препараты консервативной гемостатической терапии.
Для углубленного изучения взаимосвязи между функцией щитовидной железы и АМК проводили анализ уровней свободного Т4 и АТ-ТПО в зависимости от состояния эндометрия. Пациентки были распределены на две группы. Первую группу составили пациентки с гиперплазией эндометрия (М-эхо > 10 мм), вторую – пациентки с толщиной эндометрия в пределах нормы (М-эхо ≤ 10 мм). Гиперплазия эндометрия выявлена у 43 (32,3%) пациенток, тогда как нормальные показатели зафиксированы у 90 (67,7%). Анализ показал, что уровень свободного Т4 статистически значимо ниже у пациенток с гиперплазией эндометрия (Me = 12,21 пмоль/л; Q1–Q3 – 11,60–12,86) по сравнению с пациентками без признаков гиперплазии (Me = 12,77 пмоль/л; Q1–Q3 – 12,03–13,51). Полученные различия подтверждены с помощью U-критерия Манна – Уитни (p = 0,023). Кроме того, при анализе уровня АТ-ТПО установлены статистически значимые различия между группами (табл. 4). Повышенные уровни АТ-ТПО выявлены у 58,3% пациенток с гиперплазией эндометрия и 41,7% пациенток с нормальной толщиной эндометрия (p = 0,041; точный критерий Фишера). Более того, вероятность гиперплазии эндометрия у пациенток с повышенным уровнем АТ-ТПО превысила в 3,9 раза таковую у пациенток с нормальным уровнем антител (95%-ный доверительный интервал (ДИ) 1,116–13,506).
Для оценки прогностической значимости уровня свободного Т4 в выявлении гиперплазии эндометрия выполняли ROC-анализ. Площадь под ROC-кривой (AUC) составила 0,636 ± 0,055 (95% ДИ 0,528–0,744), что свидетельствует о статистической значимости модели (p = 0,023). Оптимальное пороговое значение (cut-off), соответствующее наивысшему значению индекса Юдена, – 13,04 пмоль/л. У пациенток с уровнем свободного Т4 ниже этой величины вероятность гиперплазии эндометрия выше. При данном пороговом значении чувствительность модели составила 82,9%, специфичность – 44,4%.
Обсуждение
Нами проведено исследование связи между функцией щитовидной железы и гиперпластическими процессами эндометрия у пациенток с АМК пубертатного периода. Исследования, посвященные эндокринным аспектам у женщин репродуктивного возраста, достаточно многочисленны, в то время как данные о подростках остаются крайне ограниченными, что подчеркивает важность настоящего исследования. Полученные результаты подтверждают, что даже минимальные изменения уровней гормонов щитовидной железы и АТ-ТПО могут иметь клиническое значение, особенно в аспекте рецидивирующих кровотечений и гиперплазии эндометрия. Наши данные демонстрируют, что уровни свободного Т4 и АТ-ТПО могут служить значимыми прогностическими маркерами гиперпластических изменений эндометрия у пациенток с АМК пубертатного периода. Статистически значимо более низкие значения свободного Т4 и повышенные уровни АТ-ТПО ассоциируются с гиперплазией эндометрия, что указывает на их потенциальное патогенетическое значение. Полученные нами данные согласуются с результатами предыдущих исследований, в которых подчеркивается роль гормонов щитовидной железы в регуляции пролиферативных процессов в эндометрии. Более того, как показал ROC-анализ, уровень свободного Т4 ниже 13,04 пмоль/л может быть использован как прогностический маркер гиперплазии эндометрия с высокой чувствительностью (82,9%) и умеренной специфичностью (44,4%). Повышенный уровень АТ-ТПО зафиксирован у 58,3% пациенток с гиперплазией эндометрия. Этот показатель значительно превысил таковой в группе с нормальной толщиной эндометрия – 41,7% (p = 0,041). Полученные данные позволяют предположить участие аутоиммунных процессов в патогенезе гиперпластических изменений эндометрия. Уровни АТ-ТПО служат маркерами аутоиммунных процессов в щитовидной железе, которые даже при ее сохраненной функции способны системно влиять на гормональный профиль. Вероятность гиперплазии эндометрия у пациенток с повышенным уровнем АТ-ТПО почти в четыре раза больше, чем у пациенток с нормальным значением АТ-ТПО.
Полученные данные согласуются с результатами крупных эпидемиологических исследований, указывающих на связь дисфункции щитовидной железы, особенно гипотиреоза, с нарушением репродуктивного здоровья. При этом роль аутоиммунных процессов требует дальнейшего изучения, поскольку в подростковом возрасте иммунная система характеризуется повышенной реактивностью, что может усиливать влияние субклинических нарушений на состояние эндометрия. Результаты нашего исследования свидетельствуют о необходимости комплексной диагностики пациенток с АМК, включая оценку уровней Т4 и АТ-ТПО. Это поможет не только обнаруживать скрытые эндокринные нарушения, но и более точно стратифицировать пациенток по риску гиперпластических процессов эндометрия. Выявленные маркеры могут стать частью прогностических моделей, позволяющих индивидуализировать подход к лечению и предотвращать развитие рецидивов.
В работе Л.В. Адамян и соавт. сказано, что в период полового созревания девочки-подростки подвержены более высокому риску развития аутоиммунного тиреоидита по сравнению с мальчиками [4]. Авторы отмечают, что аутоиммунные заболевания щитовидной железы могут играть значительную роль в нарушении женской репродуктивной функции. В частности, в ряде исследований отмечалась повышенная распространенность этих заболеваний среди женщин с бесплодием неясного генеза и синдромом поликистозных яичников (СПКЯ), что указывает на потенциальную связь патологии щитовидной железы с нарушениями репродуктивной системы.
Необходимо отметить, что во время пандемии и в постпандемическом периоде отмечалось увеличение частоты АМК, что может быть связано с влиянием SARS-CoV-2 на эндокринную систему, в том числе щитовидную железу [5]. Щитовидная железа экспрессирует рецептор ангиотензинпревращающего фермента 2, через который вирус проникает в клетку, что делает ее уязвимой к острой инфекции и системным нарушениям. Кроме того, Т3 и Т4 играют ключевую роль в регуляции иммунных процессов, включая клеточный иммунитет и противовирусные реакции. Это подчеркивает их важность для поддержания общего физиологического равновесия организма. Несмотря на то что у больных с контролируемыми формами гипотиреоза и гипертиреоза не наблюдалось повышенной заболеваемости COVID-19 или ухудшения его прогноза, ретроспективные и проспективные исследования последних лет выявили случаи дисфункции щитовидной железы, связанные как с острой фазой SARS-CoV-2, так и с постковидным синдромом, проявляющимся через несколько недель после перенесенного заболевания [6, 7]. Подобное взаимодействие может частично объяснить рост случаев АМК через влияние на гормональный статус и регуляцию эндометрия.
Рецидивирующие АМК пубертатного периода могут ассоциироваться с дисфункцией щитовидной железы и приводить к нарушению гормональной регуляции, изменению овариальной функции и формированию предпосылок для гиперплазии эндометрия. В этом случае повышаются вероятность нарушений фолликулогенеза и риск бесплодия в будущем. Бесплодие определяется как невозможность зачать ребенка после 12 месяцев регулярных половых контактов без использования контрацепции. Тиреоидные гормоны играют ключевую роль в регуляции гипоталамо-гипофизарно-яичниковой оси, влияя на репродуктивные процессы на различных уровнях. Взаимодействие Т3 и ФСГ напрямую влияет на функции гранулезных клеток, формирование рецепторов ЛГ/ХГЧ и предотвращение апоптоза этих клеток. Кроме того, тиреоидные гормоны изменяют функцию яичников, снижая активность ароматазы в гранулезных клетках, ингибируя развитие предшественников фолликулов и воздействуя на синтазу оксида азота [8, 9]. Присутствие тиреоидных рецепторов в развивающихся и зрелых ооцитах, а также выявление Т3, Т4 и тиреоидных антител в фолликулярной жидкости свидетельствует о прямой роли щитовидной железы в регуляции фолликулогенеза и овуляции.
Результаты ряда исследований демонстрируют связь между нарушениями функции щитовидной железы и АМК. В исследовании с участием 79 пациенток с АМК нарушения функции щитовидной железы отмечались в 15,1% случаев, в частности гипотиреоз – в 13,9% (субклинический – 8,8%, явный – 5,06%) и гипертиреоз – в 1,3% [10].
В другом исследовании с участием 200 пациенток нарушения функции щитовидной железы зарегистрированы в 19% случаев, из них 16,5% случаев с гипотиреозом (субклинический – 10,5%, явный – 6%) и 2,5% – с гипертиреозом [11].
В исследовании, включавшем 170 пациенток, у 22,4% выявлены патологии щитовидной железы с преобладанием гипотиреоза (17,6%) над гипертиреозом (4,7%) [12].
Сходные результаты отмечались и в других работах, где доля пациенток с АМК и нарушением функции щитовидной железы варьировала от 20 до 30%, причем в большинстве случаев преобладал гипотиреоз.
В исследовании K. Vimalambigai и соавт. у 6% пациенток с АМК гипотиреоз выступал этиологическим фактором наряду с анновуляторной дисфункцией (61,3%) и ранними проявлениями СПКЯ (16,6%) [13]. Хотя нарушения функции щитовидной железы встречались реже, их влияние на менструальный цикл подтвердилось описанием клинических признаков, таких как увеличение массы тела, холодовая непереносимость (зябкость), выпадение волос, нарушения стула (запор), что характерно для гипотиреоза.
Z. Abdulla и соавт. оценивали влияние гормональных нарушений, связанных с СПКЯ, на эндокринные и репродуктивные показатели [14]. У пациенток с СПКЯ наблюдались изменения уровней тиреоидных гормонов, таких как Т3 и Т4, однако значимых различий в концентрациях ТТГ и Т4 не выявлено.
Гипотиреоз, который часто диагностируется у пациенток с СПКЯ, ассоциирован с уменьшением уровня глобулина, связывающего половые гормоны, что приводит к развитию гиперандрогенизма. Этот процесс сопровождается клиническими проявлениями, такими как гирсутизм, акне и ановуляция, усугубляющими репродуктивные нарушения.
Cистематический обзор и метаанализ K.J. Comishen и соавт. были посвящены оценке основных причин и подходов к диагностике обильных менструальных кровотечений (ОМК) у подростков и женщин репродуктивного возраста (n = 41 541) [15]. Установлено, что нарушения функции щитовидной железы, включая гипотиреоз и гипертиреоз, встречаются у 3% пациенток с ОМК (95% ДИ 0–6%). При этом гипотиреоз составляет 89% этих случаев, а гипертиреоз – 11%. Интересно, что авторы указывают на важность возраст-специфического подхода к диагностике, поскольку у подростков с ОМК часто имеют место ановуляторные циклы и неструктурные причины кровотечений, включая нарушения щитовидной железы, тогда как у взрослых чаще выявляются структурные причины.
Выводы
Проведенное исследование выявило статистически значимую корреляцию между уровнями свободного тироксина и антител к тиреопероксидазе с гиперпластическими процессами эндометрия у пациенток с АМК пубертатного периода. Установлено, что сниженные значения свободного Т4, даже в пределах референсного интервала, достоверно коррелируют с наличием гиперплазии эндометрия и рецидивирующим характером кровотечений, что позволяет рассматривать данный параметр как независимый прогностический маркер. Повышенный уровень АТ-ТПО у пациенток с гиперплазией эндометрия свидетельствует о возможной роли аутоиммунных процессов щитовидной железы в патологической пролиферации эндометрия, а следовательно, увеличении вероятности гиперплазии в 3,9 раза. Эти данные подчеркивают необходимость комплексного подхода к диагностике пациенток с АМК пубертатного периода, включающего оценку уровней гормонов щитовидной железы и аутоиммунных маркеров. Сочетание лабораторных показателей с клинико-инструментальными данными способствует оптимизации стратификации риска и персонификации терапевтической стратегии. Данный подход открывает перспективы для ранней диагностики гиперпластических процессов эндометрия и разработки персонализированных алгоритмов лечения пациенток пубертатного возраста.
A.Yu. Kurmangaleeva, Ye.V. Sibirskaya, PhD, Prof.
Morozovskaya Children's City Clinical Hospital, Moscow
N.I. Pirogov Russian National Research Medical University
Russian Children’s Clinical Hospital – a Branch of N.I. Pirogov Russian National Research Medical University
Russian University of Medicine
Contact person: Aliya Yu. Kurmangaleeva, askarova-aliya@yandex.ru
Purpose is to evaluate the influence of thyroid hormone status on the development of abnormal uterine bleeding during puberty and to identify predictive markers of endometrial hyperplastic changes.
Material and methods. A retrospective study was conducted on 113 patients aged 12 to 17 years, hospitalized with a diagnosis of abnormal uterine bleeding during puberty. All patients underwent evaluation of thyroid-stimulating hormone, free thyroxine (T4), free triiodothyronine, and anti-thyroid peroxidase antibodies (TPO-Ab) using immunochemical analysis, along with ultrasound examination of the endometrium.
Results. Endometrial hyperplasia (endometrial thickness > 10 mm) was detected in 32.3% of the patients. It was found that the level of free T4 was significantly lower in the group with endometrial hyperplasia (Me = 12.21 pmol/L; Q1–Q3: 11.60–12.86) compared to patients with normal endometrial thickness (Me = 12.77 pmol/L; Q1–Q3: 12.03–13.51; p = 0.023). According to ROC analysis, a threshold value of free T4 < 13.040 pmol/L predicts endometrial hyperplasia with a sensitivity of 82.9% and a specificity of 44.4%. Elevated concentrations of TPO-Ab were observed in 58.3% of patients with endometrial hyperplasia compared to 41.7% in the group without hyperplasia (p = 0.041). Moreover, the likelihood of endometrial hyperplasia in patients with elevated TPO-Ab levels was 3.9 times higher compared to patients with normal antibody levels (95% CI 1.116–13.506).
Conclusion. The results confirm the clinical significance of assessing thyroid hormone status in patients with abnormal uterine bleeding during puberty. The level of free T4 and elevated TPO-Ab levels demonstrated high predictive value in identifying endometrial hyperplastic changes and predisposition to recurrent bleeding. The implementation of comprehensive diagnostics, including hormone and autoimmune marker analysis, improves risk stratification and enables a personalized approach to treatment selection.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.