количество статей
7145
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Иммуногистохимические аспекты хронического абактериального простатита
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №1
- Аннотация
- Статья
- Ссылки
Ок, давайте делать 2-х уровневое меню, без выпадалки "О журнале". Путь пользователь нажимает на "Эффективную фармакотерапию" для получения общей информации о издании.
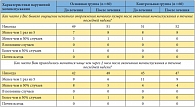
Таблица 2. Частота и выраженность нарушений мочеиспускания по данным опросника NIH-CPSI у пациентов с хроническим абактериальным простатитом в стадии обострения (количество пациентов)
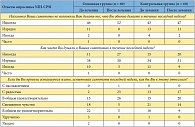
Таблица 3. Качество жизни пациентов с хроническим абактериальным простатитом в стадии обострения по данным опросника NIH-CPSI
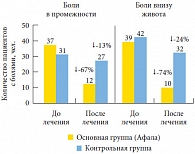
Рис. 1. Количество пациентов обеих групп с болями различной локализации по данным опросника NIH-CPSI
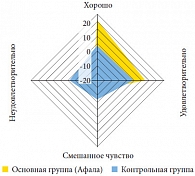
Рис. 2. Динамика количества пациентов обеих групп с различным качеством жизни по данным опросника NIH-CPSI
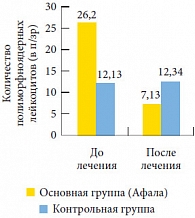
Рис. 3. Динамика средних значений количества полиморфноядерных лейкоцитов в секрете предстательной железы у пациентов обеих групп

Таблица 4. Динамика средних значений количества полиморфноядерных лейкоцитов и лимфоцитов в секрете предстательной железы у пациентов с хроническим абактериальным простатитом в стадии обострения
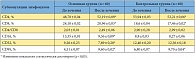
Таблица 5. Динамика средних значений субпопуляций лимфоцитов в секрете предстательной железы у пациентов с хроническим абактериальным простатитом в стадии обострения
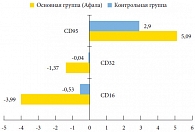
Рис. 4. Динамика разницы средних значений субпопуляций лимфоцитов в секрете предстательной железы (%) у пациентов обеих групп
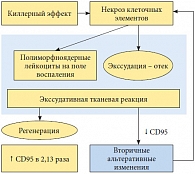
Рис. 5. Стимуляция репаративной регенерации при приеме препарата Афала
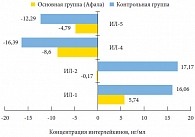
Рис. 6. Динамика разницы средних показателей интерлейкинов (ИЛ) в секрете предстательной железы у пациентов обеих групп

Таблица 6. Динамика средних концентраций интерлейкинов (ИЛ) в секрете предстательной железы у пациентов с хроническим абактериальным простатитом в стадии обострения
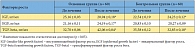
Таблица 7. Динамика средних концентраций факторов роста в секрете предстательной железы у пациентов с хроническим абактериальным простатитом в стадии обострения
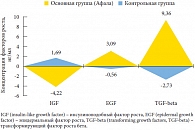
Рис. 7. Динамика прироста средних значений факторов роста в секрете предстательной железы у пациентов обеих групп
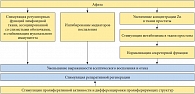
Рис. 8. Влияние препарата Афала на иммуногистохимические процессы в ткани предстательной железы при хроническом простатите
<p class="x-text">Вне зависимости от характера патологического фактора, запускающего воспалительный процесс в предстательной железе, важную роль в его развитии играет каскад иммунологических реакций. Особенно актуальны изменения иммунологических регуляторных механизмов при хроническом абактериальном простатите. Воспаление в этом случае может быть вторичным, иммунологически опосредованным, вызванным неизвестным антигеном или связанным с аутоиммунным процессом. Уровни неспецифичных антител иммуноглобулина (Ig) A и M к микроорганизмам при этом повышаются. Эти антитела вместе с фибриногеном и С₃-компонентом комплемента были обнаружены при биопсии простаты у больных хроническим простатитом.</p>
<p class="x-text">В основе многих воспалительных заболеваний, в том числе хронического простатита, лежит нарушение баланса между синтезом провоспалительных и противовоспалительных цитокинов – небольших информационных молекул, регулирующих межклеточные взаимодействия и определяющих стимуляцию или подавление роста клеток, их дифференцировку и функциональную активность. Они же обеспечивают согласованность действия иммунной, эндокринной и нервной систем как в нормальных условиях, так и в ответ на патологические воздействия.</p>
<p class="x-text">Все цитокины можно разделить на провоспалительные, обеспечивающие активизацию воспалительного процесса (интерлейкины (ИЛ) 1, 2, 6, 8, фактор некроза опухоли альфа, интерферон (ИФН) гамма); противовоспалительные, ограничивающие развитие воспаления (ИЛ 4, 5, 10, трансформирующий фактор роста бета (transforming growth factors beta, TGF-bеtа) и регуляторы клеточного и гуморального иммунитета (естественного или специфического). </p>
<p class="x-text">Цитокины – это антигеннеспецифические молекулы, поэтому с помощью определения уровня цитокинов невозможно диагностировать инфекционные, аутоиммунные и аллергические заболевания. Однако определение концентрации цитокинов в крови позволяет уточнить функциональную активность различных иммунокомпетентных клеток, активность воспалительного процесса и его прогноз. Например, цитокины часто присутствуют в секрете простаты при хронической небактериальной (категория IIIА) форме простатита. Этот факт позволяет повысить точность лабораторной диагностики простатита, в отличие от стандартного определения лейкоцитов при постановке диагноза. X.G. Ding и соавт. (2006) показали, что у больных хроническим абактериальным простатитом значительно повышены уровни ИФН-гамма и TGF-beta [1]. Это позволило исследователям заключить, что ИФН-гамма и TGF-beta являются важными звеньями в патогенетической цепи развития простатита и их измерение может быть объективным параметром в его диагностике.</p>
<p class="x-text">Для мужчин, страдающих хроническим простатитом (или синдромом хронической тазовой боли), характерен повышенный уровень цитокинов (фактора некроза опухоли альфа и ИЛ 1 и 3) в семенной жидкости [2]. L.J. Miller и соавт. (2002) также исследовали уровни цитокинов в семенной жидкости у больных хроническим простатитом [3]. По их данным, уровни ИФН-гамма, ИЛ 2 и 10 у этих пациентов были значительно выше нормы, а уровень ИЛ-10 коррелировал с показателями качества жизни и тяжестью простатита. В этой связи исследователи предположили, что ИЛ-10 имеет важное значение в патогенезе простатита, особенно при выраженном болевом синдроме. Эти же авторы показали, что уровень фактора роста нервов (nerve growth factor, NGF) был прямо пропорционален тяжести простатита (проявлению болевых симптомов) (p < 0,01) и уровню ИЛ-10 (p < 0,04), в то время как уровень ИЛ-6 – обратно пропорционален выраженности болевых симптомов по шкале McGill [4]. Исследователи пришли к выводу, что NGF и цитокины, регулирующие воспаление, играют значимую роль в алгическом компоненте хронического простатита. Определение концентрации данных цитокинов в семенной жидкости позволит объективно контролировать ход лечения пациентов с хроническим простатитом и будет иметь значение при выборе специфической терапии [5]. </p>
<p class="x-text">T.L. Jang и соавт. (2003) также подчеркивали роль иммунной системы в патогенезе хронического простатита [6]. Воспаление в предстательной железе зависит от баланса провоспалительных и противовоспалительных цитокинов, что определяет экспрессию таких факторов, как хемокины, индуцибельная синтаза оксида азота и циклооксигеназа 2. </p>
<p class="x-text">G. Kramer и M. Marberger (2006) обратили внимание на повышение уровней ИЛ 6, 8 и 17 у больных хроническим простатитом [7]. Названные цитокины индуцируют экспрессию циклооксигеназы 2, что влияет на замещение ткани простаты соединительной тканью через аутокринный и паракринный механизмы. Эта иммунная реакция может быть активирована Toll-подобными рецепторами (Toll-like receptor, TLR) и опосредована макрофагами и Т-клетками.</p>
<p class="x-text">H.H. Liu и соавт. (2006) определяли у пациентов с хроническим абактериальным простатитом нарушение баланса Th1/Th2, что подтверждает роль этих клеток в патогенезе простатита [8]. Дисбаланс Th1/Th2 проявлялся увеличением количества хелперов 1-го подтипа, способствующих преимущественно развитию клеточного иммунного ответа (Th1) посредством активации Т-киллеров. Цитокины, экспрессируемые поляризованными Т-хелперами 1-го подтипа (прежде всего ИФН-гамма), индуцируют классическую активацию макрофагов, связанную с фагоцитозом микроорганизмов, микробицидной активностью, индукцией воспаления и противоопухолевой активностью [9]. В отличие от Th1, цитокины Th2 (ИЛ 4 и 10) при «альтернативной активации» подавляют воспаление, способствуют образованию межклеточного матрикса, репарации и ремоделированию тканей, стимулируют сосудообразование и фагоцитируют апоптотические клетки [10]. Таким образом, гипотетически, изменяя баланс Th1/Th2 клеток в ту или иную сторону, можно управлять воспалительным процессом, активируя его или сводя к заключительному этапу – регенерации поврежденных тканей. </p>
<p class="x-text">Следует отметить значимость иммунных нарушений и в патогенезе развития бесплодия у больных хроническим простатитом. Помимо иммунологических нарушений Z. Fan и H. Zhong (2004) подчеркнули роль патогенных микроорганизмов и недостатка цинка [11].</p>
<p class="x-text">Российские ученые также исследовали уровень цитокинов и хемокинов в эякуляте у пациентов с хроническим простатитом [12]. Было установлено, что у больных хроническим простатитом концентрация ИЛ-8 в сыворотке крови, секрете предстательной железы и эякуляте увеличивается. Авторы отмечают, что повышение содержания ИЛ-8 в секрете предстательной железы и эякуляте коррелирует с другими маркерами воспаления, что позволяет использовать этот показатель для определения степени активности хронического простатита. </p>
<p class="x-text">Изменение иммунного статуса при возникновении и развитии воспалительного процесса в предстательной железе диктует необходимость медикаментозной коррекции. Одним из перспективных направлений является воздействие на процесс воспаления через простатический специфический антиген (ПСА). ПСА служит эндогенным регулятором разнообразных процессов в мужском организме. Все функции этого вещества, продуцируемого предстательной железой, возможно, еще не установлены. Основной его задачей как протеолитического фермента является поддержание агрегатного состояния эякулята, то есть его разжижение в результате расщепления семиногелина 1 и 2 и фибронектина. ПСА также принимает участие в расщеплении Lys-плазминогена до биологически активных фрагментов, антиангиогенная активность которых сопоставима с активностью ангиостатина. Помимо этого ПСА тормозит пролиферацию, миграцию и инвазию эндотелиальных клеток, блокирует действие ангиогенных факторов на эндотелий [13], а также стимулирует метаболические и пролиферативные процессы в эпителиальных клетках предстательной железы [14, 15]. </p>
<p class="x-text">Вызывает интерес роль ПСА в возникновении и поддержании воспалительного процесса при хроническом простатите. В нормальной предстательной железе бóльшая часть ПСА поступает в эякулят, разжижая его, и только 0,1% абсорбируется через базальную мембрану в кровь. При воспалительном процессе в результате действия медиаторов воспаления на ткань простаты нарушается барьерная функция простатических эпителиальных клеток, их базальной мембраны и базальной мембраны и эндотелия кровеносных сосудов [16]. В результате нарушения барьера между тканью простаты и сосудистым руслом концентрация ПСА в сыворотке крови повышается, что характерно и для воспалительного процесса, и для злокачественного новообразования простаты. Кроме того, ПСА выходит за пределы кровеносных сосудов и простатических ацинусов в ткань железы, где, являясь протеолитическим ферментом, усиливает процессы воспаления [17]. Выявлено увеличение суммарной активности сериновых протеиназ в эякуляте, а также активности каллекреина в секрете простаты у пациентов с хроническим абактериальным простатитом. Исследование уровня цитокинов в эякуляте у пациентов с хроническим простатитом / синдромом хронической тазовой боли выявило положительную зависимость концентрации ИЛ-8 от уровня ПСА, что также свидетельствует об участии ПСА в развитии и поддержании воспалительного процесса [18].</p>
<p class="x-text">R.D. Motrich и соавт. (2005) показали, что у больных хроническим неинфекционным простатитом выявляются высокие уровни ИФН-гамма-секретирующих лимфоцитов, пролиферирующих в ответ на собственные антигены простаты, такие как ПСА и простатическая кислая фосфатаза (prostatic acid phosphatase, PAP) [19]. Кроме того, у этих пациентов был отмечен высокий уровень провоспалительных цитокинов (ИЛ-1 и фактора некроза опухоли альфа) в семенной жидкости, что подтверждает наличие местного воспаления. Авторы предполагают, что ИФН-гамма-секретирующие лимфоциты могут быть вовлечены в воспалительный процесс в предстательной железе и, следовательно, могут менять свою биологическую функцию. Роль ПСА в воспалительном процессе подтверждалась и другими авторами. Так, J.A. Kodak и соавт. (2006) [20] показали, что ПСА индуцирует провоспалительную реакцию, что ведет к повышению секреции ИФН-гамма из NK-клеток (клеток-киллеров). Свое действие ПСА оказывает опосредованно, стимулируя CD14-моноциты, которые секретируют активирующий NK-клетки фактор. Таким образом, повышение уровня ПСА не только является показателем активности воспаления, но и стимулирует провоспалительную реакцию. По этой причине, регулируя активность ПСА, можно влиять на интенсивность воспалительного процесса в простате [7]. Препаратом, призванным воздействовать на воспаление в простате посредством изменения этой активности, является препарат Афала, созданный на основе релиз-активных антител к ПСА. Исследования и опыт клинического применения препарата подтвердили его патогенетическое действие на предстательную железу. Было выявлено противовоспалительное, противоотечное действие [21, 22], а также увеличение под действием препарата концентрации ионов цинка в ткани простаты [23]. Цинк является структурным компонентом биологических мембран, клеточных рецепторов и протеинов, принимает участие в синтезе тестостерона, гормона роста, инсулина и инсулиноподобного фактора роста (insulin-like growth factor, IGF) 1-го типа, секрета простаты, а также в сперматогенезе. Повышение концентрации цинка в ткани простаты приводит к стимуляции в ней метаболизма, нормализации секреторной функции и, как следствие, уменьшению выраженности асептического воспаления и отека. </p>
<p class="x-text">Согласно данным экспериментальных и клинических исследований, Афала уменьшает выраженность асептического воспаления в органе и степень отека (что выражается в уменьшении объема предстательной железы, дизурических явлений, в том числе обструктивной и ирритативной симптоматики, болевых симптомов и дискомфорта, вызванных простатитом), лейкоцитарную инфильтрацию, нормализует секреторную функцию (увеличивается количество лецитиновых зерен в секрете).</p>
<p class="x-podzag-"><b>Цель исследования</b></p>
<p class="x-text">Основной целью исследования являлось получение клинико-морфологического обоснования применения препарата Афала для лечения больных хроническим абактериальным простатитом. Исследование проводилось на базе поликлинического отделения консультативно-диагностического центра НИИ урологии и ЦНИЛ Первого МГМУ им. И.М. Сеченова. </p>
<p class="x-podzag-"><b>Материалы и методы</b></p>
<p class="x-text">В открытом сравнительном исследовании приняло участие 120 пациентов с диагностированным хроническим абактериальным простатитом в стадии обострения. Критериями включения были:</p>
<ul>
<li class="x-text-bull">повышение лейкоцитов в секрете простаты более 10 в поле зрения (при 400-кратном увеличении); </li>
<li class="x-text-bull">отсутствие инфекций, передающихся половым путем (на основании анализа соскоба из уретры методом полимеразной цепной реакции);</li>
<li class="x-text-bull">обязательное использование барьерных методов контрацепции (презерватива) при половых контактах; </li>
<li class="x-text-bull">количество бактериальной флоры в секрете простаты при бактериологическом исследовании менее 10³ КОЕ/мл. </li>
</ul>
<p class="x-text">Пациенты заполняли опросник по оценке симптомов хронического простатита, предложенный Национальным институтом здоровья США (National Institutes of Health – Chronic Prostatitis Symptom Index, NIH-CPSI). Все пациенты были тщательно обследованы. Мазок секрета предстательной железы для иммуноцитохимического исследования, полученный при массаже простаты, после фиксации метиловым спиртом окрашивали толуидиновым синим. Верификация мононуклеарных клеток проводилась с помощью определения антигенов кластеров дифференцировки моноклональными антителами с последующей окраской пероксидазой хрена. Выявление типа цитокина осуществляли также с помощью моноклональных антител и окраски пероксидазой хрена.</p>
<p class="x-text">Для изучения способности препарата Афала восстанавливать нарушенный баланс лимфоидных клеток как наиболее объективной характеристики состояния лимфоидной ткани, ассоциированной со слизистыми оболочками, при проведении иммуно-морфологического исследования секрета простаты устанавливалось содержание в секрете предстательной железы следующих субпопуляций лимфоцитов: </p>
<ul>
<li class="x-text-bull">CD4-хелперы, определяющие регулировку отдельных групп лимфоцитов;</li>
<li class="x-text-bull">CD8-супрессоры, определяющие балансировку функций активности между Т- и В-лимфоцитами;</li>
<li class="x-text-bull">CD16-киллеры, то есть клетки-убийцы, осуществляющие цитолиз;</li>
<li class="x-text-bull">CD32-лимфоциты, несущие рецепторы к ИЛ;</li>
<li class="x-text-bull">CD95-лимфоциты, стимулирующие апоптоз.</li>
</ul>
<p class="x-text">Анализировалось соотношение провоспалительных и антивоспалительных ИЛ, для чего определялся уровень ИЛ 1, 2, 4 и 5 типов. Для уточнения пролиферативной активности иммунокомпетентных клеток и клеток простаты в мазке секрета предстательной железы исследовались концентрации факторов роста (IGF, эпидермальный фактор роста (epidermal growth factor, EGF) и TGF-beta). Исследование проводилось дважды: при первичном обращении и после окончания курса лечения.</p>
<p class="x-text">Статистическую обработку материала проводили с помощью критерия Стьюдента и определения границ безошибочности суждения. </p>
<p class="x-text">Все пациенты были разделены на 2 группы. Пациентам основной группы (n = 60) для лечения обострения хронического простатита был назначен препарат Афала по 2 таблетки 4 раза в сутки в течение 30 дней. С этической точки зрения нельзя было оставлять пациентов с воспалением простаты без медицинской помощи в течение месяца. По этой причине пришлось отказаться от назначения пациентам контрольной группы (n = 60) плацебо, им проводилась трансректальная ультразвуковая терапия. Известно, что физические методы при лечении хронического простатита оказывают выраженное терапевтическое воздействие на симптоматику (улучшается кровоснабжение простаты, уменьшается ее отек и венозный стаз в органах малого таза) и непосредственно воспалительный процесс в ткани железы.</p>
<p class="x-podzag-"><b>Результаты исследования</b></p>
<p class="x-text">Клиническая эффективность определялась на основании изменений показателей опросника NIH-CPSI. При этом анализировались проявления боли, нарушения мочеиспускания и качество жизни (табл. 1, 2, 3). </p>
<p class="x-text">Анализ данных таблицы 1 показывает, что количество пациентов с болями различной локализации, характерных для хронического простатита, существенно уменьшилось на фоне приема препарата. Так, если боль в промежности в начале исследования испытывали 37 пациентов (61,7%), то после лечения число таких пациентов сократилось до 12 (20%). Такие же изменения прослеживаются в отношении жалоб на боли в яичках и боли внизу живота (рис. 1). Боли при мочеиспускании перестали испытывать 6 пациентов (10%), боли при семяизвержении – 18 (30%). Частота появления болей указанной локализации также уменьшилась. Так, количество пациентов, не испытывающих боли, возросло с 7 (11,7%) до 26 человек (43,3%), редко испытывающих боль – с 18 (30%) до 24 (40%) человек. Уменьшилось количество пациентов, испытывающих боли периодически, – с 25 (41,7%) до 9 (15%). Таким образом, применение препарата Афала значительно уменьшает выраженность симптомов боли (дискомфорта), характерных для хронического простатита.</p>
<p class="x-text">В контрольной группе также было зарегистрировано субъективное улучшение их самочувствия, однако менее выраженное. Боль в промежности перестали испытывать 4 человека, боли в мошонке и внизу живота прекратились у 3 и 10 человек соответственно. Сходная тенденция наблюдалась в уменьшении частоты болевых ощущений.</p>
<p class="x-text">Положительная динамика наблюдалась и в отношении расстройств мочеиспускания (табл. 2). Однако следует отметить, что изначально пациенты не предъявляли жалоб на выраженные дизурические расстройства. Тем не менее при сравнении результатов пациентов обеих групп видно, что редукция проявлений дизурии более выражена у пациентов основной группы.</p>
<p class="x-text">Устраняя боли и расстройства мочеиспускания, вызванные хроническим простатитом, препарат Афала влияет и на качество жизни этих пациентов. В таблице 3 приведены данные показатели опросника NIH-CPSI. Так, в основной группе возросло количество пациентов, у которых после курса приема препарата отмечено отсутствие влияния заболевания на повседневную активность. Более чем в два раза увеличилось число пациентов, которых не беспокоили симптомы хронического простатита (до лечения – 11 пациентов (18,3%), после лечения – 27 пациентов (45%)). Если в начале исследования симптомы хронического простатита в той или иной мере осложняли жизнь почти всем пациентам, то на последнем визите симптомы не оказывали значимого влияния на жизнь 23 больных (38,3%). Количество пациентов, оценивающих качество жизни как удовлетворительное, удвоилось (с 13 (21,7%) до 26 (43,3%) человек). Напротив, число пациентов, недовольных своей жизнью в связи с имеющимися симптомами хронического простатита, уменьшилось в целом с 45 (75%) до 10 (16,7%) человек. Таким образом, после месячного курса приема препарата Афала выявлено существенное улучшение качества жизни больных хроническим простатитом (по результатам опросника NIH-CPSI) (рис. 2).</p>
<p class="x-text">Результаты иммуногистохимического исследования секрета предстательной железы могут служить объяснением субъективного улучшения самочувствия пациентов основной группы, демонстрируя выраженное влияние препарата на воспалительный процесс. </p>
<p class="x-text">Первый исследуемый показатель – концентрация клеток крови (мононуклеаров), определяющих выраженность и активность воспалительного компонента, а также уровень стимуляции репаративной регенерации, или, другими словами, способность к заживлению после вызванного различными факторами повреждения, являющегося основой для развития воспалительной реакции (табл. 4).</p>
<p class="x-text">Данные цитологического исследования свидетельствуют о существенном снижении содержания полиморфноядерных лейкоцитов (с 26,20 ± 0,09 до 7,13 ± 0,11 в поле зрения). Это говорит об уменьшении интенсивности альтеративных процессов (процессов повреждения), поскольку чем больше повреждение, тем выше концентрация полиморфноядерных лейкоцитов в секрете простаты (рис. 3). При этом причины возникновения процессов альтерации могут быть самыми разнообразными: от бактериальной инвазии до функционального перенапряжения. Таким образом, применение препарата уменьшает выраженность асептического (неинфекционного) воспаления в простате.</p>
<p class="x-text">Эритроцитов в секрете простаты обнаружено не было. Это является несомненно положительным фактором, поскольку наличие эритроцитов может указывать на выраженные некротические процессы, развивающиеся в ткани простаты и сопровождающиеся кровотечением различной степени. Кроме того, наличие эритроцитов в секрете простаты является одним из существенных косвенных признаков неопластического процесса в органе, и в этом случае пациент должен быть исключен из протокола исследования.</p>
<p class="x-text">Любой воспалительный процесс проходит в своем развитии ряд стадий: альтеративную – фазу повреждения клеток и тканей, экссудативную – фазу сосудистой реакции на повреждение, характеризующуюся выходом жидкости и клеток крови из сосудов в ткани, и пролиферативную (или продуктивную) стадию, во время которой происходит размножение клеток и разрастание ткани с последующим восстановлением ее целостности, то есть заживление или репарация.</p>
<p class="x-text">При хроническом воспалении организм не способен перейти от фазы сосудистой реакции к фазе заживления. Центральным звеном заживления является лимфоидная система (лимфоидная ткань, ассоциированная со слизистыми оболочками), имеющая набор лимфоцитов с различными функциональными свойствами. Дисбаланс субпопуляций лимфоцитов приводит к задержке фазы заживления, то есть к хронизации простатита и развитию периодически возникающих обострений воспалительного процесса в предстательной железе. В этой связи показательна динамика различных субпопуляций лимфоцитов у пациентов, применявших препарат Афала. После курса лечения количество лимфоцитов несколько увеличивается (с 78,40 ± 0,83 до 82,43 ± 0,83 в поле зрения). Для того чтобы понять причины роста лимфоцитов, рассмотрим изменения численности субпопуляций лимфоцитов в основной группе (табл. 5).</p>
<p class="x-text">Количество хелперов (CD4) увеличилось незначительно (с 48,97 ± 0,04 до 52,19 ± 0,09 в поле зрения), однако отмеченная тенденция достаточно выражена. По всей видимости, рост обусловлен снижением активации цитокиновой регуляции, которая, в свою очередь, связана со снижением выраженности альтеративных изменений.</p>
<p class="x-text">Вместе с тем отмечается некоторое снижение содержания Т-супрессоров (CD8) (с 24,40 ± 0,02 до 20,96 ± 0,03 в поле зрения). Очевидно, что возникает повышенная необходимость регуляторных взаимоотношений между Т-хелперами и эффекторными клетками – натуральными киллерами CD16. Еще одним фактором, способствующим повышению концентрации супрессорных клеток, является подавление воспалительной реакции. Это подавление необходимо в связи со снижением степени альтерации.</p>
<p class="x-text">Изменение соотношения CD4/CD8, то есть нормализация хелперно-супрессорного коэффициента, значение которого – 2,49 ± 0,06 – приближается к оптимальному, объективно подтверждает развитие противовоспалительной реакции. В то же время в контрольной группе динамика этих показателей менее выражена. </p>
<p class="x-text">В основной группе изменение концентрации естественных киллеров (CD16) – эффекторных клеток с 13,35 ± 0,01 до 9,36 ± 0,09 указывает на уменьшение агрессивности инфильтрата, в то время как в контрольной группе эти показатели практически не изменились. </p>
<p class="x-text">Некоторое уменьшение концентрации CD32 (миеломоноцитарного дифференцировочного антигена) в основной группе обусловлено не только снижением эффективности ангиогенеза, но и менее выраженной необходимостью в трансэндотелиальной миграции лейкоцитов.</p>
<p class="x-text">CD95 является фактором, опосредующим сигнал к апоптозу. Апоптоз, запрограммированная гибель клетки, отражает процесс двоякого рода. С одной стороны, апоптоз – это защитная реакция организма (наряду с функционированием иммунной системы и системы ИФН), необходимая для выведения из организма старых, трансформированных и поврежденных клеточных элементов, которые могут быть потенциально опасны для многоклеточного организма при их персистенции. Иммунокомпетентные клетки, выполнившие свою функцию, также выводятся из очага воспаления, что предотвращает развитие вторичных альтеративных изменений, то есть дальнейшее повреждение клеток и тканей, вплоть до аутоиммунных реакций. С одной стороны, в результате апоптоза происходит стимуляция пролиферативной активности сохранных клеток (рис. 4). С другой – повышение концентрации CD95 в группе, принимавшей препарат Афала (с 4,51 ± 0,07 до 9,60 ± 0,02, что в 2,13 раза выше показателей в группе контроля), свидетельствует о тенденции нарастания стимуляции репаративной регенерации (рис. 5).</p>
<p class="x-text">Вторая группа показателей, которые изучались в исследовании, характеризует уровни различных цитокинов (ИЛ и факторов роста), участвующих в воспалительном ответе. Воспалительный ответ может формироваться либо по гуморальному (антивоспалительный вариант развития тканевой реакции), либо по клеточному пути (провоспалительный вариант тканевой реакции). В первом случае воспалительный инфильтрат носит диффузный характер, во втором – очаговый (гранулематозный).</p>
<p class="x-text">ИЛ, названные лимфокинами за способность стимулировать и ингибировать размножение и дифференцировку лимфоцитов на разных этапах иммунной реакции, непосредственно влияют на ее направленность. Оценка всего комплекса ИЛ (1, 2, 4, 5 тип) (табл. 6) свидетельствует о стабилизации процесса без выраженной тенденции к смещению в сторону провоспалительных или антивоспалительных реакций.</p>
<p class="x-text">Анализ ИЛ в секрете предстательной железы пациентов контрольной группы, которым проведена ультразвуковая терапия, говорит о трансформации реакции из преимущественно антивоспалительной в провоспалительную. Это свидетельствует о переходе преимущественно диффузного воспаления в очаговое (гранулематозное), характеризующееся пролиферацией и трансформацией способных к фагоцитозу клеток и образованием с их участием узелков (гранулем). Характерная разность изменения динамических показателей в обеих группах представлена на рисунке 6.</p>
<p class="x-text">Поскольку одним из этиопатогенетических механизмов развития воспалительного процесса в предстательной железе являются аберрации пептидных факторов роста, мы включили их в список определяемых при иммуногистохимическом исследовании параметров (табл. 7). Динамика величин факторов роста (IGF, EGF, TGF-beta) после курса лечения препаратом Афала свидетельствует о нескольких тенденциях. Прежде всего, уменьшение концентрации IGF подтверждает снижение стимуляции пролиферативной активности лимфоидных элементов. Данный цитокин относится к группе соматомединов (проводников биологического действия соматотропного гормона, гормона роста), которые оказывают на мышечную ткань рост-стимулирующее и инсулиноподобное (ускорение синтеза белка и замедление его разрушения) действия, а также способствуют расщеплению жиров. Учитывая указанные функции соматомединов, можно с большой долей вероятности предположить, что динамика уровня IGF свидетельствует о стимуляции репарации гладкомышечных структур (миофибриллярной стромы простаты), то есть восстановлении целостности ткани в рамках третьей стадии воспалительного процесса после перенесенного повреждения.</p>
<p class="x-text">EGF стимулирует пролиферацию эпителиальных клеток, поэтому повышение концентрации EGF в секрете простаты больных основной группы свидетельствует о том, что эпителиальные структуры отвечают незначительным изменением пролиферативной активности. Повышение концентрации TGF-beta (с 32,70 ± 0,06 нг/мл перед применением препарата до 42,06 ± 0,04 нг/мл после) говорит о выраженной возрастающей стимуляции дифференцировки пролиферирующих структур.</p>
<p class="x-text">Сравнение показателей нейроэндокринной регуляции в ткани предстательной железы при хроническом простатите под влиянием ультразвукового воздействия (контрольная группа) показывает, что основные показатели имеют противоположную тенденцию: уменьшается уровень EGF и TGF-beta и увеличивается уровень IGF (рис. 7).</p>
<p class="x-text">Помимо позитивной клинической динамики, достоверно улучшились иммуногистохимические показатели в группе пациентов, принимавших препарат, по сравнению с контрольной группой. Анализ иммуногистохимических показателей секрета предстательной железы у больных хроническим простатитом до и после терапии препаратом Афала выявил:</p>
<ul>
<li class="x-text-bull">статистически значимое изменение уровня цитокинов, свидетельствующее о стабилизации процесса;</li>
<li class="x-text-bull">уменьшение значений поглотительной способности нейтрофилов и миграционной активности моноцитов; </li>
<li class="x-text-bull">стимуляцию регуляторных функций лимфоидной ткани, ассоциированной со слизистыми оболочками; </li>
<li class="x-text-bull">стимуляцию зрелости клеточных элементов;</li>
<li class="x-text-bull">нормализацию хелперно-супрессорного коэффициента.</li>
</ul>
<p class="x-text">Морфологический анализ также подтверждает стабилизацию мукозального иммунитета и ингибирование медиаторов воспаления (рис. 8). Таким образом, полученные данные указывают на патогенетический механизм действия препарата Афала при хроническом простатите.</p>
<p class="x-text">По результатам проведенного клинического исследования эффективности препарата Афала (антител к ПСА аффинно очищенных) можно сделать следующие выводы:</p>
<p class="x-text">1. Применение препарата Афала уменьшает выраженность симптоматики хронического простатита, в первую очередь дискомфорта (боли) (по данным опросника NIH-CPSI). </p>
<p class="x-text">2. Применение препарата Афала приводит к существенному улучшению качества жизни больных хроническим простатитом (по данным опросника NIH-CPSI) при обострении воспалительного процесса.</p>
<p class="x-text">3. Применение препарата Афала вызывает усиление факторов местного (мукозального) иммунитета и уменьшение агрессивности воспалительного инфильтрата. </p>
<p class="x-podzag-"><b>Заключение</b></p>
<p class="x-text">Препарат Афала эффективен у пациентов с болевым синдромом, вызванным хроническим простатитом, что еще раз было подтверждено в данном клинико-морфологическом исследовании. Препарат Афала может эффективно применяться как патогенетическое средство базовой терапии обострений хронического абактериального (в качестве монотерапии) и бактериального простатита (вместе с традиционными препаратами) для уменьшения степени воспалительного процесса, болевого синдрома, ирритативной и обструктивной симптоматики и ускорения регенерации ткани простаты. </p>
</div>
1. Ding X.G., Li S.W., Zheng X.M. et al. IFN-gamma and TGF-beta1, levels in the expressed prostatic secretions of patients with chronic abacterial prostatitis // Zhonghua Nan Ke Xue. 2006. Vol. 12. № 11. P. 982–984.
2. Alexander R.В., Ponniah S., Hasday J. et al. Elevated levels of proinflammatory cytokines in the semen of patients with chronic prostatitis/chronic pelvic pain sydrome // Urology. 1998. Vol. 52. № 5. P. 744–749.
3. Miller L.J., Fischer K.A., Goralnick S.J. et al. Interleukin-10 levels in seminal plasma: implications for chronic prostatitis-chronic pelvic pain syndrome // J. Urol. 2002. Vol. 167. № 2. Pt. 1. P. 753–756.
4. Miller L.J., Fischer K.A., Goralnick S.J. et al. Nerve growth factor and chronic prostatitis/chronic pelvic pain syndrome // Urology. 2002. Vol. 59. № 4. P. 603–608.
5. Nadler R.В., Koch A.E., Calhoun E.A. et al. IL-l and TNF-alpha in prostatic secretions are indicators in the evaluation of men with chronic prostatitis // J. Urol. 2000. Vol. 164. № 1. P. 214–218.
6. Jang T.L., Schaeffer A.J. The role of cytokines in prostatitis // World J. Urol. 2003. Vol. 21. № 2. P. 95–99.
7. Kramer G., Marberger M. Could inflammation be a key component in the progression of benign prostatic hyperplasia? // Curr. Opin. Urol. 2006. Vol. 16. № 1. P. 25–29.
8. Liu H.H., Xia X.Y., Wu Y.M. et al. Detection of peripheral blood Th1/Th2 cell ratio in patients with chronic abacterial prostatitis/chronic pelvic pain syndrome // Zhonghua Nan Ke Xue. 2006. Vol. 12. № 4. P. 330–332, 336.
9. Данилец М.Г. Фармакологическая регуляция функционального состояния макрофагов при иммунном ответе: автореф. дис. … д-ра биол. наук. Томск, 2011.
10. Martinez F.O., Sica A., Mantovani A. et al. Macrophage activation and polarization // Front. Biosci. 2008. Vol. 13. P. 453–461.
11. Fan Z., Zhong H. Progress in studies of male infertility resulting from chronic prostatitis // Zhonghua Nan Ke Xue. 2004. Vol. 10. № 6. P. 461–464.
12. Тотолян А.А., Аль-Шукри С.Х., Козлов В.В. и др. Диагностическая значимость определения интерлейкина-8 при хроническом простатите // Урология. 2001. № 6. С. 6–8.
13. Catalona W.J., Smith D.S., Ratliff T.L. et al. Мeasurement of prostate-specific antigen in serum as a screening test for prostate cancer // N. Engl. J. Med. 1991. Vol. 324. № 17. P. 1156–1161.
14. Яковец Е.А. Роль регулятора активности инсулиноподобного фактора роста в комплексной терапии ДГП // Современные вопросы урологии, андрологии и репродуктивной медицины: материалы 7-й Международной конференции. Новосибирск, 2008. С. 348–351.
15. Takayama T.K., Vessella R.L., Lange P.H. Newer applications of serum prostate-specific antigen in the management of prostate cancer // Semin. Oncol. 1994. Vol. 21. № 5. P. 542–553.
16. Keetch D.W., McMurtry J.M., Smith D.S. et al. Prostate specific antigen density versus prostate specific antigen slope as predictors of prostate cancer in men with initially negative prostatic biopsies // J. Urol. 1996. Vol. 156. № 2. Pt. 1. P. 428–431.
17. Шангичев А.В. Состояние ферментной антиоксидантной системы крови, секрета простаты и эякулята при стандартном лечении хронического абактериального простатита // Вестник Российского университета дружбы народов. 2009. № 3. С. 71–75.
18. Penna G., Mondaini N., Amuchastegui S. et al. Seminal plasma cytokines and chemokines in prostate inflammation: interleukin 8 as a predictive biomarker in chronic prostatitis/chronic pelvic pain syndrome and benign prostatic hyperplasia // Eur. Urol. 2007. Vol. 51. № 2. P. 524–533.
19. Motrich R.D., Maccioni M., Molina R. et al. Presence of INF-gamma-secreting lymphocytes specific to prostate antigens in a group of chronic prostatitis patients // Clin. Immunol. 2005. Vol. 116. № 2. P. 149–157.
20. Kodak J.A., Mann D.L., Klyushnenkova E.N. et al. Activation of innate immunity by prostate specific antigen (PSA) // Prostate. 2006. Vol. 66. № 15. P. 1592–1599.
21. Ткачук В.Н. Лечение больных хроническим абактериальным простатитом // Лечащий врач. 2008. № 1. С. 76–77.
22. Кульчавеня Е.В. Эффективность Афалы в комплексном лечении больных хроническим простатитом // Врачебное сословие. 2007. № 5. С. 20–23.
23. Боровская Т.Г., Фомина Т.И., Лоскутова О.П. и др. Антитела к простатспецифическому антигену в сверхмалых дозах: влияние на морфологическое и функциональное состояние предстательной железы крыс // Бюллетень экспериментальной и биологической медицины. 2002. Приложение 4. С. 104–106.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.