Иммуномодуляторы в терапии часто болеющих детей
- Аннотация
- Статья
- Ссылки
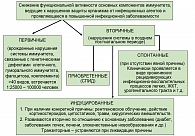



В клинической практике принято различать первичные и вторичные иммунодефициты (см. рисунок) (1). Первичные иммунодефициты (ПИД) – врожденные нарушения системы иммунитета, связанные с генетическими дефектами одного или нескольких ее компонентов, а именно клеточного, гуморального, фагоцитоза, комплемента и т. д. В настоящее время идентифицированы многие десятки врожденных дефектов системы иммунитета. Очевидно, что действительное число ПИД значительно больше. ПИД являются довольно редкими заболеваниями, частота их встречаемости соответствует 1 случаю на 23 000-100 000 человек. Исключением является селективный иммунодефицит IgA, встречающийся с частотой 1 на 500-700. Как правило, пациенты с подозрением на ПИД обследуются и лечатся в специализированных лечебных учреждениях. Лечение осуществляется за счет пожизненного применения иммунозаместительной терапии в комбинации с антибиотиками или без них.
Вторичные иммунодефициты (ВтИД) – нарушения системы иммунитета, которые развиваются в позднем постнатальном периоде и не являются результатом какого-либо генетического дефекта. Принято выделять три формы ВтИД: приобретенную, индуцированную и спонтанную. Наиболее ярким примером приобретенной формы является синдром приобретенного ИД (СПИД). Индуцированные ВтИД – это состояния, вызванные конкретной причиной: рентгеновским облучением, действием кортикостероидов, цитостатиков, травмой, хирургическим вмешательством, а также нарушения иммунитета, которые развиваются вторично по отношению к основному заболеванию (диабет, заболевания печени и почек, злокачественные новообразования и пр.). Индуцированные формы ВтИД, как правило, являются транзиторными, и при устранении вызвавшей их причины во многих случаях происходит полное восстановление функции системного иммунитета. В отличие от индуцированной, спонтанная форма ВтИД характеризуется отсутствием явной причины, вызвавшей нарушения иммунологической реактивности. Клинически эта форма проявляется в виде хронических рецидивирующих инфекционно-воспалительных процессов бронхолегочного аппарата, урогенитальной системы, желудочно-кишечного тракта, глаз, кожи, мягких тканей, вызванных условно-патогенными микроорганизмами и различными вирусами. По распространенности спонтанная форма является доминирующей среди других форм ВтИД (2).
Оценка системы иммунитета при таких процессах нередко бывает затруднительной. Это связано, во-первых, с трудностью выяснения, что является причиной, а что – следствием (нарушения системы иммунитета обусловили возникновение заболевания или возникшее заболевание привело к изменениям иммунологических показателей); во-вторых, с получением адекватного данному состоянию материала для исследования (1, 3). Несмотря на очевидные достижения иммунологии, методические возможности иногда остаются весьма ограниченными. Поэтому набор стереотипных методов исследования, используемых в клинической иммунологии, далеко не всегда может удовлетворить потребности клинической медицины. Видимо, с этим связано то, что клинически отчетливые признаки нарушения системы иммунитета в ряде случаев не подтверждаются результатами иммунологического обследования. Вышеизложенное служит дополнительным обоснованием того положения, что ВтИД является, прежде всего, клиническим понятием и проявляется хроническими рецидивирующими, вялотекущими и трудно поддающимися обычному лечению инфекционно-воспалительными процессами, порой выявляемыми вне зависимости от изменений иммунологических показателей.
В педиатрической практике следует различать наличие вторичного ИД и изменения в системе иммунитета, классифицируемые как «поздно стартующий ребенок» (4). Исследования показали, что иммунная система у детей подвержена онтогенетической последовательности «созревания» различных иммунных факторов. В основном становление системы иммунитета завершается к 12-14 годам, и к этому возрасту количественные и функциональные характеристики иммунитета соответствуют показателям взрослых лиц. Поэтому детей со сниженными уровнями показателей иммунитета без клинических проявлений вторичной иммунной недостаточности следует наблюдать и проводить динамическое мониторирование иммунного статуса.
Современная стратегия использования иммунотропных препаратов у детей без оценки иммунного статуса предусматривает их применение исключительно в профилактических целях:
- при эпидемиологически неблагоприятной ситуации по какому-либо инфекционному заболеванию;
- перед проведением хирургического вмешательства;
- у больных СПИДом и ВИЧ-инфицированных;
- при тяжелых онкологических заболеваниях (19).
Обязательное назначение иммуномодулирующей терапии следует проводить при длительно протекающих и часто рецидивирующих инфекционных процессах с выявленными иммунными нарушениями. У часто болеющих детей (ЧБД) необходимо исключать такие заболевания как первичная иммунологическая недостаточность, цилиарная недостаточность, пороки развития легких и бронхов, рецидивирующий бронхит, бронхоэктатическая болезнь, гельминтозы, сахарный диабет, муковисцидоз, респираторная аллергия, ЛОР-патология, пороки сердца.
Постановка достоверного клинического диагноза является основным принципом для проведения рациональной иммуномодулирующей терапии. Поэтому необходимо различать как эндогенные и экзогенные факторы, приводящие к частой заболеваемости, так и выявленную нозологическую форму болезни. Кроме того, использование иммуномодулирующей терапии у ЧБД в большинстве случаев должно проводиться в комплексе с антибиотиками, противовирусными и противогрибковыми препаратами.
Особенностью проведения иммуномодулирующей терапии следует считать цикличность (многоступенчатость) проведения ее курсов, а также сочетание с немедикаментозными методами иммунореабилитации (курортными и физиотерапевтическими). Количество циклов определяется выраженностью клинических проявлений и степенью иммунных нарушений и может колебаться от 2-3 до 5-6 и более, длительность сочетанной амбулаторно-санаторной помощи составляет не менее трех лет.
Проведение иммуномодулирующей терапии у детей основано на осуществлении принципов этапности, непрерывности и преемственности ведения больного. Предусматривается последовательное и непрерывное введение иммунотропного средства на всех этапах комплексного лечения больного ребенка: стационар – амбулаторная помощь – санаторий до полного восстановления показателей и функций всех звеньев иммунитета.
Иммуномодулирующая терапия должна основываться на индивидуальном подборе и последовательности ее использования. Оптимальным считается применение методов и препаратов, обладающих одной направленностью, но имеющих различные механизмы действия.
Иммуномодуляторы принято различать по их происхождению (таблица 1) (5). Наибольшее распространение в педиатрии нашли иммуномодуляторы микробного и растительного происхождения, интерфероны и их индукторы, а также иммуноглобулины для внутривенного введения (3, 4, 5).
Исследования последних лет показали, что в ротоглоточном сегменте у детей из группы ЧДБ выявляются возбудители: Str. pneumoniae (25-30%), H. influenzae (15-20%), M. catarralis (15-20%), Str. pyogenes (2-5%), представители грамотрицательной микрофлоры, персистенция различных вирусов (7, 8, 9). Все это послужило основанием для использования бактериальных лизатов с целью увеличения продукции специфических антител, а также стимуляции неспецифических факторов защиты (секреторных IgA, цитокинов, NK-клеток, клеток макрофагально-фагоцитарной системы и др.) (12). Пирогенал и Продигиозан сменили такие препараты, как Бронхо-Мунал, рибомунил, ИРС-19 и имудон, различающиеся по составу и механизмам действия. Принято различать бактриальные лизаты системного (Бронхо-Мунал, рибомунил) и местного (ИРС-19, имудон) действия (15).
Многочисленными исследованиями установлено, что применение ИРС-19 и имудона у детей с рецидивирующими риносинуситами, трахеобронхитами, аденоидитами позволяет нормализовать систему мукозального иммунитета слизистых оболочек верхних дыхательных путей, носа, околоносовых пазух и глотки и повысить устойчивость к вирусным и другим инфекциям, снижая вероятность развития бактериальных осложнений (17). Среди отоларингологов сформировалось мнение, что данные местные иммуномодуляторы являются эффективными препаратами в профилактике частых ОРВИ (18). Вместе с тем данные экспериментальных работ свидетельствуют о том, что в ряде случаев недостаточное воздействие местных иммуномодуляторов может быть связано со следующими причинами: время контакта препаратов со слизистыми коротко, слизистые оболочки захватывают незначительную часть антигенных субстанций, так как время воздействия недостаточное, ротоглоточный сегмент является частью пищеварительного тракта, поэтому здесь не функционирует реснитчатый эпителий, слюна постоянно омывает эту область, мешая постоянному контакту препарата с клетками; отсутствуют данные о времени воздействия местных бактериальных лизатов (19). Такие же результаты были получены в отношении местной терапии антибиотиками, которые подтверждают эффективность использования антибиотиков для местной терапии только для лечения отитов. Поэтому наибольшее распространение в педиатрической практике получили бактериальные лизаты системного действия (13, 14). Хороший эффект получен при применении Бронхо-Мунала. С учетом однонаправленности действия местных и системных бактериальных лизатов естественно ставить вопрос о возможности их совместного применения. Такой опыт есть (14 ,15), однако, в связи с неоднозначностью полученных результатов, исследования в этом направлении следует расширить.
В настоящее время сложилась ситуация, свидетельствующая о неоправданно широком использовании антибиотиков у часто болеющих детей, что приводит к дисбиотическим реакциям ротоглоточного сегмента, а в некоторых случаях и полному отсутствию облигатной микрофлоры. В свете этих данных уместно высказать гипотезу о том, что бактериальные лизаты возмещают недостаток стимуляции, связанной с бактериальной инфекцией, и оказывают положительное адаптогенное воздействие на иммунную систему (16, 17).
С возрастом у детей появляются антитела все к большему числу вирусов, что приводит к снижению инфекционной заболеваемости (18). Не уменьшая значимости вакцинации, для профилактики ОРЗ используются растительные адаптогены (Иммунал, Иммунап, Иммунорм), а также препараты интерферона (Виферон, Гриппферон) и его индукторы (Арбидол, Амиксин). Клинические исследования показали, что использование этих иммуномодуляторов эффективно также в остром периоде ОРВИ, но не позже чем в первые 24 часа заболевания (до момента попадания вируса в клетку), при этом уменьшается выраженность клинических проявлений и более быстрое обратное развитие заболевания (4). У пациентов с аллергией имело место переключение иммунного ответа на Th1-ответ (3, 6, 10). Очевидно, этот результат основан на более выраженной модуляции различных иммунологических механизмов, что более физиологично и лишено излишней агрессии.
Максимально оправданным у часто болеющих острыми респираторно-вирусными инфекциями следует считать использование иммуномодуляторов растительного происхождения, основой которых является сок травы Echinacea. Широкое применение иммунала как препарата Echinacea в педиатрии базируется на данных экспериментальных работ, в которых была доказана возможность препарата стимулировать процессы фагоцитоза, антигензависимую пролиферацию Т-лимфоцитов, увеличивать синтез TNF-α, пропердина, интерферона-α, -β и т.д. (11). Доказано противомикробное действие иммунала в отношении ряда возбудителей (Escherichia coli, Proteus mirabilis, Pseudomonas aeruginosa, Staphilococcus aureus) и различных вирусов (герпес, цитомегаловирус, вирус Эпштейн–Барра и др.) (1). С учетом адаптогенной направленности действия препаратов на основе Echinacea в отношении факторов иммунной системы, то есть сбалансированного, приближенного к физиологическому, комплексного (таблица 2), затрагивающего практически все эффекторные иммунологические механизмы и лишенного побочных эффектов, Иммунал используется в большей степени как профилактическое средство. Доказанной эффективностью Иммунала является сокращение сроков течения респираторно-вирусных заболеваний, уменьшение интоксикации и лихорадки (11). Кроме того, иммуномодулирующая терапия с использованием препаратов Echinacea позволяет снизить частоту бактериальных осложнений ОРВИ (14). Снижение частоты ОРВИ было зафиксировано при применении Иммунала у больных с заболеваниями кожи (экзема, псориаз), инфекций мочевыводящей системы, аутоиммунных и других заболеваний (15). Очевидно, этот результат основан на способности растительных иммуномодуляторов вызывать неспецифический ответ по отношению к различным респираторным вирусам (6, 10). Скорее всего, имеет значение увеличение синтеза интерферонов, как факторов противовирусного иммунитета, и интенсификация фагоцитарных реакций.
Результаты применения Иммунала у пациентов с аллергическими заболеваниями:
профилактическое использование иммунала у больных с аллергическими заболеваниями позволило снизить заболеваемость ОРВИ в 1,4 раза;
- при применении Иммунала уменьшилась длительность ОРВИ на 2 дня;
- на фоне применения Иммунала уменьшилась выраженность симптомов интоксикации;
- иммуномодулирующий эффект иммунала проявлялся в увеличении фагоцитарной активности нейтрофилов и цитокинов (таблица 3);
- применение иммунала позволило снизить развитие бактериальных осложнений в 1,2 раза, а также использование антибактериальных препаратов.
В настоящее время общепризнано, что ведущая роль в противовирусной защите организма принадлежит системе интерферона, которая способна подавлять множество РНК- и ДНК-содержащих вирусов вследствие ингибирования процессов транскрипции и трансляции вирусных матриц. Интерфероны оказывают действие на все клетки иммунной системы, формируют защитный барьер, стимулируют клеточную резистентность. На первых этапах иммунного ответа интерферон-α и ФНО активируют NК-клетки, которые стимулируют продукцию интерферона-γ задолго до начала его синтеза Т-лимфоцитами.
Интерфероны и индукторы интерферона представлены широким классом лекарственных средств, активно используемых в профилактике и терапии респираторных инфекций. К ним относятся лейкоцитарный интерферон, выделенный из донорской крови человека, Виферон, Гриппферон, Арбидол, Амиксин, Циклоферон. Эффективными индукторами интерферона являются нуклеиновые кислоты и их различные производные. Среди препаратов с противовирусным действием выделяют также Анаферон и Афлубин (8).
Гриппферон (рекомбинантный интерферон-α-2) выпускается в виде капель в нос – эффективный и безопасный препарат для профилактики и лечения острых респираторных вирусных инфекций (ОРЗ, ОРВИ) и гриппа. Он разрешен к применению даже детям до года, включая новорожденных. Наиболее эффективно назначение препарата в первые 3 дня заболевания гриппом и другими острыми респираторными инфекциями. При первых признаках заболевания гриппом, ОРВИ Гриппферон закапывают в нос в течение 5 дней: в возрасте от 0 до 1 года – по 1 капле в каждый носовой ход 5 раз в день, в возрасте от 1 до 3 лет – по 2 капли в каждый носовой ход 3 раза в день, в возрасте от 3 до 14 лет – по 2 капли в каждый носовой ход 4 раза в день.
Для профилактики препарат закапывают в возрастной дозировке 1-2 раза в день на протяжении контакта с больным. При необходимости профилактические курсы повторяют. Использование Гриппферона сопровождалось у большинства детей увеличением содержания секреторного IgA в носовых секретах и повышением уровня индуцированных интерферонов-α и -γ в сыворотке крови. Отмечена более быстрая элиминация возбудителя из носовых ходов обследованных пациентов и достоверное снижение частоты возникновения внутрибольничных инфекций, однако была установлена меньшая эффективность препарата в случаях аденовирусной инфекции.
Арбидол – этилового эфира 6-бром-5-гидрокси-1-метил-4-диметиламинометил -2-фенилметиллинодол-3-карбоновой кислоты гидрохлорида моногидрат. Арбидол терапевтически эффективен у болеющих гриппом и другими острыми вирусными респираторными заболеваниями. Это позволяет использовать данный препарат в амбулаторных условиях без лабораторной верификации диагноза. Препарат применяется на ранних сроках заболевания – не позже чем в первые 3 дня от начала болезни. Причем эффективность терапии во многом определяет возможность приема препарата в первые 6 часов заболевания. Арбидол назначают пациентам старше 6 лет по 50 мг (1 таблетка) 3 раза в день, в течение 3-4 дней.
Амиксин – 2,7-бис(этиламино)этоксифлуорена-9-дигидрохлорид. Изучение профилактической эффективности амиксина в отношении острой респираторной вирусной инфекции в период сезонного подъема заболеваемости показало снижение заболеваемости среди медицинских работников в 1,5 раза. Получены данные по благоприятному влиянию амиксина на течение ОРВИ у лиц, страдающих аллергическими заболеваниями, в частности бронхиальной астмой.
Циклоферон (активное вещество – акридонуксусная кислота в виде метилглюкаминовой соли) обладает противовирусным, иммуномодулирующим, противовоспалительным действием. Выпускается в таблетках и растворе для парентерального применения. Используется в первые дни заболевания гриппом и ОРВИ.
Анаферон принадлежит к новому классу лекарственных препаратов, созданных на основе сверхмалых доз антител. Действующим веществом Анаферона являются антитела к интерферону-γ человека в сверхмалых дозах. Препарат используют с 6-месячного возраста для профилактики и лечения гриппа, а также других ОРВИ по 1 таблетке 1 раз в день в течение 30-90 дней. Результаты проведенных исследований показали профилактическую эффективность препарата в период эпидемического подъема заболеваемости острыми респираторными вирусными инфекциями, а также восстановление нарушенного микробиоценоза ротоглотки, благоприятное влияние на показатели гуморального и клеточного иммунитета.
Виферон – человеческий рекомбинантный интерферон-α-2b. Выпускается в дозах 150 тыс. МЕ, 500 тыс. МЕ, 1 млн МЕ в виде мази для наружного применения и суппозиториев для ректального использования. Препарат показан для профилактики и лечения острых респираторных инфекций. Доза подбирается по возрасту.
Афлубин – комплексный гомеопатический препарат, оказывающее противовоспалительное, иммуномодулирующее, жаропонижающее действие. Афлубин показал высокую эффективность при плановой профилактике по защите учащихся общеобразовательных школ от гриппа и ОРВИ. Показана его выраженная противовирусная активность в исследованиях in vitro.Антивирусная активность афлубина была сопоставима с известными противовирусными препаратами и индукторами интерферона химического происхождения. Клинические исследования показали, что использование этих иммуномодуляторов эффективно также в остром периоде ОРВИ, но не позже чем в первые 24 часа заболевания (до момента попадания вируса в клетку). При этом уменьшается выраженность клинических проявлений и более быстрое обратное развитие заболевания.
Таким образом, проблема эффективного использования иммуномодулирующей терапии остается крайне актуальной. Совместные усилия клинических иммунологов и педиатров должны быть направлены на снижение неоправданных назначений иммунотропных средств, так как последствия этих назначений по тяжести осложнений и побочных эффектов могут превосходить тяжесть самого заболевания. Заслуживает внимания накопленный опыт использования бактериальных лизатов, восполняющих недостаток физиологической иммуностимуляции. Перспективно применение растительных адаптогенов, а также препаратов интерферона и его индукторов как с профилактической, так и с лечебной целями. Думается, что у иммуномодулирующей терапии большое будущее, в основном за счет повышения специфичности и точечной адресной направленности ее воздействия.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.