Ингибиторы пролилгидроксилазы индуцируемого гипоксией фактора в лечении анемии больных с хронической болезнью почек
- Аннотация
- Статья
- Ссылки
- English
![Рис. 2. Механизм действия ингибиторов пролилгидроксилазы индуцируемого гипоксией фактора (HIF-PHI) (адаптировано из [46])](/upload/resize_cache/iblock/63c/195_350_1/Gorelova4.jpg)
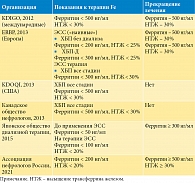
Хроническая болезнь почек (ХБП) стала глобальной проблемой общественного здравоохранения, от которой страдают более 10% населения в мире [1–3]. Анемия является наиболее частым осложнением ХБП. Наличие анемии у пациентов с ХБП связано с повышенным риском госпитализации, когнитивных нарушений, снижения качества жизни и серьезных сердечно-сосудистых событий. Кроме того, тяжесть анемии является независимым предиктором смертности [3–6]. Распространенность анемии при ХБП резко возрастает по мере снижения скорости клубочковой фильтрации (СКФ). При снижении СКФ с 60–90 до уровня ниже 20 мл/мин/1,73 м2 распространенность анемии увеличивается с 8 до 41% [7]. Анемия встречается примерно у половины пациентов с ХБП четвертой стадии и более чем у 90% пациентов с терминальной стадией почечной недостаточности, находящихся на диализе [8–10]. Основным механизмом развития почечной анемии является сочетание неадекватного синтеза эритропоэтина (ЭПО) и резистентности к ЭПО [11]. Другие факторы способствуют появлению как абсолютного, так и функционального дефицита железа, хронического воспаления, задержке уремических токсинов, нарушению гомеостаза железа, укороченной продолжительности жизни эритроцитов и дефициту витаминов (витамина B12 или фолиевой кислоты) [11, 12]. Более того, сам гемодиализ может способствовать кровопотере и повреждению эритроцитов [13]. Многие международные организации рекомендуют поддерживать гемоглобин (Гб) на уровне 10–12 г/дл [14–16]. Однако, несмотря на использование эритропоэтин-стимулирующих средств (ЭСС) и препаратов железа, уровень контроля над анемией у пациентов с ХБП неудовлетворителен, и только у 63,1–90,7% пациентов обеспечивается достижение целевых уровней Гб, частично из-за воспалительных состояний у некоторых пациентов [17]. Кроме того, безопасность ЭСС остается серьезной проблемой в клинической практике. Несколько исследований показали, что ЭСС могут провоцировать артериальную гипертензию, тромбоз, сердечно-сосудистые события и даже смерть у пациентов с ХБП [18–22]. Одной из причин этих побочных эффектов было то, что ЭСС может привести к нефизиологическому уровню ЭПО. Побочные эффекты, как считают многие исследователи, больше связаны с высокой дозой ЭСС, а не с высоким целевым уровнем Гб. Так, G. Choukroun и соавт. [23] в проспективном исследовании показали, что целевой уровень Гб ≥ 13 г/дл способствует снижению прогрессирования хронической нефропатии аллотрансплантата у реципиентов почечного трансплантата без увеличения побочных эффектов. Данные DOPPS по летальности, применяемым дозам ЭСС и уровню железа у больных разных стран представлены в табл. 1 [24]. Как видно из табл. 1, имеется четкая прямая зависимость между летальностью, дозой применяемых ЭСС и уровнем железа. В США, где применяются наиболее высокие дозы железа и ЭСС, отмечена наибольшая летальность пациентов.
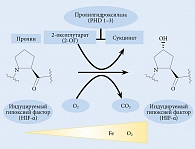
Имеются данные, подтверждающие тесную связь между железом и окислительным стрессом, ростом бактерий, тяжелыми желудочно-кишечными побочными эффектами и реакциями гиперчувствительности, а также повышенным риском инфицирования и смертности у пациентов с ХБП [25, 26]. Как было показано в недавнем рандомизированном исследовании, внутривенное введение железа связано с повышенным риском серьезных нежелательных явлений, включая сердечно-сосудистые и инфекционные заболевания [27]. Однако, несмотря на это, сохраняется опасная тенденция к увеличению применяемых доз железа. Данные результаты обусловлены, в частности, и теми национальными рекомендациями, которыми руководствуются врачи разных стран (табл. 2).
Международные наднациональные рекомендации KDIGO (2012) однозначно устарели, они не учитывают новые данные, появление новых возможностей в лечении анемии. Европейские и американские рекомендации имеют тот же недостаток. Российские рекомендации хоть и были обновлены, но повторяют старые международные рекомендации.
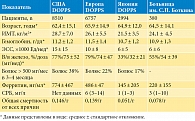
Недавно было уточнено значение индуцируемого гипоксией фактора (HIF) как фактора транскрипции, с помощью которого ЭПО индуцируется на транскрипционном уровне при гипоксии [28]. После его успешного клонирования в 1995 г. [29] были проведены исследования для выяснения молекулярного механизма, посредством которого HIF активируется в ответ на гипоксию. В 2001 г. сообщалось о клонировании диоксигеназ или гидроксилаз, действующих на остатки пролина и аспарагина, которые играют важную роль в этом процессе [30–32]. В частности, фермент, который гидроксилирует остатки пролина субъединицы HIF-α, представляет собой диоксигеназу или гидроксилазу, субстратами которой являются субъединица HIF-α, α-кетоглутарат, 2-оксоглутарат (2-OГ) и молекулярный кислород (O2); его кофакторами являются двухвалентное железо (Fe2+) и аскорбиновая кислота. Таким образом, HIF-пролилгидроксилазы (HIF-PH) обусловливают основной молекулярный механизм обнаружения снижения парциального давления кислорода или гипоксии в клетках; их можно назвать датчиками кислорода [33, 34].
Фармакологическое ингибирование HIF-PH увеличивает и DMT1 (мембранный транспортный белок 1 ионов железа)/Nramp2 (переносчик ионов металлов NRAMP 2) в эпителии кишечника, снижает выработку гепсидина в печени, тем самым улучшая метаболизм железа in vivo и потенциально приводя к эффективному лечению анемии [35–37].
HIF-1 представляет собой фактор транскрипции, состоящий из α-субъединиц (HIF-1α) и β-субъединиц (HIF-1β) [29]. Активированный HIF-1 (HIF-1α/HIF-1β) перемещается в ядрах клеток и связывается с элементом реакции на гипоксию (HRE) в регуляторной области гена-мишени, способствуя экспрессии доминантного гена. Экспрессия белка HIF-1α на очень низком уровне в культуре в условиях 20% кислорода; однако она быстро увеличивается в ответ на снижение парциального давления кислорода ниже 5% [38]. Было установлено, что HIF-1α имеет семейство молекул HIF-2α и HIF-3α [39]. Все они могут связываться с субъединицей HIF-β. Однако между ними могут быть некоторые различия: в то время как HIF-1α и HIF-2α активируют транскрипцию генов, HIF-3α подавляет активность HIF-1α и HIF-2α. Более того, их влияние на экспрессию некоторых генов также может различаться. HIF-2α может играть более важную роль, чем HIF-1α, в регуляции продукции ЭПО, поскольку он особенно необходим для продукции ЭПО в почках и печени. Непосредственная роль HIF-3α в эритропоэзе полностью не ясна. Наконец, экспрессия HIF-2α и HIF-3α ограничена несколькими тканями, в то время как HIF-1α встречается повсеместно. Удивительно, но хотя HIF-1 был выделен как фактор, ответственный за индуцированную гипоксией экспрессию ЭПО, но именно HIF-2, а не HIF-1 отвечает за индуцированную гипоксией экспрессию ЭПО в почках [40, 41].
Основной путь активации HIF-1 и HIF-2 осуществляется гидроксилазой субъединицы HIF-α. Гидроксилирование осуществляется белком домена пролилгидроксилазы (PHD) и белком – фактором, ингибирующим HIF-1 [31, 32]. Кислород является субстратом этих ферментов. Снижение концентрации кислорода приводит к уменьшению реакции гидроксилирования, и, как следствие, HIF-1α и HIF-2α разрушаются в протеасоме. Белок HIF-α связывается с HIF-1β и перемещается в ядро клетки. Этот димер является активным фактором транскрипции.
Три гена PHD были идентифицированы у млекопитающих, и считается, что каждый продукт гена выполняет определенную функцию, поскольку они различаются в отношении места (органа) экспрессии и субклеточной локализации. Эксперименты in vitro показали, что все три гена PHD гидроксилируют специфические остатки пролина HIF-α [42]. Однако в условиях in vivo PHD2 является основной пролингидроксилазой для HIF-α; было показано, что он необходим для биогенеза в экспериментах по разрушению генов [42]. PHD1 и PHD2 также негативно регулируют HIF-опосредованный ответ на гипоксию путем гидроксилирования пролиновых остатков HIF-α [43]. Были проанализированы ферментативные свойства рекомбинантных белков, и эти ферменты четко идентифицированы как диоксигеназы, которые гидроксилируют остатки пролина или аспарагина; им необходимы молекулярный кислород, 2-ОГ, Fe2+ и аскорбиновая кислота в качестве субстратов (рис. 1).
Гидроксилирование остатков пролина представляет собой ферментативную реакцию с использованием 2-ОГ в качестве субстрата в дополнение к субъединицам HIF-1α или HIF-2α и молекулярному кислороду. Ингибиторы, используемые в настоящее время в клинической медицине, работают в конкурентной борьбе с 2-ОГ по ингибированию этого фермента.
Открытие кислород-зависимых PHD в качестве ключевых регуляторов HIF-зависимого эритропоэза послужило теоретической основой для разработки HIF-активирующих соединений (называемых HIF-PHI). Соответственно, признание ключевой роли HIF-PHD в эритропоэзе открыло новые возможности в лечении ренальной анемии [44, 45]. Целевые органы или ткани HIF-PHI для коррекции анемии представлены на рис. 2 [46].
В процессе выяснения молекулярно-биологических свойств HIF было обнаружено, что несколько низкомолекулярных соединений вызывают внутриклеточное накопление белка HIF-α и способствуют повышению транскрипционной активности независимо от концентрации кислорода или даже в нормоксических условиях [42, 47]. Было обнаружено, что соли Co2+, Cu2+ и Ni2+ обладают ингибиторной активностью в отношении гидроксилазы как антагонисты Fe2+ [48–50]. Кроме того, хелаторы железа дефероксамин, 3,4-дигидроксибензойная кислота, 1,10-фенантролин и кверцетин ингибируют гидроксилазы [42, 47]. Эти низкомолекулярные соединения активируют HIF за счет ингибирования пролил- и аспарагинилгидроксилаз, однако не являются специфическими ингибиторами HIF-α-гидроксилазы. Эти соединения также ингибируют железозависимые пути в дополнение к ингибированию HIF-α-гидроксилазы и могут вызывать чрезмерную токсичность.
Синтез аналогов 2-ОГ был первым подходом, использованным при разработке ингибиторов РН. Большинство молекул, дошедших до клинического применения, представляют собой производные 2-OГ. В организме насчитывается более 60 2-ОГ-зависимых гидроксилаз; однако имеющиеся на рынке ингибиторы более чем в 1000 раз более специфичны для PHD1-3, чем для других ферментов [43].
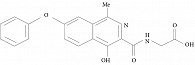
Первым препаратом HIF-PHI, который завершил испытания III фазы во многих странах, в том числе и в России, а в настоящее время одобрен к применению в Японии, Китае и странах ЕС, является роксадустат (рис. 3).
Была проведена целая программа клинических исследований III фазы, в которых приняли участие более 9600 пациентов со всего мира. Изучали эффективность и безопасность роксадустата у больных, не получающих диализ. В исследованиях ALPS, OLYMPUS и ANDES сравнивали роксадустат с плацебо у пациентов c ХБП третьей – пятой стадий [51–54]. Интегрированный анализ (n = 4270) показал, что роксадустат эффективен в достижении и поддержании уровня Гб с меньшим риском экстренной терапии. Что касается нежелательных явлений, обе группы лечения имели сопоставимые профили безопасности в отношении сердечно-сосудистых событий и смертности от всех причин [54].
Эффективность и безопасность роксадустата была оценена и с активным контролем в сравнении с дарбэпоэтином в исследовании DOLOMITES [55]. Среднее время наблюдения составило 104 недели, были включены 616 взрослых пациентов с анемией и ХБП третьей – пятой стадий (без диализа). Роксадустат не уступал дарбэпоэтину по первичной конечной точке, увеличению Гб в течение первых 24 недель лечения. Что касается вторичных конечных точек эффективности, у пациентов, получавших роксадустат, быстрее снижался уровень холестерина липопротеинов низкой плотности (ЛПНП) и требовалось меньшее количество введений железа. Роксадустат не уступал в контроле артериального давления, показателях качества жизни и изменении уровня Гб. Нежелательные явления, связанные с лечением, были сходными в двух группах. Не было существенных различий между группами в выявленных сердечно-сосудистых событиях. Во всех исследованиях роксадустата отмечалось раннее и устойчивое снижение уровня ЛПНП в виде плейотропного эффекта.
Ряд исследований III фазы, которые недавно закончились, были посвящены изучению эффективности и безопасности роксадустата в сравнении с ЭСС у больных, получающих диализ [56–58]. В этих работах было подтверждено, что у диализных пациентов роксадустат эффективен для коррекции анемии независимо от наличия воспаления, он повышает утилизацию железа и снижает уровень холестерина. Так, в подгруппах пациентов с высоким уровнем С-реактивного белка роксадустат приводил к большему повышению Гб (0,9 ± 1,0 г/дл), чем эпоэтин альфа (0,3 ± 1,1 г/дл). Кроме того, по сравнению с эпоэтином альфа у пациентов, получавших роксадустат, наблюдались повышение уровня общей железосвязывающей способности и снижение уровня гепсидина. Роксадустат усиливал метаболизм липидов, вызывая большее снижение общего холестерина, чем эпоэтин альфа. В крупном многоцентровом исследовании HIMALAYAS [56] было отмечено превосходство роксадустата над эпоэтином альфа в отношении среднего изменения Гб по сравнению с исходным уровнем; в исследование были включены пациенты с ограниченным предшествующим применением эпоэтина альфа. Применение роксадустата приводит к снижению применения внутривенно вводимого железа (исследования PYRENEES и ROCKIES [59, 60]), а в исследовании SIERRAS сообщалось и о снижении частоты переливаний крови [61].
С учетом повышенного риска сердечно-сосудистых заболеваний (ССЗ) у больных с ХБП необходим тщательный анализ риска развития ССЗ при применении роксадустата. Предварительные данные трех объединенных исследований третьей фазы по применению роксадустата у додиализных пациентов (исследования ALPS, ANDES и OLYMPUS) показывают отсутствие повышенного риска смертности от всех причин и ССЗ для роксадустата по сравнению с плацебо в ITT-популяции пациентов [62].
Заключение
На сегодняшний день проблема лечения анемии у больных с ХБП остается до конца не изученной. Непонятно, каковы верхние пределы ферритина и насыщения трансферрина железом, указывающие на перегрузку железом и риск развития нежелательных явлений. Ингибиторы пролилгидроксилазы HIF являются новыми препаратами, которые прошли основательную апробацию, получили признание в ряде стран и одобрение к их использованию для лечения анемии в качестве альтернативы ЭСС у пациентов с ХБП до диализа и на диализе. Кроме того, эти препараты обладают рядом потенциальных преимуществ. Ингибиторы пролилгидроксилазы HIF можно применять в клинических ситуациях, когда анемия очевидна и резистентна или нечувствительна к ЭСС, а также при состояниях дисрегуляции железа, особенно у больных на диализе. С учетом хорошей изученности роксадустата во многих странах мира, его простого способа применения и инновационного механизма действия, роксадустат может стать новым стандартом терапии анемии при ХБП.
Потенциальные преимущества роксадустата:
- эффективно повышает или поддерживает уровень гемоглобина;
- увеличивает экспрессию эндогенного ЭПО в физиологических пределах;
- регулирует метаболизм железа (в частности, уменьшает уровень гепсидина);
- оказывает противовоспалительный эффект;
- прием per os;
- обратимо и кратковременно ингибирует HIF-PHD;
- не вызывает риска гипертонии;
- способствует снижению уровня холестерина;
- не приводит к повышению уровней ЭП;
- предупреждает появление побочных эффектов, вызванных добавками железа.
E.V. Shutov, PhD, Prof., E.N. Gorelova, S.M. Sorokoletov, PhD
S.P. Botkin City Clinical Hospital
Russian Medical Academy of Continuous Professional Education
Contact person: Evgeny V. Shutov, shutov_e_v@mail.ru
The provided review reflects the actual problem of the treatment of anemia in patients with chronic kidney disease. Anemia is the independent predictor of mortality in this category of patients, and the use of erythropoietin-stimulating agents and iron medicines, unfortunately, does not always lead to correction of anemia. Hypoxia-inducible factor (HIF) regulates the cellular response to hypoxia and is involved in the development of many diseases, including anemia. HIF prolyl hydroxylase inhibitors (HIF-PHI) are a new class of drugs that activate HIF transcription factors and have broad therapeutic potential in clinical medicine. As a therapy for anemia, HIF-PHI stimulates erythropoiesis primarily by increasing endogenous erythropoietin production and modulating iron metabolism. The article reflects the results of numerous studies of first drug this new class – roxadustat.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.