К вопросу о структуре сопутствующих заболеваний и назначении антикоагулянтной терапии у пациентов пожилого и старческого возраста с фибрилляцией предсердий
- Аннотация
- Статья
- Ссылки
- English

Введение
С увеличением средней продолжительности жизни в мире и доли пожилого населения заболеваемость и распространенность фибрилляции предсердий (ФП) неуклонно возрастают. ФП регистрируется у 0,4–2% населения [1, 2]. По данным Фрамингеймского исследования, ежегодная заболеваемость ФП на 1000 человек среди лиц моложе 65 лет составляет 1,9 и 3,1 у женщин и мужчин соответственно по сравнению с 31,4 и 38 среди лиц старше 85 лет [3]. Вместе с тем в 2004 г. риск развития ФП у мужчин и женщин старше 40 лет в течение всей жизни составлял 25%. Всего десятилетие спустя ФП диагностируется у каждого третьего пациента [4]. Частота встречаемости ФП в европейской популяции составляла 1,1 на 1000 человеко-лет у пациентов в возрасте 55–59 лет. У лиц старше 80 лет этот показатель достигает 20,7 на 1000 человеко-лет [5]. За последние два десятилетия заболеваемость и распространенность ФП возросли как среди мужчин, так и среди женщин [6, 7].
У пожилых пациентов с ФП часто наблюдаются сопутствующие хронические заболевания, влияющие на клиническое течение ФП [8]. В исследованиях с участием от 123 224 до 1 217 103 пациентов старше 65 лет у 65–73% было выявлено два и более сопутствующих заболевания, а у 43–62% – свыше трех [9, 10]. Возрастающее бремя ожирения, сахарного диабета (СД), артериальной гипертензии (АГ), ишемической болезни сердца (ИБС) и сердечной недостаточности (СН) – факторов риска развития ФП – является основной причиной увеличения ее частоты и распространенности в популяции [6, 11].
По данным J.C. LaMori и соавт. [8], из 1297 участников исследования с ФП (средний возраст – 64,9 года) 98% помимо ФП имели как минимум одно сопутствующее заболевание, а 63% – четыре и более. При этом показатель индекса коморбидности Чарлсон у 15% составил 3–4 балла, у 3% – 4–5 баллов [8].
Полиморбидность (наличие двух или более хронических заболеваний у пациента, при котором ни одна из патологий не выделяется как основная) требует целостного и комплексного подхода к лечению пациентов с ФП, поскольку риск развития инсульта и кровотечения у таких больных выше, чем у пациентов без сопутствующих заболеваний. Кроме того, в указанной категории высока распространенность полипрагмазии [12, 13].
Одним из частых сопутствующих заболеваний, значительно влияющих на прогноз у пациентов с ФП, является анемия [14, 15]. Анемия представляет собой независимый модифицируемый фактор риска развития кровотечений, смертности от всех причин и значимых сердечно-сосудистых событий и требует обязательной оценки и учета при определении терапевтической стратегии у пациентов с ФП [16, 17].
Фибрилляция предсердий, старение и полиморбидность
Как уже отмечалось, возраст служит независимым фактором риска развития ФП [18, 19]. В поперечном исследовании the AnTicoagulation and Risk Factors in Atrial Fibrillation Study (ATRIA), включавшем 1,89 млн жителей США в возрасте 20 лет и старше, распространенность ФП составила 0,95% (95% доверительный интервал (ДИ) 0,94–0,96%), продемонстрировав рост с 0,1% среди лиц моложе 55 лет до 9,0% среди пациентов 80 лет и старше [20]. При этом, по прогнозам авторов, к 2050 г. количество пациентов с ФП увеличится в 2,5 раза [20].
Патофизиологические механизмы, способствующие развитию ФП в результате старения, до сих пор остаются предметом дискуссий. Значимый вклад вносят возраст-ассоциированная дилатация и фиброз предсердий, лежащие в основе структурного и электрического ремоделирования и приводящие к появлению субстрата, способствующего возникновению re-entry [21–23]. Другим предполагаемым механизмом считается снижение активности синоатриального узла и в то же время появление очагов эктопии в области устья легочных вен и коронарного синуса [24]. Уровень провоспалительных маркеров, поддерживающих хроническое системное воспаление, также увеличивается с возрастом, приводя к ремоделированию миокарда [25, 26].
По данным ряда исследований, концентрация высокочувствительного С-реактивного белка (вч-СРБ) и интерлейкина (ИЛ) 6 ассоциирована с развитием ФП, а также рецидивом после проведенной кардиоверсии [27–29].
Из-за высокой распространенности среди населения в целом АГ представляет собой важный фактор риска развития ФП, что нашло отражение в дополнительном популяционном риске (population attributable risk, PAR), равном 13,5% [30].
В исследовании D. Conen и соавт. [31], в котором участвовала 34 221 женщина (средний возраст – 55 ± 7 года) и период наблюдения составил 12,4 года, частота развития ФП была связана с уровнем систолического артериального давления (САД) (многофакторное скорректированное отношение рисков (сОР) для уровня САД 130–139, 140–159 и ≥ 160 мм рт. ст. составило 1,28 (95% ДИ 1,00–1,63), 1,56 (95% ДИ 1,22–2,01) и 2,74 (95% ДИ 1,77–4,22) соответственно; р < 0,0001) и диастолического артериального давления (ДАД) (многофакторное сОР для уровня ДАД 85–89, 90–94 и ≥ 95 мм рт. ст. – 1,53 (95% ДИ 1,05–2,23), 1,35 (95% ДИ 0,82–2,22) и 2,15 (95% ДИ 1,21–3,84) соответственно; р = 0,004) [31].
Аналогичные результаты получены в другом исследовании, в котором участвовали 2017 мужчин (средний возраст – 50 лет) и период наблюдения составил 35 лет. Авторы исследования оценивали долгосрочное влияние высокого АД на возникновение ФП в изучаемой когорте [32]. Пациенты с исходным САД ≥ 140 мм рт. ст. и 128–138 мм рт. ст., согласно регрессионной модели Кокса, имели 1,60-кратный (95% ДИ 1,15–2,21) и 1,50-кратный (95% ДИ 1,10–2,03) риск развития ФП соответственно с поправкой на наличие СД и сердечно-сосудистых заболеваний. Исходный уровень ДАД ≥ 80 мм рт. ст. повышал риск возникновения ФП в 1,79 раза (95% ДИ 1,28–2,59) [32]. Повышенный уровень АД и наличие АГ в целом коррелируют с частотой развития ФП на фоне гипертрофии левого желудочка (ГЛЖ) и дилатации левого предсердия, а также активации ренин-ангиотензин-альдостероновой системы [33].
В метаанализе, включавшем 27 141 пациента, частота наджелудочковых аритмий у пациентов с ГЛЖ составила 11,1% по сравнению с 1,1% среди пациентов без ГЛЖ [34]. Более того, у пациентов с ФП отсутствие антигипертензивной терапии ассоциировалось с высоким риском развития кровотечения (ОР 1,52; 95% ДИ 1,05–2,21; p = 0,027) [35].
По мере старения населения и совершенствования диагностических инструментов в мире наблюдается рост распространенности ФП и сердечной недостаточности (СН) с почти экспоненциальным увеличением заболеваемости после 60 лет [36, 37]. ФП часто имеет место при СН [38], а риск ее развития у пациентов с СН в 4–6 раз выше, чем в общей популяции [39].
По данным Фрамингеймского исследования, частота развития СН у пациентов с ФП составляет 3,3% в год, а заболеваемость ФП у пациентов с СН – 5,4% в год [3].
Как показали Z. Zhang и соавт. [40], наличие ФП сопровождается увеличением риска СН на 18%, тогда как на фоне СН риск развития ФП возрастает на 44% [40]. Помимо этого СН является наиболее распространенной причиной смерти пациентов с ФП, более чем в три раза превышающей смертность от инсульта [41]. Вместе с тем у пациентов с ФП последующее развитие хронической СН (ХСН) сопровождается повышением риска смерти от всех причин (у мужчин ОР 2,7 (95% ДИ 1,9–3,7), у женщин – 3,1 (95% ДИ 2,2–4,2)), как и дебют ФП у пациентов с ХСН (у мужчин ОР 1,6 (95% ДИ 1,2–2,1), у женщин – 2,7 (95% ДИ 2,0–3,6)) [42].
Сочетание СН и ФП значимо ассоциировано с увеличением риска инсульта, госпитализации по поводу обострения СН и смерти от всех причин [43]. Необходимо отметить, что распространенность ФП у пациентов с СН также коррелирует со степенью тяжести СН. У пациентов с ХСН I функционального класса (ФК) по классификации NYHA (New York Heart Association, Нью-Йоркская ассоциация кардиологов) ФП встречается менее чем в 10% случаев, тогда как у пациентов с ХСН IV ФК по NYHA частота ФП достигает 50% [44, 45].
Одним из факторов риска развития ФП является ИБС. Ее распространенность у пациентов с ФП варьируется от 17 до 46,5% [46]. При этом в данной когорте пациентов вероятность развития тромбоэмболических событий существенно возрастает, что отражает шкала CHA2DS2-VASc [47].
В исследовании Atherosclerosis Risk In Communities (ARIC) [48], включавшем 14 462 пациентов (средний возраст – 54 года), наличие ФП ассоциировалось с увеличением риска возникновения инфаркта миокарда (ИМ) на 63% (ОР 1,63; 95% ДИ 1,32–2,02). Исследование REAsons for Geographic And Racial Differences in Stroke (REGARDS) (n = 23 928, период наблюдения – 6,9 года) продемонстрировало, что ФП независимо связана с двукратным увеличением риска развития ИМ (ОР 1,96; 95% ДИ 1,52–2,52) [49].
Сочетание ИМ и ФП ассоциируется с увеличением смерти примерно на 40% [50]. Особому риску подвержены пациенты с ФП, впервые возникшей после ИМ: показатель смертности в данной когорте на 87% выше, чем у пациентов с постоянной формой ФП [51]. Сочетание острого коронарного синдрома (ОКС) и ФП сопровождается ухудшением прогноза, что требует специфического подхода к терапии и оценки факторов, влияющих на эффективность и безопасность антитромботической терапии у пациентов с ОКС и ФП.
Фибрилляция предсердий и анемия
Одним из потенциально обратимых факторов риска развития кровотечений, существенно влияющих на прогноз у пациентов с ФП, является анемия [16, 52].
По данным метаанализа (365 484 пациента с ФП, средний возраст – 74,7 года, период наблюдения – 0,2–4,0 года), анемия диагностирована у 16% пациентов [14].
Сходные результаты получены в исследованиях Apixaban for Reduction in Stroke and other Thromboembolic Events in Atrial Fibrillation (ARISTOTLE) (n = 18 103) и Randomized Evaluation of Long Term Anticoagulant Therapy (RE-LY) (n = 17 796): распространенность анемии составила 12,5 и 11,9% соответственно [16, 17].
Одной из основных причин развития анемии у пациентов с ФП являются кровотечения, риск возникновения которых возрастает на фоне приема антикоагулянтной терапии [16, 17]. Однако следует иметь в виду, что риск кровотечения, а значит, и развития анемии у пациентов зависит от конкретного антикоагулянта, что свидетельствует о существующей разнице в профиле безопасности отдельных лекарственных средств данной группы в когорте пациентов с ФП, особенно у больных ФП и анемией. Так, в исследовании ARISTOTLE за период наблюдения анемия de novo развилась у 30% пациентов после инициации терапии варфарином, тогда как в группе пациентов, принимающих апиксабан, данный показатель был статистически значимо ниже (ОР 0,91; 95% ДИ 0,84–0,98; p = 0,037) [16]. По данным исследования RE-LY, анемия несколько чаще встречалась у пациентов, принимавших дабигатран в дозе 150 мг два раза в сутки, по сравнению с больными группы дабигатрана 110 мг два раза в сутки или варфарина (частота развития анемии – 8,92, 7,98 и 7,38% соответственно; р = 0,02) [17].
В развитии анемии у пациентов с ФП задействован также иммуноопосредованный механизм. Он лежит в основе развития и поддержания анемии хронических заболеваний и обусловлен влиянием цитокинов на гомеостаз железа, продукцию эритропоэтина и пролиферацию предшественников эритроидного ряда [53]. Как собственно ФП, так и ряд сопутствующих ей заболеваний, в частности ХСН, хроническая болезнь почек (ХБП), а также биологическое старение организма ассоциируются с увеличением концентрации провоспалительных маркеров, особенно ИЛ-6, который стимулирует синтез гепсидина, приводящего к снижению железа, используемого в эритропоэзе, и, как следствие, к развитию анемии [54, 55]. Необходимо подчеркнуть, что у пациентов с ФП и анемией распространенность сопутствующих заболеваний выше, чем у пациентов только с ФП [16, 56]. Так, у пациентов с ФП и анемией более высокая распространенность СН (43,1 против 25,8%; p < 0,001), ИБС (19,5 против 14,8%; p = 0,006), ХБП (52,5 против 22,3%; p < 0,001), что позволяет предположить значимую роль системного воспаления в генезе анемии у пациентов с ФП [57].
Определенную роль в развитии анемии у пациентов с ФП играет дефицит микроэлементов и витаминов (железо, витамин В12, фолиевая кислота). Так, в исследовании A.M.K. Minhas и соавт. с участием 5 975 241 пациента с ФП (средний возраст – 70,3 года) распространенность железодефицитной анемии составила 2,54% [58].
Несмотря на высокую встречаемость анемии в данной когорте пациентов, исследований, оценивающих распространенность дефицитных состояний, недостаточно, а имеющиеся публикации представляют собой ретроспективные исследования с небольшим объемом выборки. Так, в исследовании M. Keskin и соавт. [59], включавшем всего 101 пациента с ФП, дефицит железа независимо от наличия анемии выявлен у 47,6% пациентов, а распространенность дефицита витамина В12 и фолатов составила 9,9 и 12,9% соответственно [59].
Согласно результатам исследования RE-LY [16], анемия у пациентов с ФП на фоне приема антикоагулянтов значимо ассоциируется с повышением риска развития как тромбоэмболических событий (сОР 1,50; 95% ДИ 1,32–1,71), так и больших кровотечений (сОР 2,14; 95% ДИ 1,87–2,46). Аналогичные результаты получены в исследовании ARISTOTLE: наличие анемии у пациентов с ФП на момент включения в исследование коррелировало не только с увеличением частоты больших кровотечений в 1,9 раза (сОР 1,92; 95% ДИ 1,62–2,28; р < 0,0001), но и служило независимым предиктором высокого риска смертности от всех причин (сОР 1,68; 95% ДИ 1,46–1,93; р < 0,0001) [17]. При этом снижение уровня гемоглобина на каждый 1 г/дл сопровождалось увеличением риска смерти на 24% [14].
С учетом сказанного для оценки риска развития кровотечения у пациентов с ФП разработаны и широко используются различные шкалы, включающие анемию как важный фактор риска геморрагических событий, – HEMORR2HAGES, ATRIA, ORBIT, GARFIELD-AF и ABC, HAS-BLED. Минздрав России и Российское кардиологическое общество для определения риска геморрагических событий рекомендуют использовать шкалу HAS-BLED, сумма баллов ≥ 3 по которой отражает высокий риск кровотечений [47].
В исследовании E.C. O'Brien и соавт. [60] по оценке прогностической ценности шкалы ORBIT снижение уровня гемоглобина/анемия представляло собой фактор, в максимальной степени ассоциированный с риском больших кровотечений по сравнению с одновременным приемом антиагрегантов, нарушением функции почек, пожилым возрастом.
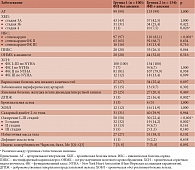
Нами был проведен анализ историй болезни пациентов с ФП старше 65 лет с анемией и без нее, планово госпитализированных в терапевтическое отделение многопрофильного стационара г. Москвы, на предмет наличия сопутствующей патологии и принимаемой антикоагулянтной терапии. У 100% пациентов имела место ХСН, а АГ и ИБС выявлялись в 99% и 97/82,1% в зависимости от наличия анемии соответственно (табл. 1).
В группе пациентов с ФП и анемией статистически значимо чаще встречались ХБП 4-й стадии (р = 0,026), доброкачественная гиперплазия предстательной железы (ДГПЖ) (р = 0,002), которые могут вносить свой вклад в развитие анемии.
Распространенность анемии возрастает по мере прогрессирования ХБП. Так, по данным анализа NHANES (National Health and Nutrition Examination Survey), у 15,4% пациентов с ХБП диагностируется анемия. При этом частота встречаемости анемии зависит от стадии ХБП – 17,4, 50,3 и 53,4% на 3-й, 4-й и 5-й стадиях ХБП соответственно [61].
В основе развития анемии у пациентов с ХБП лежит не только нарушение синтеза эритропоэтина, но и изменение гомеостаза железа, сопровождающееся истинным (вследствие повышенных потерь железа из-за дисфункции тромбоцитов, связанной с наличием уремии, нарушения всасывания железа с пищей) и функциональным дефицитом, обусловленным повышением активности гепсидина [53, 62–64].
В свою очередь развитие анемии на фоне ДГПЖ может быть связано не только с хронической кровопотерей на фоне гематурии, но и с приемом ингибиторов 5-альфа-редуктазы в качестве симптоматической терапии, которые приводят к снижению синтеза тестостерона, играющего важную роль в стимуляции эритропоэза у мужчин [65–67].
Обращает на себя внимание тот факт, что индекс коморбидности Чарлсон в обеих группах составил 7 [5; 8] (табл. 1), что свидетельствовало о высокой распространенности сопутствующих заболеваний у пациентов с ФП и низкой десятилетней выживаемости.
Как было сказано выше, оценку наличия сопутствующих заболеваний у пациентов с ФП необходимо проводить в первую очередь для определения риска развития ишемических, тромбоэмболических и геморрагических событий с целью выявления показаний к инициации и выбору антикоагулянтной терапии для достижения оптимального баланса эффективности и безопасности [47]. В связи с этим разработаны шкалы, позволяющие прогнозировать как риск развития инсульта и системной эмболии (CHA2DS2-VASc), так и риск кровотечений (HAS-BLED) [47].
Наше исследование показало, что, несмотря на средний показатель CHA2DS2-VASc > 6 (табл. 2), большая часть полиморбидных пациентов с ФП не получают антикоагулянтную терапию. Аналогичные результаты получены и в других исследованиях. Так, среди пациентов с высоким риском тромбоэмболических осложнений (≥ 3 баллов по CHA2DS2-VASc для женщин и ≥ 2 баллов для мужчин) только 48–50% принимали антикоагулянтную терапию [8, 68]. Это позволяет предположить, что в реальной клинической практике сопутствующие заболевания оказывают значимое влияние на назначение антитромботической терапии и выбор ее конкретной схемы.
В мире назначение пероральных антикоагулянтов пациентам с ФП и мультиморбидностью ассоциируется с возрастом пациентов, индексом массы тела, наличием сердечно-сосудистых факторов риска (статус курения), формой ФП, сопутствующими заболеваниями (АГ, ИБС, ИМ, транзиторная ишемическая атака или инсульт в анамнезе), наличием кровотечений, нарушением функции почек и выбором стратегии контроля ритма (аблация/кардиоверсия) [68–73].
Заключение
Возрастающая распространенность ФП представляет собой значимую проблему для современного здравоохранения. В клинической практике наблюдается рост числа пациентов с ФП и полиморбидной патологией, что подтверждается высокими баллами как по шкале CHA2DS2-VASc, так и по индексу коморбидности Чарлсон. При этом потенциально обратимой патологией, влияющей на прогноз, является анемия, представляющая собой независимый фактор риска развития кровотечений и смерти от всех причин. В связи с этим выбор рациональной фармакотерапии и тактики ведения пациентов с ФП должен осуществляться с учетом полиморбидной патологии, в частности анемии.
S.S. Telkova, A.I. Kochetkov, PhD, A.Ye. Vorobyova, S.S. Yeremina, O.D. Ostroumova, PhD, Prof.
Russian Medical Academy of Continuous Professional Education
I.M. Sechenov First Moscow State Medical University
Contact person: Aleksey I. Kochetkov, ak_info@list.ru
Atrial fibrillation (AF) is the most common cardiac arrhythmia, the prevalence and incidence increase the aging of populations worldwide. In studying the relationship with the increasing amount of multimorbid patients with AF, associated with the development of a proportion of elderly people, including the included signs, prognosis and choice of drug therapy in this case are of particular interest. Anemia, which is a consequence of dangerous and common diseases, is associated with a high risk of mortality from all causes and prognosis, and also affects the choice of therapeutic strategy in this group of patients. This sets us the task of increasing the literacy of doctors about the need to choose rational pharmacotherapy and management tactics for patients with AF, taking into account the multimorbid pathology, in particular with the presence of anemia.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.