Интегративные модели оценки риска развития рецидива немышечно-инвазивного рака мочевого пузыря
- Аннотация
- Статья
- Ссылки
- English
Цель работы – создание математических моделей прогнозирования риска развития рецидива у больных НМИРМП на основании клинико-морфологических параметров и показателей клеточного цикла осадка мочи.
При проведении дискриминантного анализа и множественного логистического регрессионного анализа были отобраны предикторы развития рецидива НМИРМП. Предикторами при проведении обоих видов анализа оказались наличие гематурии, мультицентричность опухолевого роста, удельный вес клеток осадка мочи в S- и G0-фазе. С использованием этих характеристик были разработаны интегративные математические модели, позволяющие прогнозировать развитие рецидива НМИРМП с высокой специфичностью, чувствительностью и диагностической точностью.
Цель работы – создание математических моделей прогнозирования риска развития рецидива у больных НМИРМП на основании клинико-морфологических параметров и показателей клеточного цикла осадка мочи.
При проведении дискриминантного анализа и множественного логистического регрессионного анализа были отобраны предикторы развития рецидива НМИРМП. Предикторами при проведении обоих видов анализа оказались наличие гематурии, мультицентричность опухолевого роста, удельный вес клеток осадка мочи в S- и G0-фазе. С использованием этих характеристик были разработаны интегративные математические модели, позволяющие прогнозировать развитие рецидива НМИРМП с высокой специфичностью, чувствительностью и диагностической точностью.
Введение
По данным мировой статистики, рак мочевого пузыря является достаточно распространенной опухолью, занимающей 9-е место в общей структуре онкологической заболеваемости и имеющей тенденцию к постоянному росту. На долю рака мочевого пузыря приходится около 2–5% всех злокачественных новообразований и 30–40% опухолей мочеполовой системы. 75–80% всех случаев заболевания составляет немышечно-инвазивный рак мочевого пузыря (НМИРМП) [1, 2].
Несмотря на использование комбинированных и комплексных методов, лечение НМИРМП остается проблематичным в силу склонности заболевания к рецидивирующему течению [3, 4]. Диагностике рецидива заболевания посвящено множество работ, направленных на поиск клинико-морфологических, цитологических и молекулярных предикторов течения заболевания. Тем не менее до сих пор актуальны исследования, направленные на создание диагностически точных моделей, определяющих риск развития рецидива НМИРМП [5, 6].
Цель данной работы – создание высокочувствительных и специфичных математических моделей прогнозирования риска развития рецидива у больных НМИРМП на основании клинико-морфологических параметров и показателей клеточного цикла осадка мочи.
Материал и методы
Работа проводилась на базе КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского». В исследовании участвовало 162 больных НМИРМП (средний возраст – 63,7 ± 10,30 года). Пациенты были разделены на две группы. Первую группу составили 113 пациентов, у которых отсутствовал рецидив заболевания на протяжении 36 месяцев с момента окончания лечения, вторую – 49 больных НМИРМП с подтвержденным рецидивом заболевания, возникшим в течение трехлетнего периода наблюдения.
В указанных группах изучались клинико-морфологические показатели: клинические проявления заболевания, размеры опухоли, их количество, глубина инвазии, степень дифференцировки и локализация опухоли.
Для изучения клеточного цикла в осадке мочи у всех пациентов забиралась утренняя порция мочи. Для выделения клеточных элементов осадка исследуемую порцию мочи центрифугировали при 2000 об/мин в течение 20 минут. После этого дважды проводили процедуру отмывки клеточного осадка фосфатным буферным раствором.
Клеточный цикл определяли в подготовленном клеточном осадке мочи методом флуоресцентного окрашивания ki-67 и йодидом пропидия. Пермебализацию клеточных элементов осуществляли с использованием 96%-ного этилового спирта. Флуоресцентное окрашивание ki-67 проводили моноклональными антителами, меченными флуоресцеина изотиоцианатом (ФИТЦ, максимум поглощения на 492 нм, максимум флуоресценции на 518 нм, производитель BD Biosciences, США). После добавления йодида пропидия (фенантридин-3,8-диамино-5-[3-(диэтилметиламмоний) пропил]-6-фенил-дийодид, максимум поглощения на 488 нм, максимум флуоресценции на 610 нм, производитель Sigma-Aldrich, США) и инкубации измеряли флуоресценцию на проточном цитофлуориметре BD FACSCantoII (Becton Dickinson, США).
Статистическую обработку данных выполняли с помощью компьютерных программ Мicrosoft Office Excel 2013, IBM SPSS 20.0.
При оценке нормальности распределения количественных признаков ориентировались на критерий Шапиро – Уилка. Для межгрупповых сравнений использовали непараметрический критерий Манна – Уитни. По качественным признакам сравнение групп проводили на основании критерия χ2 Пирсона. Уровень отвержения статистической гипотезы относительно незначимости различий между переменными р < 0,05.
Показатели безрецидивной выживаемости больных НМИРМП оценивали методом анализа дожития по Каплану – Мейеру. Цензурированными при проведении анализа считали случаи дожития пациентов до конца трехлетнего (36-месячного) срока наблюдения в отсутствие признаков рецидива.
Для создания прогностических моделей использованы методы дискриминантного и множественного регрессионного логистического анализа. Специфичность и чувствительность полученных логистических регрессионных и дискриминантных моделей оценивали с помощью ROC-анализа. Количественную интерпретацию результатов проводили по ROC-кривым, оценивая показатель AUC (Area Under Curve – площадь под ROC-кривой).
Результаты
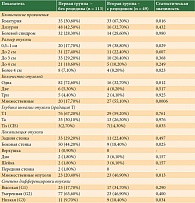
Данные, полученные при сравнительной оценке основных клинико-морфологических параметров у больных НМИРМП в зависимости от характера течения заболевания, представлены в табл. 1.
При изучении клинических признаков установлено, что у пациентов второй группы (с рецидивом заболевания) гематурия встречалась в 2,2 раза чаще (р < 0,05), чем у больных без рецидива. При этом дизурия и болевой сидром не имели статистически значимых различий в сравниваемых группах.
При анализе размеров опухоли выявлено, что размер опухоли 0,5–1 см у пациентов второй группы регистрировался в 2,2 раза (р < 0,05) чаще, чем у пациентов первой группы. Размеры опухоли более 1,0 см не имели статистически значимых различий в сравниваемых группах.
Анализ количества опухолей у больных НМИРМП показал, что одно образование чаще отмечалось у пациентов без рецидива заболевания по сравнению с пациентами с рецидивом (р < 0,05). В свою очередь мультицентричный рост опухоли в 3,1 раза (р < 0,01) чаще наблюдался у пациентов второй группы.
При анализе глубины инвазии опухоли в стенку мочевого пузыря выявлено значимое увеличение в 5,3 раза (р < 0,05) числа пациентов с ТIS по сравнению с пациентами без рецидива заболевания.
При оценке локализации опухоли в мочевом пузыре у пациентов с НМИРМП установлено, что опухоль боковой стенки мочевого пузыря в 2,4 раза (р < 0,05) чаще регистрировалась у пациентов первой группы по сравнению с пациентами второй группы. При этом мультицентричный рост опухоли был более характерен для пациентов с рецидивирующим течением заболевания (р < 0,05).
Анализ степени дифференцировки опухоли мочевого пузыря показал статистически значимые различия только при 3-й степени клеточной анаплазии (G3), которая чаще отмечалась у пациентов второй группы (р < 0,05).
Таким образом, анализ клинико-морфологических параметров у больных НМИРМП исследуемых групп продемонстрировал наличие ряда показателей, ассоциированных с рецидивирующим течением заболевания. Речь идет о гематурии, небольшом размере опухоли, мультицентричности опухолевого роста, ТIS, локализации опухолевого поражения на боковых стенках, низкой степени дифференцировки опухоли.
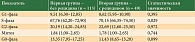
При сравнительном анализе показателей митотического цикла у пациентов с различным течением НМИРМП обнаружено увеличение количества клеток в S-фазе (70,15 ± 6,58) на фоне рецидивирующего течения заболевания (по сравнению с группой без рецидива) (р < 0,05). Кроме того, имела место тенденция к снижению доли клеток в G0-фазе у пациентов второй группы (0,05 < р < 0,1) (табл. 2).
Следующим этапом работы стало определение переменных, позволяющих прогнозировать развитие рецидива у больных НМИРМП с помощью дискриминантного анализа. В качестве предикторов использовались указанные клинико-морфологические параметры, а также показатели клеточного цикла осадка мочи. Методом шагового отбора были выбраны следующие предикторы развития рецидива НМИРМП: относительное количество клеток в осадке мочи, находящихся в S- и G0-фазах клеточного цикла, общее количество опухолей в мочевом пузыре и наличие гематурии. Наибольший вклад в результаты классификации из отобранных переменных вносят количество опухолей и наличие гематурии. Эти же признаки в большей степени коррелируют с канонической дискриминантной функцией.
Исходя из данных, линейная дискриминантная функция, прогнозирующая низкий риск развития рецидива НМИРМП после комбинированного лечения, представлена уравнением:
D1 = -49,810 + 1,322x1 + 0,251x2 + 1,665x3 + 3,764x4.
Уравнение линейной дискриминантной функции, прогнозирующей высокий риск рецидива заболевания, имеет вид:
D2 = -53,945 + 1,380x1 + 0,185x2 + 2,486x3 + 1,962x4,
где
D1 и D2 – линейные дискриминантные функции;
х1 – доля клеток осадка мочи в S-фазе клеточного цикла;
х2 – доля клеток осадка мочи в G0-фазе клеточного цикла;
х3 – мультицентричность опухоли;
х4 – гематурия (0 – отсутствие, 1 – наличие).
При D1 > D2 прогнозируется низкий риск развития рецидива НМИРМП, при D1 < D2 – высокий.
Чувствительность данной модели – 79,6%, специфичность – 72,6%, общая диагностическая точность – 74,6%.
В качестве другого метода оценки вероятности развития рецидива НМИРМП использовали множественный логистический регрессионный анализ.
Для повышения точности модели была предпринята попытка использовать наряду с показателями клеточного цикла осадка мочи в качестве предикторов клинико-морфологические параметры.
Методом шагового отбора получена логистическая регрессионная модель, представленная следующим уравнением:
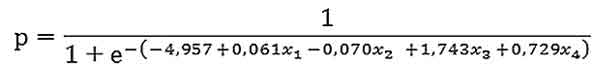 ,
,
где
р – вероятность развития рецидива НМИРМП;
х1 – доля клеток осадка мочи в S-фазе клеточного цикла;
х2 – доля клеток осадка мочи в G0-фазе клеточного цикла;
х3 – наличие гематурии
(0 – отсутствие, 1 – наличие);
х4 – количество опухолей
(b4 = 0,729).
При р < 0,5 прогнозировался низкий риск развития рецидива НМИРМП, при р ≥ 0,5 – высокий.
Модель имеет хорошую согласованность данных (по Хосмеру – Лемешоу р = 0,820) и является статистически значимой (χ2 = 51,526; р < 0,001).
Для данной модели коэффициент детерминации R2 = 0,386, что показывает статистически значимое объяснение данными предикторами изменений переменной отклика на 38,65%. Модель с высокой специфичностью предсказывает отсутствие рецидива после комбинированного лечения НМИРМП (в 91,2% случаев). При этом доля правильных предсказаний развития рецидива достигла 69,4%.
С учетом ROC-анализа наиболее точной прогностической моделью по достигнутому уровню чувствительности и специфичности является регрессионная модель, использующая в качестве предикторов рецидива рака мочевого пузыря сочетание показателей митотического цикла и клинических признаков. Модель характеризуется высокой специфичностью – 91,2%, чувствительностью 69,4%, общей диагностической точностью 84,5%.
Обсуждение
В 8-м издании TNM [7] в качестве основных прогностических факторов при немышечно-инвазивном раке мочевого пузыря указаны степень злокачественности, категория Т, carcinoma in situ, количество новообразований, предшествующие рецидивы, возраст, общее состояние, сопутствующие заболевания, объем трансуретральной резекции. К дополнительным факторам отнесены размеры опухоли, рецидив образования при обследовании через три месяца, пол и курение. Проведенный нами сравнительный анализ идентифицировал аналогичные прогностические факторы: размер и количество опухолей, наличие carcinoma in situ, низкую степень дифференцировки опухоли.
Кроме того, используемые онкологами для оценки риска рецидива и прогрессирования НМИРМП классификация EORTC [8] и схема Испанской группы онкоурологов (CUETO) [9], основанные на количестве новообразований, степени их дифференцировки, размерах, стадии и числе рецидивов, демонстрируют недостаточную диагностическую точность [10, 11]. Приведенные данные свидетельствуют о необходимости разработки новых интегративных моделей, основанных на наиболее значимых и хорошо изученных клинико-морфологических параметрах, а также новых факторах, связанных с биологическими особенностями опухолевого роста. К таким факторам можно отнести параметры клеточного цикла.
Ранее проведенные исследования продемонстрировали роль различных фаз клеточного цикла в диагностике и оценке риска развития рецидива у пациентов со злокачественными новообразованиями [12, 13]. В исследовании Е.В. Слепова и соавт. показано, что количество клеток во всех фазах клеточного цикла статистически значимо отличается у пациентов с уротелиальной карциномой по сравнению с пациентами без признаков опухолевого или воспалительного поражения мочевых путей [14].
Увеличение доли клеток, находящихся в процессе деления, отражает интенсивные пролиферативные процессы, связанные с развитием злокачественного новообразования. Данное предположение также подтверждается изменениями относительного количества клеток, находящихся в фазах клеточного цикла до и после митоза. В свою очередь снижение доли клеток осадка мочи, находящихся в синтетической фазе, возможно, характеризует перераспределение всего клеточного пула в сторону активной пролиферации. Клетки, находящиеся в G0-фазе клеточного цикла, максимально направлены на выполнение определенной функции. Поэтому относительное содержание этих клеток может отражать уровень дифференцировки исследуемой ткани. С этой точки зрения снижение доли клеток, находящихся в периоде покоя, закономерно предшествует рецидивированию опухоли в дальнейшем [15].
Обнаруженные изменения согласуются с существующими теориями канцерогенеза в тканях мочевого пузыря [16, 17]. То, что в группе с рецидивирующим течением НМИРМП доля клеток осадка мочи, находящихся в синтетической фазе, больше, чем в группе без рецидива, может объясняться более активными пролиферативными процессами в уротелии.
Заключение
Сравнительный однофакторный анализ основных клинико-морфологических параметров и показателей клеточного цикла у больных НМИРМП выявил возможные предикторы рецидива заболевания: наличие гематурии и участков carcinoma in situ, размер опухоли от 0,5 до 1,0 см, мультицентричность опухолевого роста, локализацию поражения на боковых стенках мочевого пузыря, низкую степень дифференцировки опухоли, а также увеличение количества клеток осадка мочи в S-фазе.
При проведении дискриминантного анализа методом шагового отбора были отобраны следующие предикторы развития рецидива НМИРМП: относительное количество клеток в осадке мочи, находящихся в S- и G0-фазах клеточного цикла, общее количество опухолей в мочевом пузыре и наличие гематурии. Чувствительность данной модели составила 79,6%, специфичность – 72,6%, диагностическая точность – 74,6%.
Регрессионная модель Кокса идентифицировала в качестве статистически значимых предикторов рецидива заболевания удельный вес клеток осадка мочи в S-фазе и G0-фазе митотического цикла. Кроме того, точность модели значительно повышалась при включении таких клинико-морфологических показателей, как количество опухолей и наличие гематурии. Модель характеризовалась высокой специфичностью – 91,2%, чувствительностью 69,4%, общей диагностической точностью 84,5%.
Таким образом, разработанные с использованием различных математических методов интегративные модели установили в качестве статистически значимых предикторов рецидива НМИРМП схожие показатели: повышение удельного веса клеток осадка мочи в S-фазе, снижение их в G0-фазе, наличие гематурии и мультицентричность опухолевого роста.
D.V. Chernyaev, Ye.V. Slepov, PhD, A.V. Mazayev, I.P. Safontsev, PhD, R.A. Zukov, PhD, Prof.
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
The main problem in the non-muscle-invasive bladder cancer (NMIBC) treatment is the frequent recurrence of the disease. Many works are devoted to the search for clinical, morphological, cytological and molecular parameters for effective diagnosis of disease recurrence.
The work aim was the creation of mathematical models for predicting the recurrence risk in patients NMIBC based on clinical, morphological and urine sediment cell cycle parameters.
It was selected recurrence NMIBC predictors during discriminant analysis and multiple logistic regression analysis. There were the presence of hematuria, multicentric tumor growth, and the cell cycle S-phase and G0-phase in the sediment urine cells. Integrative mathematical models developed using these predictors. They made it possible to predict the development of NMIBC recurrent with high specificity, sensitivity, and overall diagnostic accuracy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.