Возможность управления показателями клеточного иммунитета у больных раком мочевого пузыря на фоне радиотерапии
- Аннотация
- Статья
- Ссылки
- English
Целью работы стала оценка влияния лучевой терапии на показатели клеточного иммунитета у больных раком мочевого пузыря, а также изменения этих параметров на фоне применения натрия дезоксирибонуклеата – препарата с радиопротекторной активностью.
Установлено изменение клеточного состава субпопуляций лимфоцитов периферической крови, обусловленное опухолевым поражением мочевого пузыря. Уход опухоли из-под иммунологического надзора сопровождается снижением содержания Т- и В-лимфоцитов, а также цитотоксических популяций клеток. Радиотерапия усугубляет иммунодефицит. При добавлении радиопротектора восстанавливаются показатели клеточного иммунитета, в частности содержание Т- и В-лимфоцитов, а также стимулируется неспецифический иммунитет.
Целью работы стала оценка влияния лучевой терапии на показатели клеточного иммунитета у больных раком мочевого пузыря, а также изменения этих параметров на фоне применения натрия дезоксирибонуклеата – препарата с радиопротекторной активностью.
Установлено изменение клеточного состава субпопуляций лимфоцитов периферической крови, обусловленное опухолевым поражением мочевого пузыря. Уход опухоли из-под иммунологического надзора сопровождается снижением содержания Т- и В-лимфоцитов, а также цитотоксических популяций клеток. Радиотерапия усугубляет иммунодефицит. При добавлении радиопротектора восстанавливаются показатели клеточного иммунитета, в частности содержание Т- и В-лимфоцитов, а также стимулируется неспецифический иммунитет.
Введение
В начале ХХ в. Жан Бергонье и Луи Трибондо сформулировали правило чувствительности живых клеток к ионизирующим излучениям [1]. Согласно предложенной закономерности, радиочувствительность клеток находится в прямой зависимости от частоты клеточных делений, продолжительности митотической стадии и степени их дифференцировки. Практическое применение это правило нашло в радиотерапии активно пролиферирующей опухолевой ткани. Высокая эффективность лучевой терапии показана при ряде злокачественных опухолей, например раке мочевого пузыря (РМП).
В настоящее время единственным хирургическим методом лечения мышечно-инвазивного РМП считается цистэктомия. Однако отсутствие возможности создания адекватного резервуара и недостаточная адекватность функционирования путей оттока мочи в послеоперационном периоде способствуют развитию значительного количества ранних и поздних осложнений [2]. В зависимости от стадии РМП, гистологических и иммуногистохимических характеристик опухоли применение ионизирующего излучения может иметь различные цели: радикальную, послеоперационную и паллиативную. Радикальные схемы лучевой терапии применяются при противопоказаниях к радикальной операции, в дополнение к трансуретральной резекции или гемирезекции мочевого пузыря у больных мышечно-инвазивным РМП, отказе больного от хирургического лечения или тотальном поражении мочевого пузыря [3]. При немышечно-инвазивном раке мочевого пузыря лучевую терапию используют с органосохраняющей целью при быстро рецидивирующих или обширных опухолях, при которых невозможна трансуретральная резекция, а также при высоком риске прогрессирования заболевания [4].
К сожалению, помимо опухоль-опосредованного угнетающего действия терапевтические дозы ионизирующих излучений могут оказывать негативное системное влияние на организм пациентов. Так, в ряде исследований показан иммуносупрессирующий эффект лучевой терапии [5, 6]. К сожалению, до настоящего времени не сформулированы подходы к коррекции радиационно-обусловленного иммунодефицита, поэтому изучение показателей иммунной системы, а также разработка подходов к управлению ими является перспективным направлением исследований.
Целью данной работы стала оценка влияния лучевой терапии на показатели клеточного иммунитета, а также изменения этих показателей на фоне применения препаратов с радиопротекторной функцией у больных РМП.
Материал и методы
В исследование включено 80 больных РМП в возрасте 44–67 лет (средний возраст – 59,20 ± 7,3 года), которые методом случайного отбора были разделены на две группы.
Первую группу (группу сравнения) составили 40 пациентов, которым проведен послеоперационный курс дистанционной лучевой терапии в конформном режиме. Первый этап: методами 3D-CRT и IGRT облучение мочевого пузыря, паравезикальной клетчатки, зон регионарных лимфатических узлов до суммарной очаговой дозы (СОД) 46 Гр. Второй этап: облучение мочевого пузыря и паравезикальной клетчатки до СОД 60–64 Гр.
Во вторую (исследовательскую) группу вошли 40 больных РМП, пролеченных аналогичными методами с использованием препарата с радиопротективными свойствами – натрия дезоксирибонуклеата (Дерината). Раствор препарата 15 мг/мл, 5,0 мл вводили внутримышечно с первого дня лучевой терапии перед первым сеансом. Курсовое введение препарата продолжалось каждые 48 часов (через сутки), курс – десять инъекций (первый курс) с последующим 72-часовым перерывом. Повторные курсы проводились по аналогичной схеме – десять внутримышечных инъекций препарата в разовой дозе 5,0 мл раствора 15 мг/мл каждые 48 часов с 72-часовым интервалом (трое суток) между курсами вплоть до окончания лучевой терапии.
Группы были сопоставимы по демографическим и основным клинико-морфологическим и лабораторным характеристикам. Все исследования выполнены с информированного согласия пациентов и в соответствии с Хельсинкской декларацией «Этические принципы проведения научных медицинских исследований с участием человека» и Правилами клинической практики в Российской Федерации.
Контрольную группу представляли 35 практически здоровых доноров крови аналогичного возраста.
Для оценки показателей клеточного иммунитета у пациентов проводили забор венозной крови. У каждого больного манипуляцию проводили дважды – до начала радиотерапии и через месяц после терапии. В контрольной группе биологические образцы забирались однократно.
Исследование фенотипических особенностей популяций клеток иммунной системы периферической крови выполняли методом проточной цитометрии с помощью прямой пятицветной иммунофлуоресценции.
Для дифференцировки лимфоцитов использовали моноклональные антитела (BD BioScience, США), меченные FITC (fluoresceinisothiocyanate), PE (phycoerythrin), ECD (phycoerythrin-TexasRed-X), PC5 (phycoerythrin-cyanin 5), PC7 (phycoerythrin-cyanin 7). Мануальный учет сигналов флуоресценции, соотнесенный с сигналами кластеров дифференцировки на поверхности лимфоцитов, проводился на основании уровня экспрессии молекулы CD45 и по боковому светорассеянию либо прямому и боковому светорассеянию. Подсчет относительного количества субпопуляций лимфоцитов осуществляли относительно общей фракции лимфоцитов.
На основании анализа были получены данные об относительном и абсолютном содержании Т-лимфоцитов (CD3+-клетки), В-лимфоцитов (CD19+), Т-хелперов (CD3+CD4+), T-цитотоксических лимфоцитов (CD3+CD8+), Т-регуляторных лимфоцитов (CD3+CD4+CD25hiCD127low), натуральных киллеров (CD3-CD16+CD56+), NKT-лимфоцитов (CD3+ CD16+CD56+).
В связи с распределением показателей, отличным от нормального, полученные данные описывали с помощью медианы (Ме) и интерквантильного размаха в виде 25-го и 75-го перцентилей (С25 и С75). Статистическая обработка данных проводилась с использованием пакета прикладных программ Statistica 10,0 (StatSoft, США).
Результаты и обсуждение
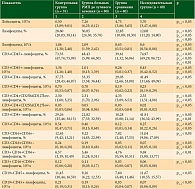
В ходе исследования у больных РМП выявлены изменения клеточных субпопуляций лимфоцитов, отражающие иммуносупрессорное воздействие опухоли на организм (таблица).
Так, снижение содержания В- и Т-лимфоцитов в группе больных относительно группы здоровых (в 1,2 и 1,5 раза соответственно) сопровождалось уменьшением относительного количества Т-цитотоксических лимфоцитов и натуральных киллеров. Наблюдалась также тенденция к снижению Т-хелперов в периферической крови.
Опухоли различных гистологических типов и локализаций в процессе канцерогенеза приобретают свойства, обусловливающие их взаимодействие с системой иммунитета [7]. Могут иметь место так называемый уход из-под иммунологического надзора за счет модуляции опухолевых антигенов, исчезновение их с поверхности мембран и нейтрализация антител растворимыми опухолевыми факторами. Другой механизм взаимодействия проявляется в подавлении клеточного и гуморального иммунитета за счет синтеза противовоспалительных цитокинов и активации Т-регуляторных субпопуляций лимфоцитов [8, 9]. Природа указанных феноменов недостаточно изучена. При этом наблюдается изменение показателей иммунной системы. Данный феномен находит отражение и в настоящем исследовании.
На фоне лучевой терапии больным РМП усугубляются существующие изменения до состояния клеточного иммунодефицита (таблица). После воздействия терапевтических доз ионизирующих излучений обнаруживается снижение содержания практически всех исследуемых популяций клеток, за исключением увеличения Т-регуляторных лимфоцитов в 1,7 раза относительно здоровых доноров и почти в два раза – относительно показателей до начала лечения.
Известно, что облучение клеток высокими дозами ионизирующего излучения способно нарушить нормальное функционирование неспецифических механизмов системы иммунитета [10, 11], к которым относятся комплекс гуморальных (например, интерфероны и факторы системы комплемента) и клеточных факторов (в частности, клеток-фагоцитов и клеток с цитотоксической функцией). В то же время адаптивный иммунитет, формируемый за счет приобретенных в процессе жизнедеятельности свойств Т- и В-лимфоцитов отвечать на антигены высокоизбирательно, чувствителен к действию самых низких доз радиации. Высокая радиочувствительность зрелых популяций лимфоцитов приводит к их гибели в первые дни после облучения. Это может являться причиной снижения общего количества Т-лимфоцитов в данной группе пациентов после радиотерапии. Кроме того, показаны изменения в пуле поверхностных клеточных рецепторов на В- и Т-лимфоцитах, что приводит к изменениям их функциональной активности. Утрата имеющихся на их поверхности клеточных рецепторов для различных антигенов связана с вмешательством ионизирующего излучения в процесс реаранжировки генов TCR (T-cell receptor – антигенраспознающего рецептора Т-лимфоцитов). Вследствие изменения экспрессии молекул адгезии после облучения нарушается распределение лимфоцитов в крови и лимфоидных органах и фактически искажается пространственная организация системы клеточного иммунитета. Снижение числа лимфоцитов, угнетение цитотоксических функций клеток иммунной системы после лучевого лечения наряду с гранулоцитопенией являются причинами развития инфекционных осложнений у данной категории больных. Увеличение регуляторных субпопуляций Т-лимфоцитов, по всей вероятности, компенсаторная реакция на снижение количества опухолевых антигенов за счет уменьшения активно пролиферирующей опухолевой ткани в результате проведенного лечения.
Применение препарата с радиопротекторными свойствами (натрия дезоксирибонуклеинат – Деринат) в другой группе больных позволило получить данные для оценки влияния лекарственной терапии на восстановление функций клеточного иммунитета после лучевого лечения (таблица). Так, уровень Т-лимфоцитов в этой группе больных после лучевого лечения соответствовал показателям в контрольной группе и значительно превосходил в данной временной точке (в 1,9 раза) параметры пациентов без поддерживающей радиопротекторной терапии. Восстановление показателей до уровня контрольной группы наблюдалось также в отношении В-лимфоцитов, Т-хелперов, Т-регуляторных лимфоцитов, натуральных киллеров. Уровни Т-цитотоксических лимфоцитов и NKT-клеток превышали показатели как здоровых доноров (в 1,4 и 1,5 раза соответственно), так и пациентов без терапии натрия дезоксирибонуклеатом более чем в два раза.
Помимо радиопротекторного эффекта натрия дезоксирибонуклеат проявляет иммуномодулирующий эффект. Следует отметить, что основной физиологический механизм иммунотропного действия дериватов ДНК принято связывать с воздействием на Toll-подобные рецепторы 9-го типа (TLR9), которые распознают консервативные структуры микроорганизмов и активируют врожденный иммунный ответ. Такие рецепторы экспрессируются дендритными клетками, натуральными киллерами и антигенпрезентирующими клетками [8, 12]. Стимулирование неспецифических естественных клеточных механизмов иммунной системы приводит к увеличению содержания популяций цитотоксических лимфоцитов – натуральных киллеров, NKT-клеток и Т-киллеров. Постоянство содержания регуляторных субпопуляций Т-лимфоцитов в разных группах пациентов отражает свойство поддерживать толерантность к собственным антигенам организма.
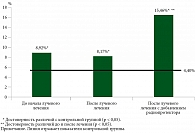
Другой популяцией клеток, экспрессирующих TLR9, являются моноциты и макрофаги [8, 12]. В ходе исследования было обнаружено, что у больных РМП содержание моноцитов в периферической крови в два раза выше, чем у пациентов контрольной группы (рисунок).
Радиотерапия не оказывала значимого влияния на содержание моноцитов в периферической крови, тогда как сочетанное лечение с радиопротектором способствовало повышению в 1,8 раза относительно уровня, зафиксированного до начала лечения, и в 3,7 раза – относительно показателей здоровых доноров.
Заключение
Процессы канцерогенеза при развитии РМП опосредуют изменение клеточного состава субпопуляций лимфоцитов периферической крови. Снижение относительного содержания Т- и В-лимфоцитов, а также цитотоксических популяций клеток отражает закономерности ухода опухоли из-под иммунологического надзора. На этом фоне радиотерапевтическое лечение усугубляет иммунодефицит, что может привести к повышенному риску инфекционных осложнений.
Радиопротектор натрия дезоксирибонуклеат, используемый в качестве сопроводительной терапии при лучевом лечении, оказывает иммуномодулирующее влияние, восстанавливает показатели клеточного иммунитета, в частности содержание Т- и В-лимфоцитов, а также стимулирует неспецифический иммунитет за счет активации его фагоцитарного и цитотоксического звена.
R.A. Zukov, PhD, Prof., Ye.V. Slepov, PhD, Yu.V. Kozina, L.M. Kurtasova, PhD, Prof., P.I. Skopin, PhD, A.A. Ivashin
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
N.P. Ogarev National Research Mordovian State University
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
Today radiotherapy is one of the main methods for many malignant neoplasms therapy, including bladder cancer.
The work purpose was assess the effect of radiotherapy on the cell immunity parameters in patients with bladder cancer, as well as changes in these parameters during the use of radioprotector – sodium deoxyribonucleate.
A change in the cellular composition of peripheral blood lymphocytes subpopulations, caused by the carcinogenesis processes during the bladder cancer, was found. Tumor escaped from immunological supervision is accompanied by a decrease in the content of T- and B-lymphocytes, and cytotoxic cell populations. Radiotherapy increases immunodeficiency. After radioprotector added the cell immunity parameters restored, in particular the content of T- and B-lymphocytes, also stimulated nonspecific immunity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.