Атеросклероз интракраниальных артерий является существенным фактором развития острого нарушения мозгового кровообращения. В статье рассматриваются патофизиологические аспекты, клинические проявления, методы диагностики, лечения и профилактики атеросклероза интракраниальных артерий. Отмечается, что дальнейший прогресс в изучении данной проблемы связан с новыми методиками визуализации сосудов и атеросклеротической бляшки и поиском индивидуальных подходов к лечению, включая определение показаний к эндоваскулярным вмешательствам.
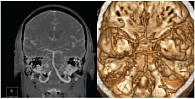
Рис. 1. Компьютерная томографическая ангиография интракраниальных артерий: окклюзия правой позвоночной артерии на интракраниальном уровне (MIP- и 3D-изображения)
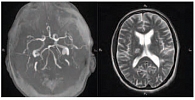
Рис. 2. Магнитно-резонансная ангиография и магнитно-резонансная томография головного мозга в режиме Т2 (магнитно-резонансный томограф с напряженностью магнитного поля 3Т)
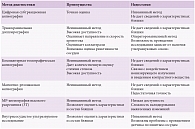
Таблица. Преимущества и недостатки методов визуализации при интракраниальном атеросклерозе
Введение
Атеросклероз интракраниальных артерий является одной из наиболее частых причин инсульта во всем мире. По данным эпидемиологических исследований, развитие острого нарушения мозгового кровообращения на фоне этой патологии зависит от расы. У европеоидов симптомный интракраниальный атеросклероз (то есть поражение артерий, вызвавшее транзиторную ишемическую атаку или инсульт) встречается в 10% случаев, тогда как у представителей негроидной и азиатской расы этот показатель достигает 30 и 50% соответственно [1–6]. Такое различие обусловлено генетической предрасположенностью к развитию заболевания, а также различиями в образе жизни и типичных факторах риска [2]. Частота асимптомного атеросклероза достигает 54% случаев у азиатов и 12% среди представителей других рас [2, 7–9].
Как правило, выраженный асимптомный атеросклероз внутричерепных артерий сочетается с другими сосудистыми факторами риска, которые обычно и служат основанием для обследования таких пациентов. С поражением внутричерепных артерий ассоциирована высокая частота повторного острого нарушения мозгового кровообращения – по данным исследования WASID, до 19% в течение ближайших двух лет [10]. На частоту повторного инсульта влияют также морфологические характеристики, в частности стеноз > 70%, женский пол и время, прошедшее с момента предыдущего ишемического эпизода (менее 17 дней).
Патофизиологические аспекты атеросклероза интракраниальных артерий
К непосредственным причинам развития инсульта при атеросклерозе интракраниальных артерий относятся:
- гипоперфузия ткани мозга с инфарктом в зонах смежного кровоснабжения, связанная с декомпенсацией процессов ауторегуляции мозгового кровотока, особенно в условиях нарушения системной гемодинамики;
- артерио-артериальная эмболия, следствием которой, как правило, является инфаркт клиновидной формы;
- наличие атеросклеротической бляшки в устье малой перфорирующей артерии, что приводит к формированию небольших инфарктов.
Высокая частота повторных инфарктов, как правило, обусловлена именно нарушением ауторегуляции мозгового кровотока в условиях выраженного стеноза [11]. Зная механизм развития первого инсульта, можно прогнозировать механизм повторного нарушения: так, у пациентов с небольшими инфарктами вследствие окклюзии малой артерии повторный инсульт, как правило, развивается по другому типу и локализуется дистальнее пораженной артерии [12]. Чаще всего атеросклеротическое поражение локализуется в средней мозговой артерии (до 27% [13]) и внутренней сонной артерии (каменистой, кавернозной и супраклиноидной части), реже в основной артерии и интракраниальном сегменте позвоночной артерии [10, 14].
Считается, что даже субстенозирующее поражение артерий может стать причиной острого нарушения мозгового кровообращения по аналогии с атеросклеротическими изменениями коронарных артерий, которые могут вызывать инфаркт миокарда на фоне относительно нетяжелого стеноза. Эта угроза связана с воспалительными процессами, которые происходят во время возникновения, прогрессирования и повреждения бляшки и приводят к разрыву покрышки бляшки и формированию тромбоза и инфаркта.
Диагностика
Для диагностики атеросклероза интракраниальных артерий используются ультразвуковые методы (транскраниальная допплерография), магнитно-резонансная (МР), компьютерная томографическая (КТ) (рис. 1 и 2) и цифровая субтракционная ангиографии (таблица). Последний метод считается золотым стандартом диагностики [15], поскольку позволяет точно определить степень стеноза артерии. Вместе с тем цифровая субтракционная ангиография – это инвазивное вмешательство, которое предполагает введение контрастного вещества. Кроме того, метод сопряжен с развитием преходящего и стойкого неврологического дефицита, частота которого может достигать 1,8 и 0,6% соответственно [16].
В отношении точности более безопасных и доступных неинвазивных методов однозначные данные отсутствуют. Так, при МР-ангиографии визуализация просвета сосуда зависит от тока крови в нем, при этом истинная выраженность поражения сосуда может искажаться в случае критического стеноза с очень низким кровотоком (он может выглядеть как окклюзия) и при стенозах большой степени с высокой скоростью кровотока.
Считается, что транскраниальная допплерография и МР-ангиография могут использоваться в качестве скрининга для исключения поражения интракраниальных артерий, но они недостаточно надежны для подтверждения наличия стеноза и определения степени его выраженности [17]. В то же время транскраниальная допплерография дает дополнительную информацию, с помощью которой можно оценить кровоток по коллатеральным сосудам и определить цереброваскулярную реактивность.
КТ-ангиография превосходит МР-ангиографию по точности диагностики [18, 19] и обладает наивысшей после прямой ангиографии чувствительностью и специфичностью выявления стеноза > 50% [20]. Кроме того, КТ- или МР-ангиография могут быть дополнены методиками оценки мозгового кровотока – перфузионной компьютерной или магнитно-резонансной томографией. Как правило, последние входят в стандартный протокол исследования и позволяют выявить зоны гипоперфузии, возникающие в условиях длительно существующего стеноза и не проявляющиеся клинически.
Классический подход к диагностике, направленный только на установление степени сужения артерии, обладает рядом недостатков – в частности, невозможно установить гистологическое строение и, следовательно, степень «нестабильности» атеросклеротической бляшки, а также дифференцировать атеросклеротический стеноз от сужения просвета артерии, вызванного другими причинами.
В настоящее время особое значение приобретают новые технологии визуализации, такие как магнитно-резонансная томография высокого разрешения и внутрисосудистое ультразвуковое исследование – методики, благодаря которым можно изучить саму атеросклеротическую бляшку. Это особенно важно на ранних стадиях атеросклеротического процесса, когда просвет сосуда еще не сужен вследствие ремоделирования. Так, магнитно-резонансная томография, выполненная на аппарате с напряженностью магнитного поля 3T, дает возможность непосредственно визуализировать тромб, кровоизлияние в бляшку и определить состав бляшки, то есть оценить активность бляшки [21].
Внутрисосудистое ультразвуковое исследование также позволяет выявить кровоизлияние в бляшку, установить ее состав и протяженность. Это может повлиять на определение риска и, следовательно, на выбор тактики лечения.
Таким образом, новые методы исследования особенно важны при обследовании пациентов с инсультом и нестенозирующим повреждением интракраниальных артерий, когда причиной инфаркта может быть повреждение бляшки, не выявляемое с помощью классических методов визуализации [22].
Клинические проявления
К наиболее серьезным клиническим проявлениям атеросклероза интракраниальных артерий относятся транзиторная ишемическая атака и ишемический инсульт, симптомы которых соответствуют локализации поражения. Для стеноза средней мозговой артерии, как правило, характерны лакунарные инфаркты и ишемия в зоне смежного кровоснабжения. Стеноз внутренней сонной артерии сопровождается развитием более обширных очагов и вовлечением серого вещества. Неврологический дефицит в этом случае оказывается более выраженным, чем при стенозе средней мозговой артерии [23].
Помимо двигательных и чувствительных нарушений в случае поражения серого вещества, таламуса или хвостатого ядра у пациентов могут отмечаться когнитивные расстройства. Когнитивные нарушения могут также развиваться и в отсутствие инфарктов вследствие снижения церебральной перфузии и связанных с этим изменений белого вещества мозга. Наконец, возможно асимптомное течение атеросклеротического процесса. Клиническая симптоматика наблюдается при наличии ряда факторов, среди которых необходимо отметить степень стеноза и строение коллатеральных сосудов [24]. Симптомами обычно сопровождается поражение средней мозговой артерии, основной артерии и интракраниальной части позвоночной артерии, тогда как изменения передней и задней мозговых артерий чаще всего протекают асимптомно [25].
Атеросклероз интракраниальных артерий может прогрессировать, стабилизироваться или регрессировать [26]. Принято считать, что у асимптомных пациентов исход заболевания более благоприятен. Так, при анализе данных исследования TOSS-2 прогрессирование поражения наблюдалось в 13% случаев у пациентов с симптомным атеросклерозом и лишь в 6% случаев при асимптомном стенозе [27]. По результатам обследования 102 пациентов со значимым стенозом или окклюзией средней мозговой артерии риск инсульта у пациентов с симптомным поражением составлял 12,5% в год и лишь 2,8% в год у асимптомных больных [28]. При асимптомной бляшке средней мозговой артерии можно прогнозировать относительно благоприятный исход: такие бляшки часто бывают кальцинированными и, следовательно, не отличаются высоким риском эмболии [29].
В ряде исследований были выявлены различия между локализацией стеноза и течением заболевания [30]. Очевидно, прогноз заболевания при окклюзии основной артерии хуже, чем при окклюзии внутренней сонной или средней мозговой артерии [31].
Профилактика и лечение
Основной целью лечения у пациентов с симптомным атеросклерозом интракраниальных артерий является предотвращение повторного острого нарушения мозгового кровообращения. С этой целью проводятся следующие мероприятия:
- контроль артериального давления (систолическое артериальное давление ≥ 140 мм рт. ст. значимо повышает риск инсульта
в соответствующем артериальном бассейне);
- устранение дислипидемии (общий холестерин ≤ 5,1 ммоль/л
и липопротеины низкой плотности ≤ 1,8 ммоль/л);
- агрессивная коррекция других факторов риска (нормализация массы тела, увеличение физической активности, отказ от курения, поддержание нормогликемии) в соответствии с рекомендациями по вторичной профилактике инсульта [32];
- антитромботическая терапия.
Предпочтение отдается монотерапии антиагрегантами. В то же время имеются данные, что для предотвращения повторного инсульта в ранние сроки после первого сосудистого эпизода больший эффект демонстрирует двойная антиагрегантная терапия. В исследовании SAMMPRIS у пациентов, получавших аспирин и клопидогрел в течение 90 дней с последующей терапией только аспирином в сочетании с интенсивной коррекцией факторов риска, частота повторного инсульта в первые 30 дней составила 5,8% [33].
Основываясь на результатах наиболее крупных исследований, монотерапию аспирином в дозе 325 мг/сут в сочетании с интенсивной коррекцией факторов риска можно рекомендовать пациентам с умеренным стенозом
(< 70%) крупной интракраниальной артерии или пациентам с транзиторной ишемической атакой/ишемическим инсультом давностью более 30 дней независимо от степени стеноза. У пациентов с недавним (< 30 дней) ишемическим эпизодом и тяжелым стенозом (70–99%) предпочтительна двойная антиагрегантная терапия: клопидогрел 75 мг/сут и аспирин 325 мг/сут в течение 90 дней. Медикаментозное лечение также должно сочетаться с интенсивной коррекцией факторов риска [34]. Затем клопидогрел следует отменить при отсутствии других показаний к его применению и перейти на монотерапию аспирином в дозе 325 мг/сут. Более длительное лечение двумя антиагрегантными препаратами нецелесообразно в связи с увеличением риска геморрагических осложнений.
В течение многих лет предпринимались попытки хирургического лечения атеросклеротического стеноза интракраниальных артерий и его последствий. Наиболее ранней и самой изученной операцией является наложение экстраинтракраниального анастомоза, однако результаты проведенных в 1980-х гг. и в 2011 г. исследований не подтвердили ее эффективность и в настоящее время эта операция не имеет широкого распространения [35].
На сегодняшний день применяются такие методики хирургического лечения интракраниального атеросклероза, как эндоваскулярные вмешательства с использованием баллонной ангиопластики, баллонной ангиопластики со стентированием и с установкой саморасправляющихся стентов. Последние характеризуются высокой частотой технического успеха и относительным удобством установки, поскольку не требуют использования баллона и могут быть доставлены в сложные для прохождения участки артериального русла. Однако в крупном рандомизированном исследовании SAMMPRIS эндоваскулярное вмешательство оказалось менее безопасным и эффективным, чем медикаментозное лечение [33]. В результате ни один эндоваскулярный метод не был одобрен в качестве предпочтительного вмешательства. Возможными показаниями к проведению эндоваскулярной операции у 70–99% пациентов с атеросклерозом могут быть симптомы вследствие нарушений системной гемодинамики, а также плохое развитие коллатералей и рецидивирующие острые нарушения мозгового кровообращения, несмотря на агрессивное медикаментозное лечение и коррекцию факторов риска [35].
У пациентов с асимптомным атеросклерозом интракраниальных артерий целесообразно проведение первичной профилактики церебральной ишемии с учетом выявленных факторов риска. Принимая во внимание возможность прогрессирования атеросклеротического поражения, целесообразно отслеживать состояние артерий с интервалом около двух лет [36].
Развитие стеноза интракраниальных артерий сопровождается нарушением ауторегуляции мозгового кровотока и формированием зон со сниженной перфузией, поэтому таким пациентам уместно назначать препараты, обладающие нейротрофическим, метаболическим и антигипоксическим эффектом. Примером может служить Актовегин – всесторонне изученный препарат с плейотропным эффектом и благоприятным профилем безопасности.
В ряде зарубежных рандомизированных плацебоконтролируемых исследований показана эффективность Актовегина у пожилых пациентов с признаками легкой и умеренной деменции различного генеза, в том числе и сосудистого [37]. Его применение сопровождалось улучшением поведенческих характеристик и результатов нейропсихологических тестов. Обширный опыт российских исследователей подтверждает эффективность препарата у пациентов с хронической ишемией головного мозга, сопровождающейся когнитивными расстройствами [38]. Актовегин позитивно влиял не только на показатели памяти и внимания, но также улучшал психоэмоциональный статус пациентов – уменьшал выраженность депрессивных, астенических симптомов, улучшал сон и общее самочувствие [39, 40].
Доказанный эндотелиопротективный эффект Актовегина и позитивное влияние на микроциркуляцию, вероятно, дают дополнительные терапевтические преимущества у пациентов с когнитивными расстройствами, возникшими вследствие хронической церебральной ишемии, сопровождающейся тканевой гипоксией, микро- и макрососудистым повреждением [41].
Таким образом, включение Актовегина в схему лечения пациентов с интракраниальным атеросклерозом наряду с мерами по профилактике сосудистых событий может способствовать нивелированию проявлений недостаточности мозгового кровообращения и улучшению самочувствия таких пациентов.
Заключение
Атеросклероз интракраниальных артерий – существенный фактор развития острого нарушения мозгового кровообращения, требующий особого подхода к диагностике и лечению. Дальнейший прогресс в изучении проблемы диагностики и лечения атеросклероза интракраниальных артерий связан с новыми методиками визуализации сосудов и атеросклеротической бляшки и поиском индивидуальных подходов к лечению, включая определение показаний к эндоваскулярным вмешательствам.
