Использование оценки состояния адаптивной иммунной системы у больных со злокачественными солидными опухолями в качестве предиктивных или прогностических факторов: систематический обзор
- Аннотация
- Статья
- Ссылки
- English
Исходя из результатов систематического обзора можно предположить, что высокое содержание эффекторных субпопуляций является благоприятным фактором, способствующим увеличению эффективности лечения и продолжительности жизни, в то время как содержание регуляторных клеток иммунной системы играет обратную роль. Прогностическая и предиктивная роль данных показателей в В-клеточном звене иммунной системы у пациентов со злокачественными опухолями, вероятно, менее значима, чем оценка Т-клеточного звена. Однако выявленная нелинейность взаимосвязей этих показателей с конечными точками исследований требует обязательного учета данных параметров в комплексной оценке противоопухолевого иммунного ответа.
Теоретически можно предположить ряд состояний, повышающих или снижающих эффективность лечения. Мы можем предполагать наличие четких иммунологических сигналов, свидетельствующих о наличии или отсутствии эффекта от проводимого лечения. На основании имеющихся данных литературы сложно сформулировать четкие критерии и последовательность развития подобных состояний. Необходим комплексный анализ иммунологических показателей для оценки отдельных компонентов иммунной системы при всех выявленных состояниях, определения профилей иммунологической реактивности и их влияния на эффективность лечебных подходов.
Исходя из результатов систематического обзора можно предположить, что высокое содержание эффекторных субпопуляций является благоприятным фактором, способствующим увеличению эффективности лечения и продолжительности жизни, в то время как содержание регуляторных клеток иммунной системы играет обратную роль. Прогностическая и предиктивная роль данных показателей в В-клеточном звене иммунной системы у пациентов со злокачественными опухолями, вероятно, менее значима, чем оценка Т-клеточного звена. Однако выявленная нелинейность взаимосвязей этих показателей с конечными точками исследований требует обязательного учета данных параметров в комплексной оценке противоопухолевого иммунного ответа.
Теоретически можно предположить ряд состояний, повышающих или снижающих эффективность лечения. Мы можем предполагать наличие четких иммунологических сигналов, свидетельствующих о наличии или отсутствии эффекта от проводимого лечения. На основании имеющихся данных литературы сложно сформулировать четкие критерии и последовательность развития подобных состояний. Необходим комплексный анализ иммунологических показателей для оценки отдельных компонентов иммунной системы при всех выявленных состояниях, определения профилей иммунологической реактивности и их влияния на эффективность лечебных подходов.








Введение
В последние годы достигнуты значительные успехи в области иммунотерапии солидных опухолей. Однако новые подходы к лечению обозначили круг проблем, требующих разрешения для успешной реализации данных терапевтических методик. Речь прежде всего идет о проблеме выбора метода лечения на основании имеющейся клинической информации, то есть проблеме оценки биологических маркеров эффективности терапии. Характеристики иммунной системы (ИС) являются естественным фактором, позволяющим рассчитывать на успешное решение данной задачи.
Оценка состояния ИС в клинических исследованиях проводилась для решения трех основных задач:
- использования иммунологических параметров в качестве факторов прогнозирования эффективности терапии или течения заболевания;
- оценки механизмов действия препаратов;
- определения фармакодинамических параметров воздействия препарата на организм.
Для клинического применения в повседневной практике может быть использовано только решение первой задачи. Мы оценили прогностическую и предиктивную роль параметров ИС у пациентов со злокачественными солидными опухолями. В статье проанализированы маркеры, характеризующие состояние адаптивной ИС.
Материал и методы
Для оценки информации о прогностической или предиктивной роли показателей ИС и возможности их использования для выделения групп пациентов с разными иммунологическими характеристиками или различным потенциальным ответом на лечение нами был проведен систематический обзор публикаций в системах PubMed и eLIBRARY на английском и русском языках соответственно. Стратегия поиска публикаций в указанных системах представлена в приложении. Критериями включения публикаций в обзор были:
- клинические исследования;
- наличие злокачественной солидной опухоли у включенных в исследования пациентов;
- возраст больных от 18 лет и старше;
- более 20 объектов наблюдения в одной группе;
- отсутствие у больных измененного состояния ИС, включая:
- ВИЧ-инфекцию и ассоциированные с ней заболевания;
- активную инфекцию вирусами гепатита В или С;
- состояние на фоне или после трансплантации костного мозга или гемопоэтических стволовых клеток;
- оценка одного или нескольких параметров, характеризующих адаптивную иммунную систему:
- NKT-клетки, Т-хелперы (Th), цитотоксические Т-лимфоциты (ЦТЛ), CD1d+-лимфоциты, CD3+CD27+CD62L+, CD3+CD28+CD62L+,CD3+CD38+CD4+, CD3+CD4+CTLA4+,T-регуляторные (Treg) клетки (CD4+25+bright CD127low или CD4+CD25+bright FoxP3+), CD3+CD4+CD8+,CD3+CD4-CD8-, наивные Т-лимфоциты, Т-клетки памяти, В-лимфоциты;
- уровень иммуноглобулинов и циркулирующих иммунных комплексов (ЦИК);
- экспрессия CD25, CD38, CD71, CD95, HLA-DR, NKG2D на клетках иммунной системы;
- отношение CD3 к Th4, Th к ЦТЛ, NKT к ЦТЛ, Treg к ЦТЛ;
- показатели спонтанной и активированной миграции клеток;
- определение прогностической или предиктивной роли параметра, в том числе связь иммунологических показателей:
- со стадией заболевания;
- выживаемостью без прогрессирования (ВБП);
- частотой объективного ответа;
- общей выживаемостью (ОВ).
Поскольку в значительной части публикаций, размещенных в системе eLIBRARY, отсутствовали аннотации, дополнительно был осуществлен поиск по фамилиям авторов – членов научных коллективов (прежде всего руководителей), занимающихся изучением иммунологических показателей у больных со злокачественными опухолями. Схема обработки публикаций представлена на рисунке.
Детальное описание каждого включенного в обзор исследования представлено в приложении. В статье упоминаются только исследования, в которых проводилась оценка показателей адаптивной ИС.
Состояние Т-клеток как фактор прогноза при злокачественных опухолях
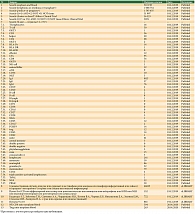
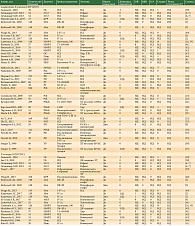
При анализе роли Т-лимфоцитов в качестве биомаркеров нами были использованы четыре основных направления поиска: анализ содержания Т-клеток и соотношение их субпопуляций – иммунорегуляторный индекс, анализ маркеров активации Т-лимфоцитов (прежде всего CD25 и HLA-DR), оценка супрессорных субпопуляций Т-лимфоцитов и специфических клонов Т-лимфоцитов (табл. 1). В систематический обзор были включены 292 группы (n = 26 204) [1–9, 11, 13–15, 18, 19, 21–28, 31, 33, 34, 39–82, 84–86].
Общее содержание Т-клеток оказалось значимым фактором при прогнозировании рецидивов колоректального рака [1] и оценке эффективности терапии ипилимумабом у больных меланомой кожи [2]. В противовес этим данным при терапии меланомы кожи интерфероном альфа в адъювантном режиме [3] или ипилимумабом при неоперабельном распространенном процессе таких закономерностей не выявлено [4]. При раке молочной железы [5] и различных солидных опухолях [6, 7] связи с эффективностью лечения не установлено. В значительной части исследований взаимосвязь между этим показателем и стадией заболевания не отмечалась.
Общее содержание Т-хелперов в периферической крови изучали в ряде исследований. В одних [2] показано, что более низкий уровень данных клеток в периферической крови у больных меланомой кожи, получавших ипилимумаб, ассоциируется с худшими показателями ОВ. В других связь содержания CD4+-лимфоцитов в периферической крови с эффектом химиотерапии у больных раком молочной железы [5] или применения фактора некроза опухоли альфа у больных меланомой кожи [6–8] не прослеживалась.
В некоторых исследованиях изучали субпопуляции Т-хелперов. Так, S.J. Sante и соавт. [9] показали, что повышение уровня наивных Т-хелперов (CD4+CD45R0-) и снижение клеток эффекторной памяти (CD4+CD45R0+) ассоциируются с повышением ОВ у больных кастрационно-резистентным раком предстательной железы, получавших вакцинотерапию в сочетании с ипилимумабом. Интересно, что в этом же исследовании повышенный уровень Т-лимфоцитов, экспрессирующих CTLA4, до начала лечения был связан с повышением ОВ. Отметим, что CTLA4 – мишень для воздействия ипилимумаба является антагонистом костимулирующего рецептора CD28, практически постоянно экспрессирующегося на наивных Т-лимфоцитах [10]. Таким образом, можно предположить, что иммунный ответ в данном исследовании пропорционален количеству наивных Т-лимфоцитов, которые можно было специфически активировать в процессе терапии.
В других исследованиях у больных меланомой кожи, получавших ипилимумаб, подобные различия были статистически незначимы [4]. На фоне применения ниволумаба наблюдалось увеличение уровня клеток эффекторной памяти у больных, достигших объективного ответа на лечение [11].
Одной из наиболее значимых для развития злокачественного процесса субпопуляций Т-хелперов являются Treg, имеющие выраженную конститутивную (врожденную) экспрессию CD25, FoxP3 и слабо или не экспрессирующие CD127. Их предиктивная роль при проведении терапии анти-PD1-препаратами показана в ряде исследований [12]. Вместе с тем в некоторых исследованиях роль этих клеток противоречива. Если при глиобластоме повышение данной субпопуляции до лечения увеличивало риск смерти [13], то при использовании ипилимумаба у больных меланомой кожи, наоборот, наблюдалось повышение уровня этих клеток относительно доноров у пациентов с наибольшей продолжительностью жизни [2].
Уровень цитотоксических Т-лимфоцитов (CD3+CD8+) теоретически может иметь особое значение для прогноза, поскольку именно эти клетки реализуют противоопухолевый специфический иммунный ответ. Ряд клинических исследований [14, 15] подтверждает это предположение, тогда как в других исследованиях [5–7] такой связи не установлено. Интересно, что увеличение уровня ЦТЛ было связано с повышением качества жизни, а именно улучшением когнитивных/физиологических функций [16] у больных раком молочной железы.
Повышение пролиферативной активности Т-лимфоцитов сразу после начала терапии анти-PD-1-препаратами по поводу меланомы кожи наблюдалось у пациентов, ответивших на лечение, что подтверждает наше предположение о значимости этой популяции Т-лимфоцитов для развития эффективного ответа на лечение [17].
При раке легкого подобная популяция клеток была больше у ответивших на лечение больных и состояла из клеток, экспрессирующих CD27 и CD28, что говорит об их «наивном» характере [12].
О значимости анализа популяций клеток памяти среди эффекторных лимфоцитов свидетельствуют исследования Y.P. Coana и соавт. [4], в которых показана значимость повышения уровня таких клеток при увеличении ОВ. Похожие закономерности с клетками эффекторной памяти выявлены в упоминавшемся исследовании S.J. Santegoets и соавт. [9].
Функциональные показатели активности Т-клеток оценивались в качестве прогностических факторов в небольших исследованиях. Установлено, что более низкие уровни спонтанной миграции лимфоцитов и повышенные уровни стимулированной фитогемагглютинином миграции наблюдались у больных раком вульвы I–IV стадии без рецидива после проведенного лечения [18]. Связи между показателями эффективности химиотерапии или гормонотерапии при раке молочной железы не выявлено [19].
Уровень маркеров активации Т-лимфоцитов может также быть важным фактором, свидетельствующим о функциональном состоянии ИС. Выделяют несколько маркеров активации: ранней – CD25+ и поздней – СD71+ и HLA-DR+, последовательно экспрессирующихся на поверхности Т-лимфоцитов в процессе развития иммунного ответа [20]. Важным показателем активности Т-клеток также является уровень CD95 – маркер апоптоза.
Содержание активированных Т-лимфоцитов, особенно их супрессорных популяций, активно изучалось различными коллективами авторов. В ходе исследований получены данные о нарастании содержания CD4+CD25+ Т-лимфоцитов, что может свидетельствовать об истощении иммунного ответа по мере прогрессирования раннего рака молочной железы [21]. Напротив, в наших исследованиях более высокое содержание данных клеток наблюдалось у больных меланомой кожи с развившимся клиническим ответом на терапию дакарбазином [14]. Более высокий уровень регуляторных Т-лимфоцитов отмечен в группе больных глиальными опухолями с более высокими показателями ОВ [22]. В целом можно предположить негативное влияние данных субпопуляций на показатели выживаемости и эффективности и их ассоциацию с повышенной стадией опухолевого процесса.
Оценка уровня экспрессии СD71 не позволила выявить его предиктивной ценности [6, 7]. Более значимыми оказались изменения уровня HLA-DR-антигена. Изменения данного маркера наблюдались у больных меланомой IV стадии, при этом связи с прогнозом или изменений показателя в динамике не выявлено [2]. В отдельных исследованиях установлена связь между уровнем экспрессии HLA-DR и стадией заболевания при раке желудка [23] и немелкоклеточном раке легкого [24]. В других исследованиях связь между уровнем HLA-DR+-клеток и известными прогностическими факторами или показателями выживаемости не прослеживалась [3, 25].
Содержание CD38+- и CD95+-клеток изучали в небольшом числе исследований, однако прогностическая и предиктивная значимость таких клеток не показана [5–7]. В ряде исследований зафиксировано повышение CD95+-клеток с увеличением стадии Т у больных первичным раком молочной железы [21] и снижение содержания этих клеток в группе неблагоприятного прогноза при раке яичников [26].
Еще одной популяцией, обладающей регуляторными свойствами, являются NKT-клетки, то есть Т-лимфоциты, экспрессирующие маркеры NK-клеток (CD3+CD16+CD56+). В исследованиях их роль оказалась двоякой. Выявлено повышение уровня этих клеток относительно доноров при начальных, но не при местнораспространенных стадиях рака молочной железы [27]. При меланоме [27] и раке почки [8], напротив, наблюдались более частое прогрессирование и худшие показатели ОВ при увеличении содержания этих клеток в крови. Важно, что при раке почки уровень NKT-клеток был независимым от критериев MSKCC фактором прогноза.
Соотношение Th и ЦТЛ – иммунорегуляторный индекс, вероятно, лучше демонстрирует возможности иммунной системы в подавлении опухолевого роста, поскольку отражает соотношение эффекторных и тормозных сигналов в Т-клеточном звене. Это подтверждается ростом данного индекса по мере увеличения стадии раннего рака молочной железы [28]. Однако в других исследованиях прогностического значения данного индекса не выявлено [3]. Возможно, причиной являлось схожее изменение показателя на различных стадиях опухолевого процесса [24].
Баланс Т-хелперов и поляризация иммунного ответа в сторону Т- или В-лимфоцитов могут иметь практическое значение при прогнозировании нежелательных явлений. Так, при изучении фебрильной нейтропении указанный фактор был единственным, позволившим предсказывать данное состояние [29].
Таким образом, результаты систематического обзора позволяют предположить, что высокое содержание эффекторных субпопуляций служит благоприятным фактором, способствующим увеличению эффективности лечения и продолжительности жизни, тогда как содержание регуляторных клеток играет отрицательную роль. Многие параметры отражают сходные процессы, происходящие в иммунной системе. Противоречивость результатов некоторых исследований требует комплексной оценки изучаемых показателей в рамках одного анализа для выявления клинически значимых ассоциаций данных, позволяющих индивидуализировать терапию или использовать выявленный иммунологический синдром как основание для проведения лечебных воздействий.
Состояние В-клеток как фактор прогноза при злокачественных опухолях
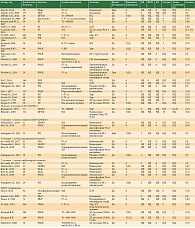
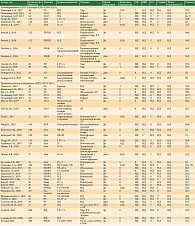
В наш систематический обзор, посвященный оценке состояния В-клеточного звена иммунной системы, вошли 54 группы, включавшие 4997 пациентов со злокачественными солидными опухолями [2, 3, 8, 14, 19, 23–25, 30–34, 39–42, 44, 48–53, 55–57, 60, 64] (табл. 2).
Несмотря на то что В-лимфоциты не являются основными эффекторами противоопухолевого иммунного ответа, их повышенное содержание может рассматриваться как фактор прогноза эффективности лечения [2, 14]. Однако это взаимодействие разнонаправленное и может быть нелинейным [2]. Установлена связь между улучшением качества жизни по гастроинтестинальной шкале и содержанием В-клеток в крови больных первичным раком молочной железы на фоне комплексного лечения [16]. Возможно, большую значимость имеют субпопуляции B-регуляторных лимфоцитов, повышение которых приводило к ухудшению показателей выживаемости больных раком желудка, получавших химиотерапию по схеме XELOX [30].
Высокие уровни этих лимфоцитов имели благоприятное прогностическое и предиктивное значение во всех исследованиях, несмотря на отсутствие статистически значимых различий в некоторых из них [8].
Уровни иммуноглобулинов (Ig) также могут иметь разностороннее значение в прогнозе заболевания. В исследованиях показана связь уровней IgA, IgG и IgM с прогнозом в отдельных когортах пациентов [31–33]. При этом значения отклонений в уровнях Ig нередко носили противоречивый характер.
Еще одним фактором комплексной оценки как В-клеточного звена, так и эндогенной интоксикации является оценка содержания циркулирующих иммунных комплексов в крови. В отдельных исследованиях пониженное содержание данных структур наблюдалось у больных без рецидива рака вульвы после проведенного лечения [34].
Обобщая исследования В-клеточного звена ИС, необходимо отметить, что прогностическая и предиктивная роль данных показателей у больных со злокачественными опухолями, вероятнее всего, менее значима, чем оценка Т-клеточного звена ИС. Однако выявленная нелинейность взаимосвязей В-клеточного звена с исходами заболевания требует обязательного учета данных параметров в комплексной оценке состояния ИС.
Использование комплексных оценок состояния ИС для определения клинической тактики
Возможность оценки множественных характеристик ИС обусловливает необходимость введения комплексных оценок показателей. Одним из вариантов решения данной проблемы является создание сложных прогностических индексов или нормограмм, учитывающих сразу несколько факторов. К одному из таких решений относится неаполитанский прогностический индекс, учитывающий одновременно NLR, LMR, уровень альбумина и холестерина. У больных раком желудка повышение данного индекса системного воспаления существенно снижает показатели общей выживаемости больных колоректальным раком, получающих первую линию химиотерапии [35].
Как показали результаты кластеризации пациентов [36, 37] по основным показателям иммунного статуса, могут быть выделены варианты иммунного реагирования пациентов на злокачественную опухоль (преимущественно на больных раком почки): активация адаптивного иммунного ответа (повышение суммарного содержания Т- и NK-клеток, B-лимфоцитов и иммуноглобулинов), активация врожденного иммунного ответа (повышение нейтрофилов, незрелых гранулоцитов, моноцитов при повышенном или референсном уровне NKT-клеток, на фоне нормального или пониженного уровня Т- и NK-клеток, а также В-лимфоцитов, повышения IgM и IgE), подавление всех звеньев иммунной системы (понижение Т- и NK-клеток с референсным или пониженным уровнем всех остальных показателей) и отсутствие реакции иммунной системы (все показатели в пределах референсных значений). Реже могут наблюдаться еще два варианта: дизрегуляторное состояние (повышение нейтрофилов, классических моноцитов (CD14+CD16-) и В-клеток при снижении Т- и NK-клеток) и гиперактивация адаптивной ИС (референсные значения нейтрофилов и моноцитов при повышенном содержании Т-, В- и NK-клеток и высоком уровне Ig всех классов). В исследованиях этого коллектива авторов вариант иммунного реагирования был связан с прогнозом пациентов.
Похожие результаты были получены другой группой исследователей при изучении местнораспространенной и метастатической меланомы кожи [38]. В исследованиях также выделялось четыре варианта иммунного реагирования ИС на заболевание: умеренная супрессия, нормальная реакция, активация и гиперактивация. Сравнив варианты иммунного реагирования с ранее описанной системой, можно утверждать, что активация эквивалентна повышению активности адаптивной ИС (повышение уровня CD8+ Т-лимфоцитов, сопоставимый с ними уровень CD38+-клеток при уровне моноцитов и CD4+-клеток в пределах референсных значений), нормореакция соответствует отсутствию реакции ИС на опухоль, умеренная супрессия отражает состояние дизрегуляции (повышенное содержание HLA-DR-клеток и моноцитов при лимфопении за счет как CD8+, так и CD4+; уровень CD38+ при этом также понижен и сопоставим с уровнем ЦТЛ). Гиперактивация иммунного ответа при этом отражает как избыточную активность эффекторов врожденной ИС (повышение моноцитов и лимфоцитов, LMR около 1, повышение HLA-DR+-клеток), так и высокую активность CD4+- и CD8+-клеток. При этом уровень CD38+-лимфоцитов значительно превышает уровень CD8+-клеток. Важно, что в исследованиях этих авторов показана наиболее неблагоприятная прогностическая значимость именно варианта гиперактивации ИС.
Таким образом, теоретически может быть предположен ряд состояний, открывающих возможности достижения или препятствующих развитию эффекта лечения. Мы можем предполагать наличие четких иммунологических сигналов, свидетельствующих о наличии или отсутствии эффекта проводимого лечения. На основании имеющихся данных литературы сложно сформулировать четкие критерии и последовательность развития подобных состояний. Необходим комплексный анализ иммунологических показателей для оценки отдельных компонентов ИС при всех выявленных состояниях, определения профилей иммунологической реактивности при «иммуночувствительных» и «не чувствительных» к иммунологическим воздействиям опухолей и влияния этих профилей на эффективность лечебных подходов.
ПРИЛОЖЕНИЕ
Стратегия поиска в систематическом обзоре и описание включенных исследований
A.V. Novik, PhD, S.A. Protsenko, PhD, Prof., I.A. Baldueva, PhD
N.N. Petrov National Medical Research Center of Oncology
Saint-Petersburg State Pediatric Medical University
Contact person: Alexey V. Novik, anovik@list.ru
Immune system assessment may be used as a predictive or prognostic marker in patients with solid tumors. To check this hypothesis, we performed a systematic review of clinical trial papers in PubMed and eLIBRARY systems where parameters of the adoptive immune system were assessed. We found 76 trials with 336 groups of patients (292 for T-cells and 54 for B-cells), totally with 31 201 patients included.
We can propose that a high amount of effector subpopulations of T-cells is a favorable factor for therapeutic efficacy and survival. In contrast, the high regulatory subsets level has the opposite role. Prognostic and predictive role of B-cells is less critical. Yet, nonlinear interactions of these cells with the endpoints of the studies promote the inclusion of B-cells parameters in the complex models of antitumor immunity.
Literature data collected supports the possibility to define distinct conditions of the immune system that can enhance or decrease the efficacy of different therapeutic approaches. We can propose the presence of clear immunological signals accompanying the therapeutic effect development. It is hard now to form the definitions of these conditions. Complex analysis of immunologic parameters is needed for the description of the condition properties. Immune reactivity profiling is essential in immune responsive and immune resistant tumors to assess their interaction with therapy efficacy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.