Mодель прогнозирования прогрессирования солидной опухоли на фоне лекарственной терапии с применением методов искусственного интеллекта
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование были включены больные с иммуногенными (295 с меланомой, 81 с раком почки) и неиммуногенными (47 с саркомой мягких тканей, 26 с колоректальным раком), а также с первично-множественными опухолями (29), у которых иммунологическая оценка проводилась до (23,5%), на фоне (58,3%) и по завершении (18,2%) лечения. Пациенты были рандомизированы в соотношении 3:1 в тренировочную (1682 оценки иммунной системы) и контрольную (616 оценок) группы. Проанализированы иммунологические (содержание Т-, B- и NK-лимфоцитов, цитотоксических лимфоцитов, Т-хелперов) и клинические (возраст, пол, заболевание, стадия, мутационный статус, ответ на лечение, длительность заболевания и лечения, характер предшествующего лечения) факторы.
На основании анализа указанных факторов с использованием градиентного бустинга CatBoost разработана модель для прогнозирования прогрессирования опухоли в ближайшие три месяца.
Влияние результатов прогнозирования на показатели общей выживаемости (ОВ) и времени до прогрессирования (ВДП) оценивалось с использованием методов Каплана – Мейера и Кокса.
Результаты. Площадь под кривой ошибок полученной модели составила 0,801.
При прогнозе прогрессирования заболевания по данным модели его частота увеличивалась с 37,5 до 62,0%, вероятность ответа на терапию снизилась с 37,5 до 8,4% (р = 0,016). Предполагаемое прогрессирование заболевания не добавляло дополнительной информации к известным прогностическим факторам ОВ. Однако оно служило независимым фактором риска прогрессирования процесса (относительный риск – 2,204, р = 0,011). Ложноположительные результаты позволили выделить среди пациентов, ответивших на терапию, группу с неблагоприятным течением заболевания (медиана ОВ – 16 месяцев, ВДП – 6 месяцев). При истинно отрицательном результате наблюдалось повышение ОВ до 61 месяца, ВДП до 18 месяцев (р = 0,03). Возможность улучшения прогноза при смене терапии была независимым фактором прогноза ВДП (р < 0,001). Модель также позволяла выделить больных с повышенной ОВ при прогрессировании заболевания (р = 0,033).
Вывод. Построенная модель прогнозирования прогрессирования процесса предоставляет дополнительную клинически значимую информацию. Целесообразно проспективное тестирование данного подхода.
Материал и методы. В исследование были включены больные с иммуногенными (295 с меланомой, 81 с раком почки) и неиммуногенными (47 с саркомой мягких тканей, 26 с колоректальным раком), а также с первично-множественными опухолями (29), у которых иммунологическая оценка проводилась до (23,5%), на фоне (58,3%) и по завершении (18,2%) лечения. Пациенты были рандомизированы в соотношении 3:1 в тренировочную (1682 оценки иммунной системы) и контрольную (616 оценок) группы. Проанализированы иммунологические (содержание Т-, B- и NK-лимфоцитов, цитотоксических лимфоцитов, Т-хелперов) и клинические (возраст, пол, заболевание, стадия, мутационный статус, ответ на лечение, длительность заболевания и лечения, характер предшествующего лечения) факторы.
На основании анализа указанных факторов с использованием градиентного бустинга CatBoost разработана модель для прогнозирования прогрессирования опухоли в ближайшие три месяца.
Влияние результатов прогнозирования на показатели общей выживаемости (ОВ) и времени до прогрессирования (ВДП) оценивалось с использованием методов Каплана – Мейера и Кокса.
Результаты. Площадь под кривой ошибок полученной модели составила 0,801.
При прогнозе прогрессирования заболевания по данным модели его частота увеличивалась с 37,5 до 62,0%, вероятность ответа на терапию снизилась с 37,5 до 8,4% (р = 0,016). Предполагаемое прогрессирование заболевания не добавляло дополнительной информации к известным прогностическим факторам ОВ. Однако оно служило независимым фактором риска прогрессирования процесса (относительный риск – 2,204, р = 0,011). Ложноположительные результаты позволили выделить среди пациентов, ответивших на терапию, группу с неблагоприятным течением заболевания (медиана ОВ – 16 месяцев, ВДП – 6 месяцев). При истинно отрицательном результате наблюдалось повышение ОВ до 61 месяца, ВДП до 18 месяцев (р = 0,03). Возможность улучшения прогноза при смене терапии была независимым фактором прогноза ВДП (р < 0,001). Модель также позволяла выделить больных с повышенной ОВ при прогрессировании заболевания (р = 0,033).
Вывод. Построенная модель прогнозирования прогрессирования процесса предоставляет дополнительную клинически значимую информацию. Целесообразно проспективное тестирование данного подхода.



Введение
Иммунотерапия является одним из основных методов системного лечения злокачественных опухолей. Однако в ряде случаев наблюдается развитие как первичной, так и вторичной резистентности к лечению [1]. Известные паттерны резистентности обусловливают поиск прогностических и предиктивных биомаркеров для повышения эффективности терапии.
Общность и универсальность механизмов развития противоопухолевого иммунного ответа [2] позволяют изучать их при широком спектре опухолей и использовать единые подходы к лечению.
Определение субпопуляций клеток иммунной системы в периферической крови – один из подходов, применяемый для поиска предиктивных и прогностических маркеров. Системный иммунный ответ наряду с локальным является важной частью иммунограммы злокачественной опухоли [3]. Через кровь активированные иммунные клетки попадают в ткани, где реализуют свои эффекторные функции. Таким образом, развитие системного иммунного ответа, защищающего от системного опухолевого процесса, может быть определено по образцу периферической крови. Полученный образец в силу своего происхождения будет усредненным и случайным.
Цель исследования – разработать модель прогнозирования прогрессирования опухоли в ближайшие три месяца от момента оценки состояния иммунной системы с использованием как клинических, так и иммунологических параметров и оценить возможности ее применения в клинической практике.
Материал и методы
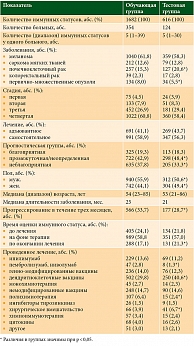
В исследование были включены больные с иммуногенными, неиммуногенными, а также с первично-множественными опухолями. Так, число участников с меланомой составило 295, раком почки – 81, саркомой мягких тканей – 47, колоректальным раком – 26, множественными опухолями – 29. Все они получали лечение в Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова в рамках различных научно-исследовательских проектов.
Критерии включения:
- проведение системного медикаментозного лечения по показаниям;
- наличие оценки состояния иммунной системы (иммунного статуса) до, во время и после лечения.
Для разработки модели отобраны 2298 иммунных статусов.
Данные для обучения и тестирования случайным образом (с фиксированным начальным значением для генератора псевдослучайных чисел в целях воспроизводимости результатов) были разделены в соотношении 3:1.
Характеристика больных в обучающей и тестовой группах представлена в табл. 1.
Для построения модели прогнозирования использовались такие клинические параметры, как вид заболевания, стадия, прогностическая группа заболевания, пол, возраст пациентов, время от начала терапии и от постановки диагноза, проводимое лечение. В качестве иммунологических параметров использовали тесты первого уровня, а именно определение значений лимфоцитов, Т-, В- и NK-лимфоцитов, цитотоксических Т-лимфоцитов, T-хелперов и иммунорегуляторного индекса.
Для построения модели применяли модель машинного обучения на основе градиентного бустинга, представляющего собой ансамбль деревьев решений. Моделирование производили с помощью языка программирования Python 3.7. В качестве бинарного классификатора выбрана модель градиентного бустинга, реализованная в CatBoost [4] (https://github.com/catboost/catboost), метрики оптимизации – площадь под кривой ошибок (Receiver Operating Characteristic Area Under the Curve, ROC AUC). С целью подбора гиперпараметров модели (количество деревьев, их глубина, скорость обучения и параметр регуляризации модели) использовали Hyperopt [5] (https://github.com/hyperopt/hyperopt) и кросс-валидацию: исходная тренировочная часть пять раз случайным образом разбивалась на тренировочную и валидационную в соотношении 3:1 таким образом, чтобы все наблюдения от одного больного попадали только в одну из частей.
Модель обучали на всем исходном тренировочном множестве, после чего использовали для предсказания на тестовом множестве. Важность признаков оценивалась самой моделью. Окончательное тестирование модели проводили на наборе найденных гиперпараметров. Визуализация ROC-кривой и оценка важности признаков проводились с помощью Matplotlib [6].
Результаты
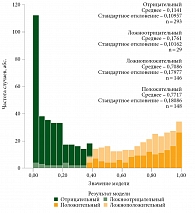
В ходе анализа и валидации был сформирован ансамбль деревьев решений, который оценивал вероятность прогрессирования в ближайшие три месяца. Для определения оптимальной точки отсечения был применен метод Йодена. Оптимальной точкой отсечения принято значение 0,3812. Все превышающие его значения считались положительными.
Эффективность прогнозирования в отношении отсутствия прогрессирования в течение ближайших трех месяцев составила 87% (истинно отрицательные), наличия прогрессирования – 52% (истинно положительные). Чувствительность метода – 73% (рис. 1). Общая диагностическая точность – 73%. ROC AUC достигала 80,15%.
К иммунологическим характеристикам, вошедшим в модель, помимо уровня лимфоцитов и их основных субпопуляций (T-, В- и NK-лимфоцитов, цитотоксических Т-лимфоцитов, T-хелперов) были отнесены определенные типы иммуноопосредованных нежелательных явлений в соответствии с предложенной нами классификацией, основанной на механизме их возникновения.
Необходимо отметить, что параметры иммунного статуса были наиболее важными для определения риска прогрессирования процесса.
Уровни Т-, В- и NK-клеток имели сопоставимое прогностическое значение. При этом в обеих моделях значимость уровней Т- и NK-клеток превосходила значимость текущей стадии заболевания.
Значимыми факторами модели также были вид и тип планируемого лечения, возможность использования комплексного подхода.
Для определения прогностической ценности модели оценена общая выживаемость (ОВ) пациентов. Положительными считались результаты при вероятности прогрессирования заболевания более 38,12% и времени до прогрессирования (ВДП) от используемой оценки состояния иммунной системы менее трех месяцев, ложноположительными – при вероятности прогрессирования более 38,12% и ВДП более трех месяцев, отрицательными – при вероятности прогрессирования менее 38,12% и ВДП более трех месяцев, ложноотрицательными – при вероятности прогрессирования менее 38,12% и ВДП менее трех месяцев.
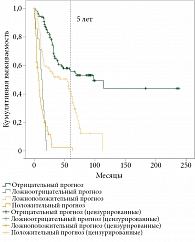
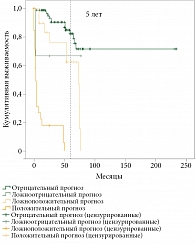
Результаты однофакторного анализа ОВ в зависимости от результатов прогнозирования представлены на рис. 2–4.
Анализ ОВ и ВДП (результаты не представлены) показал, что ложноположительный результат имеет самостоятельное прогностическое значение и позволяет выделить среди отвечающих на терапию группу пациентов со значительно худшим прогнозом, для которых, вероятно, потребуется коррекция лечебной тактики. Так, при ложноположительном результате медиана ВДП составляла шесть месяцев, при отрицательном – 18 месяцев. В данных группах медианы ОВ оказались равными 16 и 61 месяцам соответственно. Ложноотрицательный результат не позволял определить группу больных, отличающуюся по выживаемости от пациентов с положительным результатом. Все проведенные сравнения были значимы при Log-rank p < 0,00001.
Проанализирована также частота расхождения результатов прогнозирования с фактическим результатом лечения в зависимости от анализа иммунного статуса до, во время и по завершении терапии. Установлено, что частота истинно отрицательных результатов увеличивалась – от 30,6% до лечения, 48,1% на фоне терапии и до 63,4% после лечения. В группе завершивших лечение частота ложноположительных результатов сократилась почти в два раза (p = 10-5). Полученные данные свидетельствуют о большей точности модели в прогнозировании прогрессирования в процессе лечения и по его окончании. Различий в других вариантах ответа выявлено не было.
В качестве фактора прогноза эффективности лечения был оценен результат классификации модели. При сравнении положительного результата модели, под которым понималось значение более 0,3812 (38,12%) по данным иммунного статуса, оцененного до лечения, выявлена статистически значимая связь между ответом на лечение и результатами прогнозирования (p = 0,016). При высокой вероятности прогрессирования заболевания по результатам интерпретации модели в 62,0% случаев наблюдалось прогрессирование процесса, в 29,6% – его стабилизация. При низкой вероятности прогрессирования заболевания по результатам прогнозирования вероятность указанных выше состояний составила 37,5 и 25% случаев соответственно. Частота объективного ответа на терапию при высокой вероятности прогрессирования достигла 8,4%, при низкой – 37,5% (р < 0,05).
Для оценки независимой прогностической значимости результатов модели мы оценили связь результата с показателями ОВ и ВДП в многофакторной модели у больных меланомой как наибольшей из групп. Модель была стратифицирована по типу лечения – адъювантное и самостоятельное. Анализировались как качественный, так и количественный результаты модели и их связь с типом лечения. Результат прогнозирования не добавил новой информации при учете известных факторов прогноза ОВ (р > 0,05). Однако при анализе ВДП выявление признаков прогрессирования заболевания по данным модели признано статистически значимым независимым фактором, увеличивающим риск прогрессирования в 2,204 раза (р = 0,011).
Для оценки возможности подбора метода лечения проведен ряд анализов. Прежде всего была изучена возможность улучшения результата прогноза и значимость этой возможности для ОВ и ВДП. При однофакторном анализе ОВ и ВДП выявлено, что у пациентов с низкой вероятностью прогрессирования вне зависимости от лечения был значительно лучший прогноз, чем у пациентов с высокой его вероятностью (р < 0,0001). Группа пациентов, у которых была возможность улучшения результатов лечения, отличалась от группы пациентов с прогрессированием заболевания до лечения и практически не отличалась от них при оценке прогноза на фоне и после окончания лечения. Медианы ОВ и ВДП, а также результаты сравнения этих показателей представлены в табл. 2.
При проведении многофакторного анализа выживаемости с использованием всех возможных параметров модели значимыми оказались только возможность улучшения результатов лечения (р = 3 × 10-24) и наибольший разброс результатов при подборе методов терапии в зависимости от прогноза модели (р = 0,001). С увеличением этих параметров риск смерти возрастал.
Для определения возможности прогнозирования ранней смены терапии или раннего возобновления наблюдения из тестовой группы были отобраны пациенты с достигнутым эффектом на фоне лечения. После этого была оценена ОВ в зависимости от полученного качественного результата модели и построены модели пропорциональных рисков Кокса, включавшие все доступные клинические параметры.
При анализе ОВ с помощью метода Каплана – Майера у пациентов, у которых не прогнозировалось прогрессирование заболевания в ближайшие три месяца, были значительно лучшие показатели по сравнению с больными, у которых прогрессирование было вероятным в ближайшее время, – медиана 18 и 8 месяцев соответственно (Log-rank p = 0,03).
Таким образом, использование модели позволяет своевременно изменять лечебную тактику во время или после завершения терапии, то есть отменять или возобновлять терапию, не дожидаясь прогрессирования, и избегать роста опухолевой нагрузки.
Сравнение результатов прогнозирования при продолжении или прерывании терапии в момент оценки иммунного статуса показало, что во втором случае числовые значения были сопоставимы с выбранной точкой отсечения. Как следствие, были выделены четыре группы:
1) больные, у которых вне зависимости от проведения или приостановки терапии не прогнозировалось прогрессирование;
2) пациенты, у которых прогрессирование прогнозировалось вне зависимости от продолжения терапии;
3) пациенты, которые теряли достигнутый эффект при прекращении лечения;
4) больные, у которых результат прогнозирования был лучше при завершении лечения.
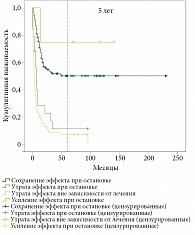
Общая выживаемость и время до прогрессирования в зависимости от изменения результата прогноза при планировании остановки терапии представлены на рис. 5 и 6.
При сравнении полученных результатов прогноза при остановке лечения они оказались не хуже, чем при продолжении терапии, у 32,5% пациентов. Кроме того, данная группа характеризовалась лучшими показателями не только ОВ (медиана 25 против 5 месяцев, Log-rank р = 10-5), но и ВДП (р = 2 × 10-9).
Сопоставление полученных значений с точкой отсечения продемонстрировало, что только у 5,4% пациентов прогнозировалась утрата эффекта терапии в случае ее остановки. Количество больных, у которых вне зависимости от лечения эффект сохранялся или терялся, было одинаковым – по 46,7%. Важно отметить, что в данной популяции как ОВ, так и ВДП существенно различались. При этом выживаемость больных, у которых по завершении лечения в момент оценки иммунного статуса утрачивался эффект терапии, не отличалась от выживаемости пациентов, у которых утрата эффекта ожидалась в любом случае.
Нами выявлено четыре случая, при которых результат прогнозирования был лучше при остановке терапии, чем при ее продолжении. Во всех этих случаях пациенты получали вакцинотерапию. Двое из них – генно-модифицированные вакцины в лечебном режиме, один – немодифицированные вакцины в адъювантном режиме, еще один – дендритноклеточные вакцины в аналогичном режиме.
Обсуждение
С одной стороны, большое количество участников иммунологических взаимодействий и производимых ими регуляторных молекул (цитокинов, хемокинов, поверхностных и растворимых рецепторов к различным факторам) делает практически невозможным выбор ключевого, независимого фактора. С другой стороны, значительная связь всех параметров иммунной системы [7] облегчает определение ее состояний, или иммунологического диагноза. Использование разных наборов факторов способно существенно снизить проблему неполноты отдельных наблюдений. В ряде исследований была продемонстрирована корреляция системных и локальных параметров иммунного ответа [8–10]. Следовательно, для прогноза может потребоваться меньше иммунологических данных.
В последнее время для построения многомерных моделей используются различные технологии машинного обучения. В нашем исследовании был применен ансамбль деревьев решений, успешно применяющийся во многих областях онкологии [11–13]. Несмотря на то что метод затрудняет оценку внутренних связей между факторами, он позволяет точнее решать поставленную практическую задачу, преодолевая ряд препятствий, описанных ранее, в том числе обусловленных обилием возможных показателей.
В ходе нашего исследования было обнаружено, что увеличение числа факторов в модели прогнозирования ухудшает ее работу и точность. В итоговом результате в модель вошло содержание основных субпопуляций иммунных клеток, что позволило охарактеризовать состояние иммунной системы с точностью, не уступающей и даже превышающей точность геномных методов, оценивающих успешность иммунотерапии [14]. Аналогичный вывод был сформулирован при построении математической модели работы иммунной системы. Было показано, что сложные модели менее воспроизводимы [15]. Различные практически ориентированные исследования, использующие номограммы для определения прогноза, также подтвердили возможность успешного прогнозирования течения заболевания с использованием ограниченного числа иммунологических тестов [16, 17]. Точность их прогнозирования сопоставима с точностью прогнозирования нашей модели.
На сегодняшний день вопрос оптимальной продолжительности терапии остается трудноразрешимым. Результаты ранее проведенных исследований интерлейкина 2, ипилимумаба и инфильтрации опухоли лимфоцитами свидетельствовали о возможности сохранения эффекта терапии более пяти лет при однократном или очень коротком по времени воздействии [18]. Анализ результатов лечения больных, преждевременно прекративших прием анти-PD-1-препаратов, позволил предположить не только отсутствие его отрицательного эффекта, но и дополнительные преимущества в виде отсутствия необходимости терапии и развития новых нежелательных явлений [19–22]. Кроме того, в некоторых клинических исследованиях не подтвержден дополнительный эффект от продолжения лечения [23]. Известно, что прекращение терапии у некоторых пациентов приводит к прогрессированию процесса. Однако установлены лишь клинические факторы такого прогноза, что не позволяет уверенно принимать решение о прекращении или продолжении терапии [24, 25].
Представленный нами инструмент прогнозирования помогает более точно оценить роль прекращения или продолжения терапии. Кроме того, с его помощью можно выделить группы пациентов, у которых эффект терапии будет утрачен в ближайшее время вне зависимости от продолжения или прекращения текущего лечения. Это отличает его от других методов, в частности излучающихся биомаркеров, таких как циркулирующая опухолевая ДНК [26]. Важно подчеркнуть, что наша модель прогнозирования позволяет предположить достижение стабильного состояния с использованием разных методов лечения на основании иммунных и клинических параметров, то есть на индивидуальном уровне, что делает возможным использование ее для принятия решения в каждой конкретной клинической ситуации. Это выгодно отличает наш подход от анализа риска рецидива, который подтверждает вероятность достижения излечения через несколько лет, но не может быть использован для планирования терапии у конкретного больного [27]. Наша модель также позволяет своевременно принимать решение о возобновлении терапии, как следствие, сохранить достигнутый эффект и обеспечить достаточную эффективность реиндукции терапии, которая на сегодняшний день достигается не у всех пациентов [25].
Вывод
Построенная модель прогнозирования прогрессирования заболевания предоставляет значимую информацию, которая может быть использована в различных клинических ситуациях. Целесообразно проспективное тестирование данного подхода.
A.V. Novik, PhD, D.V. Girdyuk, T.L. Nekhaeva, PhD, N.V. Emelyanova, N.A. Efremova, D.Kh. Latipova, PhD, A.I. Semenova, PhD, G.M. Teletaeva, PhD, S.A. Protsenko, PhD, I.A. Baldueva, PhD
N.N. Petrov National Medical Research Centre of Oncology, St. Petersburg Russia)
St. Petersburg State Pediatric Medical University
Contact person: Aleksey V. Novik, anovik@list.ru
Biomarkers finding, especially dynamic ones, is an unmet medical need in modern anticancer immunotherapy.
We trained a progression prediction model based on clinical features and peripheral immune system assessments for dynamic prognosis of disease progression in the nearest 3 month.
Material and methods. Patients with immunogenic (melanoma, 295, kidney cancer, 81), non-immunogenic (soft tissue sarcoma, 47, colorectal cancer, 26) and multiple primary tumors (29) with immunologic assessments before treatment (23.5%), on therapy (58.3%), and in follow-up after the treatment (18.2%) were randomly divided in 3:1 ratio to the training (1682 assessments of the immune status) and test (616 assessments) groups. Counts of lymphocytes, T-, B-, NK-cells, cytotoxic lymphocytes, T-helpers were used as immunologic parameters. Age, sex, disease, stage, therapy, mutational status, last response on treatment, disease and therapy duration, previous treatments were used as clinical ones. The model was trained to predict disease progression in the next three months using Catboost gradient boosting. We also studied the influence of model prediction on overall survival (OS) and time to progression (TTP) on the test dataset using the Kaplan – Meyer method and Cox regression.
Results. The ROC AUC value of the model was 0.801.
The model prediction of progression increased the probability of progressive disease from 37.5 to 62.0% and decreased the response rate from 37.5 to 8.4% (p = 0.016).
The model prediction did not add information over known prognostic factors for OS in the multifactorial model but was an independent prognostic factor for TTP (HR – 2.204, p = 0.011). False-positive results separate the group of patients with poor prognosis (OS – 16 months, TTP – 6 months) among patients with clinical benefit from patients with favorable prognosis (OS 61 months, TTP 18 months, p < 0.001), who had a truly negative model prediction (р = 0.03). The possibility of prognosis improvement with therapy change was an essential factor for OS and TTP prediction (р < 0.001). The model was useful in predicting higher OS in patients with disease progression (p = 0.033).
Conclusion. Our progression prediction model provides clinically useful information. Its utility should be tested in a prospective trial.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.