Дифференциально-диагностическая роль опухолевых маркеров у пациенток детского возраста с новообразованиями яичников
- Аннотация
- Статья
- Ссылки
- English
Введение
Опухоли и опухолевидные образования придатков матки в детской гинекологической практике встречаются реже, чем во взрослой, – от 1 до 4,6% [1]. Преобладают доброкачественные физиологические кисты яичников – около 45% от общей патологии придатков [2]. Истинные опухоли яичников – патология, редко встречающаяся в данной возрастной категории, – 2,6–3 случая на 100 тыс. девочек за год [3]. На долю злокачественных опухолей яичников, по разным данным, приходится от 0,2 до 3,3% [4].
В детском возрасте гистологические формы истинных опухолей яичников менее разнообразны, чем во взрослом. В педиатрической практике чаще встречаются герминогенные опухоли яичника (зрелая и незрелая тератома, дисгерминома) ввиду их дизонтогенетического происхождения, реже – эпителиальные опухоли (серозные, муцинозные цистаденомы) и опухоли стромы полового тяжа (текома, фиброма, гранулезоклеточная опухоль ювенильного типа и др.) [5–7].
Клиническое течение образований придатков матки как у детей, так и у взрослых не сопровождается патогномоничными симптомами. Из жалоб при неосложненном течении опухолей и опухолевидных образований придатков матки возможны болевой синдром (внизу живота над лоном, в подвздошно-паховой области), увеличение объема живота и нарушение менструального цикла. В случае гормонпродуцирующей опухоли может быть диагностировано преждевременное половое созревание, реже вирилизация.
Одной из наиболее сложных задач, стоящих перед клиницистом, является дифференциация доброкачественного и злокачественного характера опухоли. Адекватная предоперационная стратификация риска позволяет хирургу принять решение об оперативном вмешательстве (лапаротомия или лапароскопия) и его объеме (цистэктомия с сохранением яичниковой ткани или сальпингоофорэктомия, лимфаденэктомия, биопсия сальника), что в свою очередь улучшает прогноз пациентки в дальнейшем.
Диагностика образований яичников у детей основана на анализе клинико-анамнестических данных, данных осмотра, медицинской визуализации и лабораторного дообследования.
Из-за отсутствия четких критериев дифференциальной диагностики доброкачественной и злокачественной природы новообразований яичников особая роль отводится определению опухолевых маркеров в сыворотке крови.
Цель – определить роль наиболее часто используемых в детской и подростковой гинекологической практике опухолевых маркеров в дифференциальной диагностике образований яичников.
Обсуждение
Согласно определению, предложенному на V Международной конференции по онкомаркерам человека в 1988 г., онкомаркеры, или биохимические опухолевые маркеры, – вещества, образуемые опухолевыми клетками и секретируемые в биологические жидкости, в которых они могут быть количественно определены неинвазивными методами. Эти вещества представляют собой макромолекулы, в основном белки с углеводным или липидным компонентом.
В качестве опухолевых рассматриваются следующие маркеры:
- биохимические вещества эндогенного происхождения, превышение порогового количественного значения которых служит индикатором злокачественного процесса;
- опухолеспецифические биохимические вещества, качественное определение которых указывает на потенциальную злокачественность новообразования.
Определять указанные биохимические вещества можно как внутриклеточно, так и в сыворотке крови, благодаря чему их концентрацию устанавливают неинвазивно с помощью иммуноферментного анализа.
Опухолевые маркеры могут быть классифицированы следующим образом [8]:
- онкофетальные антигены – антигены, которые экспрессируются исключительно во внутриутробном периоде, но при патологическом процессе могут определяться в неопластических клетках (раково-эмбриональный антиген, альфа-фетопротеин (АФП));
- опухоль-ассоциированные антигены (CA 125, CA 19-9, CA 15-3 и др.);
- гормоны (хорионический гонадотропин человека (ХГЧ), плацентарный лактоген, кальцитонин и др.);
- энзимы (лактатдегидрогеназа, простатическая специфическая кислая фосфатаза (простатспецифический антиген));
- рецепторы (прогестероновые, эстрогеновые);
- протеины (ферритин, бета-2-микроглобулин, иммуноглобулины);
- другие биологические вещества (полиамины).
В настоящее время используется широкий диапазон опухолевых маркеров. Вместе с тем для однозначной диагностики злокачественного потенциала образования яичника не существует ни одного онкомаркера, который соответствовал бы идеальным параметрам [9–11]. Одними из важнейших признаков идеального онкомаркера являются специфичность и чувствительность 100%, то есть маркер должен определяться только у пациентов со злокачественными новообразованиями и отсутствовать у здоровых людей и лиц с доброкачественными опухолями [9, 10].
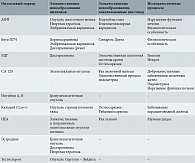
В диагностике новообразований яичников определяют следующие опухолевые маркеры: АФП, лактатдегидрогеназу (ЛДГ), бета-субъединицу ХГЧ, раковый антиген СА 125, ингибин А, B, кальций, человеческий эпидидимальный протеин 4 (HE4), а также эстрадиол и тестостерон (таблица) [12].
С учетом гистотипов опухолей, наиболее часто диагностируемых в педиатрической когорте пациентов, определяют AФП, бета-ХГЧ, ЛДГ и СА 125 [13–16].
АФП – гликопротеин, который в норме вырабатывается в эмбриональном желточном мешке, печени и эпителии кишечника плода. В организме плода он выполняет функции альбумина взрослого человека: осуществляет транспорт веществ, необходимых для развития плода, связывает эстрогены, ограничивая их влияние на развивающийся организм, и защищает от негативного воздействия иммунной системы матери. Через 8–12 месяцев после рождения содержание АФП в крови ребенка снижается до следового количества.
Высокая концентрация АФП в сыворотке крови может определяться у пациентов с герминогенными опухолями яичников – опухолями желточного мешка, незрелыми герминомами, эмбриональными карциномами [16].
H. Takayasu и соавт., проанализировав результаты проведенного клинического исследования, установили закономерность: чем выше уровень АФП и больше размер опухоли, тем вероятнее злокачественный процесс в яичнике [17].
Между тем данные противоречивы, и чувствительность определения АФП поставлена под сомнение: уровень АФП может находиться в рамках референсных значений, если незрелая тератома не содержит очагов полипотентных первичных зародышевых клеток [18].
Невысокая специфичность данного опухолевого маркера объясняется тем, что повышение его уровня может быть вызвано патологией печени, в том числе низкодифференцированной опухолью [17, 18].
ХГЧ – гормон, вырабатываемый клетками хориона (оболочки зародыша) сразу после имплантации. По химическому строению хорионический гонадотропин является соединением белка и сложных углеводов, состоящим из двух частей (субъединиц): альфа и бета. Альфа-субъединица ХГЧ полностью идентична альфа-субъединицам лютеинизирующего, фолликулостимулирующего и тиреотропного гормонов гипофиза.
Опухолевым маркером является бета-субъединица ХГЧ, которая физиологически должна определяться только во время беременности, что обусловливает ее специфичность и позволяет идентифицировать в биологических средах. Наиболее высокая концентрация маркера отмечается при хорионэпителиоме, хориобластоме и герминогенных опухолях [16].
Как показал систематический обзор A.L. Madenci и соавт., с целью установления потенциала злокачественности образования яичника целесообразно именно совместное определение уровней АФП и бета-ХГЧ, поскольку в этом случае повышается чувствительность [19].
ЛДГ – внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват и содержится практически во всех клетках организма. ЛДГ наиболее активна в скелетной мускулатуре, сердечной мышце, почках, печени и эритроцитах.
ЛДГ наряду с АФП и бета-ХГЧ является одним из основных опухолевых маркеров в диагностике герминогенных опухолей яичников [7, 12]. Как и многие другие опухолевые маркеры, маркер ЛДГ неспецифичен, его повышенный уровень может свидетельствовать о гематологических заболеваниях, меланоме.
Раковый антиген CA 125 – высокомолекулярный гликопротеин, повышенный уровень которого отмечают при эпителиальной карциноме яичника, а также аденокарциноме эндометрия и фаллопиевых труб. СА 125 является наиболее часто используемым в гинекологической практике опухолевым маркером для диагностики опухолей яичников [20]. Значение выше 35 ЕД/мл может свидетельствовать о злокачественной природе новообразования. Чувствительность маркера варьируется от 61 до 90%, специфичность составляет 71–93% [21]. Чувствительность СА 125 в препубертатной группе пациенток ниже, чем в постпубертатной [22]. Высокий уровень СА 125 чаще говорит об эпителиальной опухоли яичника, реже диагностируются опухоль желточного мешка, незрелая тератома.
Недостаточная опухолевая специфичность маркера связана с тем, что его повышение в сыворотке крови зачастую прямо пропорционально степени патологического раздражения серозного покрова брюшины (СА 125 продуцируется клетками целомического эпителия). Известно также, что транзиторное изменение уровня СА 125 у здоровых девочек может происходить при различных физиологических состояниях. Так, уровень маркера несколько увеличивается во время менструации и при беременности (в первом триместре).
Эндометриоз – одно из патологических состояний, при которых уровень СА 125 может быть выше референсных значений [23]. Перекрут яичника также относится к состояниям, способным повлиять на информативность определения опухолевых маркеров [24].
В клиническом исследовании C. Spinelli и соавт. все случаи гистологически подтвержденных злокачественных новообразований яичников сопровождались высоким уровнем опухолевых маркеров. В то же время 20,4% доброкачественных образований яичников ассоциировались с высоким уровнем онкомаркеров в крови. В частности, значения АФП, СА 125, ЛДГ были высокими при зрелой тератоме, СА 125 – при доброкачественной серозной цистаденоме [25].
Таким образом, рядом исследователей сделан вывод о неоднозначности применения опухолевых маркеров в качестве инструмента дифференциальной диагностики и определения риска малигнизации образования [14].
Принимая во внимание недостаточную информативную ценность изолированного определения опухолевых маркеров, A.E. Lawrence и соавт. в 2019 г. предложили многофакторную оценку клинической картины для установления потенциала злокачественности образований яичников у педиатрических пациенток. Иными словами, было рекомендовано учитывать наличие или отсутствие патологических симптомов (вздутие живота, признаки преждевременного полового развития или вирилизации), результаты медицинской визуализации (размеры образования, контуры, солидный компонент, папиллярные структуры и др.) и использовать панель онкомаркеров в крови [26].
Заключение
Определение опухолевых маркеров в сыворотке крови является одним из важных диагностических этапов для стратификации риска злокачественности новообразования яичника и выбора метода хирургического лечения, но не рассматривается как самостоятельный надежный критерий из-за недостаточной специфичности.
Целесообразно учитывать особенности клинической картины, размер опухоли, визуальные характеристики при ультразвуковом исследовании и магнитно-резонансной томографии, а также использовать панель опухолевых маркеров с учетом возраста пациенток.
L.V. Adamyan, PhD, Prof., Academician of RASci, Ye.V. Sibirskaya, PhD, Prof., S.A. Korotkova, G.T. Osipova, PhD, Ye.I. Polyakova, A.Z. Mokoyan
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
N.I. Pirogov Russian National Research Medical University
Russian Children's Clinical Hospital of the N.I. Pirogov Russian National Research Medical University
Morozovskaya Children's City Clinical Hospital, Moscow
Contact person: Ani Z. Mokoyan, animokoyan@gmail.com
Adnexal masses in pediatric patients are characterized by high incidence, non-specific symptoms and difficulties in differential diagnosis, which can lead to diagnostic and management failures, therefore, potentially irreversible consequences can take place – partial or complete loss of ovarian function and impaired quality of life. When developing a differential diagnosis for adnexal masses, clinician must consider the patient’s age, presenting complaints, physical examination findings, laboratory tests results and imaging results to generate a list of possible diagnoses and an appropriate treatment plan. This review highlights the role of serum tumor markers in the differential diagnosis of ovarian masses in children and preoperative risk stratification, which may guide surgical management decisions before the availability of histological confirmation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.