Оценка параметров иммунного статуса в качестве факторов прогнозирования эффективности терапии в контексте механизмов развития противоопухолевого иммунного ответа
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В пулированный анализ результатов ряда проспективных клинических исследований
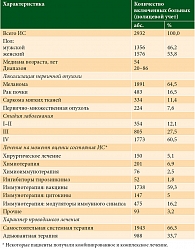
I–II или IV фазы, проведенных в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России с 1998 по 2017 г., включены 2932 оценки состояния иммунной системы (ИС) у 532 больных. У 64,5% пациентов диагностирована меланома, у 16,5% больных – рак почки, у 11,4% – саркома мягких тканей, у 7,6% – первично-множественные опухоли с включением указанных локализаций. У 12,1% больных установлена I–II стадия, у 27,5% – III, у 60,5% – IV. Представлены результаты комплексной оценки иммунологических показателей в качестве факторов прогноза общей выживаемости, времени до прогрессирования и частоты объективного ответа.
Результаты. При комплексном анализе показана предиктивная роль анергии ИС для развития эффекта вакцинотерапии у больных меланомой. Выявлен ряд факторов, менявших свое прогностическое и предиктивное значение на противоположное в зависимости от локализации первичной опухоли, характера лечения (адъювантное или самостоятельное) и вида проведенного лечения. Показаны эффективность химиотерапии и таргетной терапии при повышенном уровне CD3+CD4+CD24highCD127low-лимфоцитов; благоприятное прогностическое значение повышенного уровня CD3+CD4+CD8+-клеток; связь поляризации иммунного ответа с механизмом действия и эффективностью применения различных видов вакцин. Представлены особенности иммунологических профилей предиктивных факторов при разных заболеваниях, разных видах терапии.
Заключение. С целью прогнозирования эффективности терапии необходимы оценка основных звеньев ИС и выделение отдельных иммунологических синдромов на основании полученных результатов.
Материал и методы. В пулированный анализ результатов ряда проспективных клинических исследований
I–II или IV фазы, проведенных в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России с 1998 по 2017 г., включены 2932 оценки состояния иммунной системы (ИС) у 532 больных. У 64,5% пациентов диагностирована меланома, у 16,5% больных – рак почки, у 11,4% – саркома мягких тканей, у 7,6% – первично-множественные опухоли с включением указанных локализаций. У 12,1% больных установлена I–II стадия, у 27,5% – III, у 60,5% – IV. Представлены результаты комплексной оценки иммунологических показателей в качестве факторов прогноза общей выживаемости, времени до прогрессирования и частоты объективного ответа.
Результаты. При комплексном анализе показана предиктивная роль анергии ИС для развития эффекта вакцинотерапии у больных меланомой. Выявлен ряд факторов, менявших свое прогностическое и предиктивное значение на противоположное в зависимости от локализации первичной опухоли, характера лечения (адъювантное или самостоятельное) и вида проведенного лечения. Показаны эффективность химиотерапии и таргетной терапии при повышенном уровне CD3+CD4+CD24highCD127low-лимфоцитов; благоприятное прогностическое значение повышенного уровня CD3+CD4+CD8+-клеток; связь поляризации иммунного ответа с механизмом действия и эффективностью применения различных видов вакцин. Представлены особенности иммунологических профилей предиктивных факторов при разных заболеваниях, разных видах терапии.
Заключение. С целью прогнозирования эффективности терапии необходимы оценка основных звеньев ИС и выделение отдельных иммунологических синдромов на основании полученных результатов.
Введение
В последнее время достигнуты существенные успехи в области иммунотерапии злокачественных новообразований [1]. Показана возможность увеличения продолжительности жизни больных c различными солидными опухолями при применении клеточных технологий (противоопухолевых вакцин, клонов Т-лимфоцитов, NK-клеток), моноклональных антител (антител к EGFR, HER2, VEGF, CD20, CTLA-4, PD-1, PD-L1 и др.), цитокинов (интерферон-альфа, интерлейкин-2) [2]. Однако новые подходы к лечению ставят ряд проблем, требующих разрешения для успешного проведения данных лечебных методов. В первую очередь это проблема отбора пациентов. Гетерогенность популяции больных, несмотря на, казалось бы, равные диагнозы и стадии болезни, очень велика, что обусловлено эволюцией опухоли с течением времени [3, 4]. Вместе с тем выявляемые изменения иммунной системы (ИС) часто оказываются схожими при разных локализациях злокачественных новообразований [5]. Это позволяет предположить, что иммунологические нарушения могут не зависеть от локализации первичной опухоли, но определяться дефектом в том или ином звене ИС [5, 6]. Такие нарушения в конечном итоге могут определять эффективность разных видов лекарственной терапии.
Применение современных средств иммунотерапии выявило возможность позднего развития эффекта лечения и наличие особых типов ответа на лечение [7]. Кроме того, феномен иммунологической памяти [8] позволяет предположить возможность длительного влияния иммунотерапевтических средств на контроль за течением опухолевого процесса. В настоящее время учет таких результатов затруднителен, что может приводить к отмене высокоэффективной терапии. Вместе с тем известно много случаев повышения качества лечения при сочетанном использовании цитостатиков, лучевой терапии и иммунотерапии [9]. Описано влияние каждого из существующих на сегодняшний день методов лечения злокачественных опухолей на иммунную систему. Можно предположить, что учет данных влияний позволит не только оптимизировать выбор метода или комбинации лечебных воздействий, но и адаптивно менять подходы к лечению в зависимости от ответа больного на терапию и вносить коррективы до формальной оценки эффекта на основании размеров опухолевых очагов [10].
Цель исследования – оценить возможность использования состояния ИС в качестве фактора прогнозирования эффективности терапии у больных солидными опухолями.
Материал и методы
Данное исследование представляет собой пулированный анализ результатов ряда проспективных клинических исследований I–II или IV фазы, проведенных в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России с 1998 по 2017 г., во время которых пациенты с диссеминированными солидными опухолями получали противоопухолевое лечение. В ходе каждой научно-исследовательской работы проводилась оценка состояния ИС до, во время и после лечения в период наблюдения за пациентами. Результаты оценки являлись дополнительными конечными точками в каждом из этих исследований. В исследовании допускалось повторное включение пациентов с отличающимся от ранее использованных данных оценки состояния иммунной системы – иммунного статуса . Всего в исследование включено 2932 иммунных статуса у 523 больных.
Во время исследования проводилась оценка следующих параметров у каждого включенного больного: пол, возраст, общая выживаемость (ОВ), группа, подгруппа и стадия заболевания, динамика развития опухолевого процесса на момент оценки иммунного статуса, режим лечения, тип лечения (адъювантное или паллиативное (самостоятельное)), количество этапов предшествующего системного лечения, наличие на момент оценки иммунного статуса иммуноопосредованных нежелательных явлений (иНЯ) определенного типа и механизма развития (в соответствии с описанными нами ранее [11]), эффект терапии по системе RECIST [12] и iRC [7], время до прогрессирования, наличие и характер иНЯ в соответствии с предложенной нами классификацией [11, 13], уровень показателей иммунного статуса, наличие иммунологических нарушений отклонений от референсных значений определенного типа. В качестве характеристик иммунного статуса использовались следующие показатели в абсолютных (×109/л) и относительных (%) величинах, а также их соотношения: лейкоциты, моноциты, базофилы, эозинофилы, нейтрофилы, лимфоциты, T- и В-лимфоциты, Т-хелперы (Th), цитотоксические Т-лимфоциты (ЦТЛ), естественные/натуральные киллеры (NK), NKT (Т-клетки с рецептором NK-клеток), уровень CD14+, CD25+, CD38+, CD71+, CD95+ и HLA-DR+ лимфоцитов и/или мононуклеаров периферической крови, CD25+ и HLA-DR+ активированные Th, HLA-DR+ЦТЛ, НСТ спонтанная, фагоцитарные число и индексы моноцитов и нейтрофилов, NKG2D+ЦТЛ, спонтанная и стимулированная конковалином А или фитогемагглютинином миграция, CD1d+ лимфоциты, клетки памяти (Tem, Tcm, Tnaiv), CD3+CD4+CTLA-4+, NKG2D+NK, CD127lowTreg, FOXP3+Treg, двойные негативные Т-лимфоциты (DP, DN), иммуноглобулины (IgA, IgG, IgM), циркулирующие иммунные комплексы. При сопоставлении уровней показателей выделялись значения выше и ниже референсных (снижение до 50% и более). Сами референсные значения определялись на основании данных лаборатории, в которой проводился анализ.
Общая характеристика больных, включенных в исследование, представлена в таблице.
Методы лечения пациентов были определены в соответствии с предложенной нами ранее классификацией методов иммунотерапии [11]. В нашем исследовании наличие иНЯ на момент оценки иммунного статуса использовалось только в качестве кофактора для прогнозирования эффективности терапии. Под благоприятным влиянием фактора понималось повышение частоты объективного ответа (ОО) или снижение риска прогрессирования или смерти с ростом уровня фактора.
Статистический анализ и визуализация результатов выполнялись с использованием статистических пакетов SPSS v22. Использовались методы описательной статистики, методы семейства хи-квадрат, метод пропорциональных рисков Кокса, метод Каплана – Майера.
Результаты
Нарушения распознавания опухоли ИС происходят на самом раннем этапе противоопухолевого иммунного ответа и приводят к развитию анергии. В нашем исследовании подобная ситуация чаще встречалась у больных с саркомой мягких тканей (СМТ) и редко – у больных меланомой и первично-множественными опухолями. Повышение эффективности вакцинотерапии наблюдалось при анергии (вакцинотерапия специфически воздействует на данное нарушение), в то время как явления анергии часто снижали эффективность других видов лечения. Это получило отражение в низком уровне маркеров поздней активации (CD38+, СD71+, СD95+, HLA-DR+Th, HLA-DR+ЦТЛ) на фоне референсных значений экспрессии маркеров ранней активации (CD25), низкого уровня Т-лимфоцитов, ЦТЛ и Th, снижения фагоцитарной активности и повышения НСТ, сниженного уровня спонтанной миграции, низкого уровня Treg. Низкий уровень Treg был значимым только у больных меланомой, тогда как при СМТ или почечно-клеточном раке (ПКР) снижение Treg не приводило к повышению эффективности терапии дендритноклеточной вакциной (ДКВ), а, наоборот, повышало вероятность прогрессирования заболевания (ПЗ) (р < 0,05), не влияя при этом на показатели ОВ.
Повышенный уровень моноцитов, обеспечивающих распознавание антигена и сопровождающий воспалительные процессы, при СМТ и ПКР был неблагоприятным прогностическим фактором (р < 0,05). С повышением абсолютного числа СD14+ моноцитов при адъювантной терапии меланомы, преимущественно за счет применения генно-модифицированных вакцин (ГМВ), но не ДКВ, наблюдалось улучшение показателей общей выживаемости (р < 0,05). Неблагоприятная прогностическая роль моноцитов также отражена в систематическом обзоре [14].
Уровень Th оказывал неоднозначное влияние на эффективность терапии, меняя свое прогностическое значение в зависимости от типа солидной опухоли, лечебной тактики и адъювантного характера лечебного воздействия (p < 0,05). Важное значение имела экспрессия маркеров активации на Th. При этом разнонаправленные изменения содержания клеток с экспрессией CD25 для иммунотерапии оказывали благоприятное прогностическое значение, тогда как при таргетной терапии – неблагоприятное (р < 0,05).
Экспрессия антигена CD38 в нашем исследовании подтвердила ранее описанную связь с регуляторными популяциями иммунокомпетентных клеток [15], поскольку при низком содержании этих клеток повышалась эффективность терапии ГМВ у больных меланомой, тогда как рост уровня CD38+ значительно повышал риск прогрессирования заболевания при всех методах системной терапии. Любое отклонение относительного уровня CD38+ЦТЛ от референсных значений снижало эффективность ипилимумаба, тогда как при повышенном уровне этих клеток росла эффективность анти-PD-1-терапии (p < 0,05).
Treg- и NKT-клетки были двумя основными регуляторными популяциями, изученными в нашем исследовании. В целом уровень Treg являлся фактором неблагоприятного прогноза ОВ и времени до прогрессирования (ВДП) во всех анализируемых локализациях, что соответствует данным метаанализа опубликованных исследований [16] и проведенному нами ранее систематическому обзору [17]. Эффективность химиотерапии при повышенном содержании Treg может быть объяснена ее известной особенностью в подавлении пролиферации регуляторных Т-клеток [18, 19]. Ингибиторы BRAF могут обладать аналогичным действием [20], что получило подтверждение в нашем исследовании. Необычным наблюдением оказалась неблагоприятная прогностическая роль снижения уровня регуляторных субпопуляций – как собственно CD127lowTreg, так и абсолютного уровня CD25+ активированных Th. При этом снижение относительного уровня CD25+-клеток продемонстрировало явный благоприятный прогностический характер и было ассоциировано с повышенной частотой ответа на лечение и снижением риска смерти.
Уровень NKT-клеток в нашем исследовании был неоднозначным и зависел от проводимого лечения, что позволяет расценить данный показатель как предиктивный. Уровень CD1d+-лимфоцитов, участвующих в активации NKT-клеток, оказался фактором благоприятного прогноза у пациентов, получавших ипилимумаб (p < 0,05). NKT-клетки обладали благоприятным прогностическим значением у больных ПКР и СМТ вне зависимости от вида проведенного лечения (p < 0,05). Прогностическое значение относительного содержания DN (двойные негативные Т-лимфоциты CD3+CD4-CD8-), среди которых, благодаря особенностям гейтирования, могли быть представлены и NKT-клетки, было показано только у больных меланомой, у которых они повышали вероятность ОО, но при этом увеличивали риски ПЗ и смерти в адъювантной терапии.
DP (двойные положительные Т-лимфоциты CD3+CD4+CD8+) в нашем исследовании имели благоприятное прогностическое значение до лечения при полихимиотерапии у больных СМТ и лечении цитокинами больных меланомой (p < 0,05). На фоне терапии ипилимумабом при повышенном уровне DP-клеток реже наблюдалось ПЗ (p < 0,05). Наши данные в целом предполагают скорее иммуносупрессивную роль DP при опухолевом росте. Было установлено, что снижение уровня Т-лимфоцитов при всех видах терапии, за исключением ГМВ, снижало эффективность лечения (p < 0,05). В то же время повышение содержания Т-лимфоцитов снижало эффективность терапии ипилимумабом у больных меланомой (p < 0,05), но их снижение у больных СМТ на фоне химиотерапии повышало вероятность ОО (p < 0,05). Накопление клеток Tcm (Т-клетки центральной памяти), полностью лишенных эффекторных свойств, оказалось маркером неблагоприятного прогноза у пациентов с меланомой на фоне лечения ипилимумабом (относительный риск (ОР) смерти 1,02; р = 0,02), тогда как рост эффекторных (Tem, СD3+СD45RA-СD62L-) клеток памяти на фоне этой терапии был благоприятным фактором прогноза ОВ (ОР 0,401; р = 0,008) и ВДП (ОР 0,961; р = 10-5). Это согласуется и с литературными данными [21–23].
Оценка направления поляризации ИС является важным фактором прогнозирования эффективности иммунотерапии. В нашем исследовании уровни ЦТЛ и NK-клеток как основных эффекторов противоопухолевого иммунного ответа имели противоречивое прогностическое значение при разных типах солидных опухолей и методах лечения, что отражает их различное функциональное состояние и процесс развития анергии эффекторных клеток. Уровень В-лимфоцитов также играл неоднозначную роль при различных злокачественных опухолях. Так, его повышение ассоциировалось с повышенной частотой ОО при ПКР, повышением ОВ при СМТ и демонстрировало выраженный неблагоприятный характер при меланоме (p < 0,05). При меланоме сниженный уровень основных классов Ig имел благоприятное прогностическое значение только при использовании цитокинов, тогда как при всех других видах терапии у больных меланомой снижалась вероятность ОО и повышались риски ПЗ и смерти (p < 0,05). При СМТ низкий уровень В-лимфоцитов ассоциировался с повышенной частотой клинического эффекта и увеличением ОВ (p < 0,05).
При анализе В-клеточного звена ИС и содержания основных классов Ig были выявлены отличия между различными клеточными вакцинами. Так, отклонения в уровне сывороточного IgA у пациентов, получавших адъювантную терапию при меланоме, увеличивали риск ПЗ и смерти у пациентов на терапии немодифицированными вакцинами из инактивированных аутологичных опухолевых клеток и ГМВ, но при этом являлись фактором благоприятного прогноза у пациентов, которые получали ДКВ (p < 0,05). Повышение уровня IgM у пациентов, получавших ДКВ как самостоятельное лечение, оказалось неблагоприятным фактором, тогда как при ГМВ в этих ситуациях снижался риск ПЗ и смерти (p < 0,05). Высокий уровень NK-клеток являлся значимым благоприятным прогностическим фактором для больных меланомой, которые получали ГМВ, и неблагоприятным для пациентов на терапии ДКВ в адъювантном режиме (p < 0,05).
Лимфоидные клетки врожденного звена ИС 2-го типа (ILC2) и эозинофилы в последнее время также рассматриваются как необходимые эффекторы в защите от опухоли при различных злокачественных новообразованиях [24]. В нашем исследовании пониженный уровень эозинофилов ассоциировался с повышенным риском смерти больных меланомой и ПКР, риск ПЗ и смерти возрастал, тогда как при СМТ снижался. При адъювантной терапии меланомы и при использовании ГМВ при ПКР наблюдалась обратная статистически значимая тенденция (p < 0,05).
Кроме того, результаты нашего исследования свидетельствуют о неблагоприятном значении нейтрофильно-лимфоцитарного индекса (NLR), нейтрофильно-лимфоцитарно-моноцитарного индекса (NMLR) и признаков системного воспаления при всех оцениваемых типах солидных опухолей (p < 0,05). Неожиданным для нас стала не описанная ранее повышенная эффективность терапии больных меланомой на фоне как увеличения относительного уровня нейтрофилов, так и роста NLR в динамике (p < 0,05).
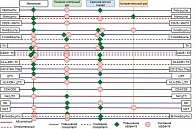
Сравнивая между собой больных с различными видами противоопухолевого лечения, можно проанализировать иммунологические различия между отдельными типами солидных опухолей. В нашем исследовании такими видами терапии были применение ДКВ при всех оцениваемых локализациях солидных опухолей и применение химиотерапии при меланоме и СМТ. Различия (все при p < 0,05) обобщены на рис. 1. При СМТ большое участие в иммунном ответе принимают NK-клетки, используются иные системы регуляции и другие варианты противоопухолевого иммунного ответа, о чем говорит важная роль Th, NKT-клеток и негативное влияние сниженного уровня Treg на прогноз заболевания. При ПКР важным оказался первый тип поляризации иммунного ответа и участие клеток врожденной ИС, которые являются его основными эффекторами.
Анализируя различные методы терапии при одинаковой стадии заболевания, можно выделить особенности иммунологического профиля отдельных злокачественных опухолей. В адъювантной терапии наглядно проявляются различия между разными видами вакцин. Так, ГМВ, которые секретируют цитокины, активирующие преимущественно Th1, вероятно, активируют главным образом клеточный противоопухолевый иммунный ответ. ДКВ рассчитаны на элиминацию более глубокой анергии ИС и способны активировать, кроме клеточного, гуморальный противоопухолевый иммунный ответ. Иммунологическое профилирование различных вариантов изучаемой нами терапии позволило хорошо отразить возможные ниши для применения каждого из них для лечения метастатической меланомы (рис. 2).
Представленная широкая сеть взаимодействий иммунокомпетентных клеток становится важной при разработке комбинированных стратегий с учетом осцилляций иммунологических показателей, позволяющих рационально усиливать достигнутый эффект предшествующей терапии.
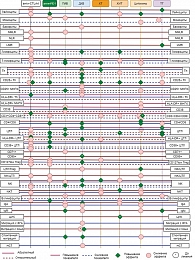
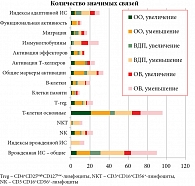
В настоящем исследовании мы использовали несколько наборов показателей ИС, которые лишь частично пересекаются между собой. В соответствии с рекомендациями по оценке состояния иммунной системы, они были нацелены на оценку различных ее звеньев и состояния активации [21, 25]. При этом активность изучалась на разных уровнях – от общей экспрессии маркеров активации до их оценки на отдельных субпопуляциях иммунокомпетентных клеток. Наибольшее число связей в исследовании было выявлено при оценке наиболее крупных субпопуляций иммунных клеток – лейкоцитов и показателей первого уровня иммунного статуса, относящихся преимущественно к Т-клеточному звену ИС (рис. 3). Роль остальных показателей была менее значительной.
Обсуждение
В ходе исследования при оценке параметров иммунного статуса мы использовали как абсолютные, так и относительные показатели. С одной стороны, относительные показатели являются первичными данными, которые измеряют при оценке состояния ИС, тогда как абсолютные получаются путем пересчета, что теоретически позволяет накапливать ошибку измерений. Тем не менее наши данные свидетельствуют о меньшем размере вариабельности абсолютных показателей. С другой стороны, как абсолютные, так и относительные иммунологические показатели используются в клинических исследованиях и в реальной клинической практике большинства лабораторий [26].
Относительные показатели предоставляют дополнительную информацию о соотношении субпопуляций иммунных клеток. Фактически их изменение свидетельствует о синхронности реакций различных звеньев иммунной системы. В наших ранних исследованиях [27] показано, что взаимосвязь параметров ИС сама по себе является фактором прогноза эффективности терапии. Однако в реальной практике эти связи оценить затруднительно. Поэтому единственно возможным способом оценки взаимосвязи параметров в одном иммунном статусе является оценка относительных показателей и индексов, то есть соотношений различных клеток, которые показали свое значение как в нашем исследовании, так и в ряде других. Важно подчеркнуть, что при построении многофакторных прогностических моделей как относительные, так и абсолютные уровни показателей оказались статистически значимыми и не имели высоких корреляций регрессионных остатков, что говорит об их независимости в модели. При этом в ряде случаев влияние отклонений показателей было разнонаправленно. Так, в нашем исследовании рост абсолютного уровня CD14+-моноцитов значительно снижал риск смерти пациентов с меланомой, получавших адъювантную терапию. Повышение относительного уровня при этом повышало вероятность ПЗ, уменьшая влияние абсолютных показателей. Разнонаправленное влияние на риск ПЗ и смерти оказывали относительные и абсолютные уровни лимфоцитов, эозинофилов, базофилов, CD38+-лимфоцитов, HLA-DR+ЦТЛ у больных меланомой, уровни NKT у больных с саркомами мягких тканей. Таким образом, представляется рациональным при оценке значимости изменений иммунологических показателей учитывать их значения как в абсолютных, так и в относительных единицах.
В нашем исследовании мы использовали все доступные оценки состояния ИС, что отличается от большинства исследований, где многие потенциальные предиктивные и прогностические маркеры изучаются до лечения. Такой подход требует обсуждения в нескольких аспектах.
ИС – динамически изменяющаяся система. Для инфекционного процесса динамика соотношения и активности отдельных компонентов ИС уже хорошо описана [8]. Для злокачественной опухоли начало заболевания остается неизвестным фактором. Таким образом, мы оцениваем состояние ИС в неопределенной фазе развития противоопухолевого иммунного ответа, пытаясь предсказать долговременный успех или неудачу терапии. С одной стороны, своевременность воздействия может являться определяющим фактором эффективности лечения. С другой стороны, хорошо описаны осцилляции состояния ИС с периодами, измеряющимися неделями, тогда как длительность иммунотерапии может превышать несколько лет [8, 28]. Таким образом, мы можем предполагать изменение значения фактора в динамике, что нарушает иначе предположение о равной степени действия фактора с течением времени, заложенное в основу метода пропорциональных рисков Кокса, который чаще всего используется для выявления важных факторов прогноза [29]. То есть мониторинг и оценка состояния ИС в динамике являются методологически обоснованными.
Учет динамических маркеров эффективности иммунотерапии позволяет отражать разные аспекты механизмов действия препаратов [30]. Большинство воздействий на ИС оказывают множественные эффекты, отличающиеся в зависимости от ее состояния в момент воздействия, что подтверждается результатами математического моделирования [31]. Клинические данные о применении современной иммунотерапии свидетельствуют о возможности достижения стабильного эффекта иммунотерапии после относительно короткого и, что более важно, конечного по длительности курса терапии [32–36].
Важным компонентом разработки прогностических моделей, особенно в исследованиях по иммунотерапии, является выбор конечной точки исследования. Общепринятым подходом во всех исследованиях, включенных в наш систематический обзор, был выбор бинарного исхода для определения факторов, связанных с благоприятным и неблагоприятным течением заболевания. В нашем исследовании мы использовали несколько общепринятых делений исходов: по непосредственному эффекту, ВДП и ОВ. Различная методология, используемая в таких расчетах, позволяет использовать результаты в качестве внутреннего контроля при совпадении прогностического значения, оцененного по разным методам. Вместе с тем большее количество сравнений может привести к известной переоценке результатов, вызванной проблемой множественных сравнений. Тем не менее биологическая обоснованность многих наблюдений, с одной стороны, и сопоставление полученных результатов с литературными данными, с другой, подтверждают сделанные нами выводы о прогностической значимости параметров периферической ИС и свидетельствуют о необходимости дальнейшего изучения данного направления для разработки оптимальных схем индивидуального лечения.
Возможность оценивать эффективность иммунотерапии на кратких отрезках времени и своевременно изменять вид и направление иммунологического воздействия может стать основой для адаптивного проведения терапии с учетом достижения или недостижения целевого состояния ИС. Исследования адаптивных стратегий, основанных на изменении биомаркеров, считаются наиболее перспективными, но в то же время наиболее сложными и малоизученными в связи с сопряженными с ними рисками [37]. Они требуют разработки риск-адаптированных подходов к лечению, основанных на повторных оценках состояния ИС. Предложенные в нашем исследовании способы решения подобной задачи могут быть использованы как отправная точка для разработки подобных стратегий персонализированной терапии, которая в перспективе может позволить излечивать значительное число больных.
Кроме того, изучение динамики иммунологических показателей позволяет выявлять необычную динамику иммунологических показателей, что создает основу для новых направлений научного поиска. Так, неожиданным для нас стало снижение риска прогрессирования у больных с нарастанием относительного уровня нейтрофилов в динамике, поскольку эти клетки относятся к эффекторам врожденной иммунной системы и, следовательно, обычно отражают неблагоприятный прогноз по данным многочисленных исследований [14]. Тем не менее в нашей работе как повышение относительного уровня нейтрофилов, так и рост NLR в динамике был ассоциирован с повышенной эффективностью лечения. Возможной причиной такой находки является поляризация нейтрофилов, определенные субпопуляции которых могут, по данным некоторых исследований, обладать противоопухолевыми функциями [38, 39].
Другим необычным наблюдением в нашем исследовании является негативная прогностическая роль снижения уровня регуляторных субпопуляций – как собственно Treg, так и абсолютного уровня CD25+Th. При этом снижение относительного уровня последних клеток носило явно позитивный прогностический характер и было ассоциировано с повышенной частотой ответа на лечение и снижением риска смерти. Подобные изменения свидетельствуют о необходимости гармоничной активации иммунной системы и о негативной роли дисбаланса в ее работе при изолированном изменении количества отдельных субпопуляций лимфоцитов. Однако наше наблюдение лишь отчасти согласуется с результатами других исследователей, в которых наблюдалась противоположная по значению связь данного показателя с эффективностью лечения, не всегда подтверждавшаяся статистически [40].
Различные профили и разная прогностическая значимость иммунологических параметров при разных заболеваниях подчеркивают проблему свободной экстраполяции данных и перенесения эффектов терапии одним препаратом с одной локализации злокачественных опухолей на другую. Возможно, именно различия в иммунных профилях приводят к возникновению нескольких паттернов ответа на иммунотерапию, представленных в работе K. Suda [41], а также к неэффективности некоторых иммунотерапевтических подходов при различных солидных опухолях, например анти-PD-терапии при саркомах [42–44].
В то же время наше исследование показало как количественные, так и качественные различия в основных иммунологических параметрах. Принимая во внимание прогностическую значимость выявленных отклонений в показателях ИС в периферической крови и продемонстрированную нами структуру иммунологических нарушений, можно предполагать, что изучение направленных воздействий на иммунную систему должно проводиться как минимум с учетом подобных синдромов и механизмов иммунопатогенеза заболевания. Из опыта применения таргетной терапии известно, что она эффективна только у пациентов с известным нарушением сигнальных путей, управляемых конкретным видом лечения. Иммунотерапия также обладает свойствами таргетной терапии и эффективна только при определенных нарушениях в работе периферической ИС. Мы показали разную частоту встречаемости иммунологических синдромов при отдельных заболеваниях. Поэтому отсутствие информации об иммунопатогенезе может привести к ошибочным выводам о неэффективности того или иного метода лечения. Примером такой недооценки могут быть ранние этапы изучения ингибиторов EGFR, где до открытия мутаций в этом гене современные и эффективные препараты признавались неэффективными [45].
Ранее мы предложили разделить методы лекарственного лечения на основании их первичного иммунологического воздействия на ряд категорий, из которых в нашем исследовании изучалось четыре: методы усиления презентации антигена, методы модуляции активности иммунного синапса, методы усиления кинетики иммунных процессов и методы воздействия на опухоль с последующей активацией иммунной системы [11]. Наше исследование отчасти подтвердило общность закономерностей для препаратов из одной группы, однако был выявлен и ряд внутригрупповых различий. Так, например, гуморальный иммунный ответ играл разную и подчас противоположную роль в достижении эффекта ГМВ и ДКВ. Прогностическое значение сниженного уровня B-лимфоцитов и повышенного содержания CD38+ЦТЛ было разным для ипилимумаба и анти-PD1-терапии. Подобные различия в механизмах иммунологического действия препаратов разных классов поддерживаются и результатами некоторых зарубежных исследований [46], что подтверждает выявленные нами внутригрупповые различия.
Нами показана зависимость значимости отклонения показателей иммунного статуса от проводимого лечения как в количественном, так и в качественном отношении. Таким образом, мы можем предполагать прежде всего предиктивную значимость параметров ИС. Систематические обзоры подтверждают подобное неоднозначное взаимодействие для большинства факторов, характеризующих состояние ИС, при оценке периферической крови [14, 17, 40, 47]. Интересно подчеркнуть, что в некоторых из включенных в указанные обзоры исследованиях не была отмечена связь исследованных нами субпопуляций клеток, например Treg, с эффективностью анти-PD-1-терапии. Данные результаты могут объясняться как относительно небольшим количеством пациентов в исследованиях, так и особенностями их дизайна (использованные конечные точки, методы измерения параметра и т.д.).
Таким образом, для оценки состояния иммунной системы с целью прогнозирования эффективности терапии необходимы оценка ее основных звеньев и выделение отдельных иммунологических синдромов на основании полученных результатов. При этом целесообразно использование как абсолютных, так и относительных значений показателей с учетом их референсных значений.
A.V. Novik, PhD, T.L. Nehaeva, PhD, D.H. Latipova, PhD, N.V. Emelyanova, N.A. Efremova, PhD, A.Yu. Zozula, PhD, G.M. Teletaeva, PhD, A.I. Semenova, PhD, S.A. Protsenko, PhD, I.A. Baldueva, PhD
N.N. Petrov National Medical Research Center of Oncology
St. Petersburg State Pediatric Medical University
Contact person: Aleksei V. Novik, anovik@list.ru
The purpose of the study was to evaluate the prognostic and predictive value of lymphocyte subpopulations estimation in the peripheral blood during systemic therapy in patients with solid tumors.
Material and methods. We performed a pooled analysis of a series of phase I–II or IV prospective trials conducted in the N.N. Petrov National Medical Research Center of Oncology since 1998 to 2017. Immune system condition (immune status) was assessed 2932 times in 532 patients. 64.5% of patients had melanoma, 16.5% – kidney cancer, 11.4% – soft tissue sarcoma, 7.6% – primary multiple tumors with inclusion of above mentioned diseases. Stages I–II was diagnosed in 12.1% of cases, stage III in 27.5%, stage IV in 60.5%. We present results of the complex assessment of immune factors as predictors of objective response, time to progression or overall survival.
Results. We confirmed predictive role of the anergy for efficacy of anticancer vaccines in melanoma. We found several factors that have change their prognostic and predictive value to the opposite in relation to primary tumor, therapy setting (adjuvant or therapeutic), type of therapy. We have shown the efficacy of chemotherapy and targeted therapy in patients with high CD3+CD4+CD24highCD127low lymphocytes level. We have shown favorable prognostic value of elevated CD3+CD4+CD8+ cells level. We demonstrated relation between immune response evaluation and mechanism of action in different types of vaccines. Features of immunological profiles of predictive factors for different diseases, different types of therapy are presented.
Conclusion. Evaluation of the main parts of the immune system and allocation of different syndromes is essential for the prediction do the therapy efficacy based on immune system parameters.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.