Исследование бактериального сообщества толстой кишки при язвенном колите: микробиота как потенциальный маркер эффективности терапии
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включено 128 пациентов с ЯК: 86 пациентов в фазе рецидива ЯК и 42 пациента в фазе ремиссии ЯК. Группу контроля составили 56 здоровых добровольцев. Проведены клинико-инструментальные обследования для установления активности и степени тяжести заболевания, а также определение таксономического состава бактериального компонента микробиоты толстой кишки – исследование копрофильтрата методом NGS-секвенирования 16S рибосомальной РНК.
Результаты. Микробиотический состав образцов контрольной группы на уровне типа и рода был сформирован представителями здорового микробного сообщества толстой кишки: основными являлись типы Firmicutes, Bacteroidota, Proteobacteria и Actinobacteriota, а также бактерии родов Bacteroides, Faecalibacterium, Prevotella, Bifidobacterium и Alistipes. Структура доминирующей микробиоты толстой кишки у пациентов с ЯК характеризовалась повышенным содержанием микроорганизмов, ассоциированных с развитием воспаления (Collinsella и Ruminococcus). Композиционные различия с группой здоровых добровольцев включали сниженное количество короткоцепочечных жирных кислот – продуцентов родов Alistipes и Akkermansia (в группе ремиссии) и Phascolarctobacterium (в обеих группах с ЯК), а также повышение уровня бактерий патогенных и условно-патогенных родов у всех пациентов с ЯК. На основании данных о процентном соотношении обнаруженных родов бактерий была выполнена разработка прогнозной модели ответа на терапию ЯК.
Заключение. Толстокишечная бактериальная флора представляет предиктивный динамический инструмент и может служить неинвазивным биомаркером для прогнозирования терапевтического ответа.
Материал и методы. В исследование включено 128 пациентов с ЯК: 86 пациентов в фазе рецидива ЯК и 42 пациента в фазе ремиссии ЯК. Группу контроля составили 56 здоровых добровольцев. Проведены клинико-инструментальные обследования для установления активности и степени тяжести заболевания, а также определение таксономического состава бактериального компонента микробиоты толстой кишки – исследование копрофильтрата методом NGS-секвенирования 16S рибосомальной РНК.
Результаты. Микробиотический состав образцов контрольной группы на уровне типа и рода был сформирован представителями здорового микробного сообщества толстой кишки: основными являлись типы Firmicutes, Bacteroidota, Proteobacteria и Actinobacteriota, а также бактерии родов Bacteroides, Faecalibacterium, Prevotella, Bifidobacterium и Alistipes. Структура доминирующей микробиоты толстой кишки у пациентов с ЯК характеризовалась повышенным содержанием микроорганизмов, ассоциированных с развитием воспаления (Collinsella и Ruminococcus). Композиционные различия с группой здоровых добровольцев включали сниженное количество короткоцепочечных жирных кислот – продуцентов родов Alistipes и Akkermansia (в группе ремиссии) и Phascolarctobacterium (в обеих группах с ЯК), а также повышение уровня бактерий патогенных и условно-патогенных родов у всех пациентов с ЯК. На основании данных о процентном соотношении обнаруженных родов бактерий была выполнена разработка прогнозной модели ответа на терапию ЯК.
Заключение. Толстокишечная бактериальная флора представляет предиктивный динамический инструмент и может служить неинвазивным биомаркером для прогнозирования терапевтического ответа.


Введение
Язвенный колит (ЯК) – хроническое, неспецифическое и полиэтиологичное заболевание, поражающее толстую кишку и классифицируемое как воспалительное заболевание кишечника (ВЗК) [1]. Патогенез ВЗК определяется сложными взаимодействиями между генетической предрасположенностью, факторами окружающей среды, микробиотой и нарушением регуляции иммунного ответа.
Микробное сообщество толстой кишки включает бактерии, простейшие, археи, грибы и вирусы, представляя крупнейший резервуар микробиома человека [2–4]. С учетом разнообразия, сложности, избыточности и взаимодействия с организмом-хозяином толстокишечная микробиота является обширной и стабильной экосистемой [4]. Ее здоровое функционирование способствует метаболизму питательных веществ, ксенобиотиков и лекарств, сохранению структурной целостности барьера слизистой оболочки (СО) кишечника, иммуномодуляции и защите от патогенов [5].
Бактериальная микробиота является наиболее обширным компонентом кишечной микробной флоры и насчитывает около 100 триллионов микроорганизмов и более 1000 видов, большинство из которых принадлежат к доминирующим типам Bacteroidetes, Firmicutes, Proteobacteria и Actinobacteriota [6]. Изменения в структуре или функции микробиотического сообщества и нарушение микроэкологического гомеостаза – состояние дисбиоза, характерное для ЯК, в последние годы стало предметом значительного интереса и изучения [7–9]. Критические композиционные и функциональные изменения микробных сообществ, выявляемые у пациентов с ЯК, по сравнению со здоровыми людьми, а также идентификация мутаций в генах, участвующих во взаимодействиях микробиома и иммунной системы, выступают в поддержку фундаментальной роли микробиоты в механизмах развития и прогрессирования заболевания [9].
Нарушения микробиотического баланса – изменения в микробном составе, связанные с активностью ЯК, могут служить детерминантами ответа на лечение: исследования демонстрируют потенциал микробиома кишечника – его составляющих или метаболитов – в качестве диагностических биомаркеров для оценки активности заболевания или эффективности терапии [10, 11].
Цель исследования – изучение бактериального сообщества толстой кишки у пациентов с ЯК в различные фазы течения заболевания и у группы здоровых добровольцев, а также разработка на основании полученных данных модели, отражающей прогноз эффективности консервативной (базисной) терапии в достижении клинико-эндоскопической ремиссии ЯК.
Материал и методы
В исследование было включено 128 пациентов с ЯК с легкой и средне-тяжелой степенью активности заболевания: 86 пациентов в фазе рецидива ЯК (32,03 ± 5,5 года) и 42 пациента в фазе ремиссии (38,0 ± 4,4 года), 56 (20,5 ± 1,4 года) здоровых добровольцев составили группу контроля.
Всем больным, включенным в исследование, были проведены комплексное клинико-инструментальное и лабораторное обследования в соответствии с национальными клиническими рекомендациями по диагностике и лечению больных с ЯК [12].
Таксономический состав бактериальной микробиоты толстой кишки определяли с помощью исследования копрофильтрата методом NGS-секвенирования 16S рибосомальной РНК. У больных ЯК анализ выполняли в период рецидива заболевания и через 12 недель базисной терапии при достижении клинико-эндоскопической ремиссии.
Статистическую обработку данных выполняли в пакете прикладных программ SPSS версии 26 (IBM, USA). Проверку на нормальность распределения количественных данных проводили с помощью критериев Колмогорова – Смирнова (с коррекцией значимости Лильефорс) и Шапиро – Уилка. Гипотезы о соответствии распределения нормальному были отвергнуты, в связи с чем расчет описательных статистик представлен медианой и квартилями. Сравнение групп выполнено с помощью непараметрического критерия Манна – Уитни. Для сравнения показателей, подчинявшихся нормальному закону распределения, применяли t-критерий Стьюдента. Различия признавали статистически значимыми при p < 0,05.
Результаты
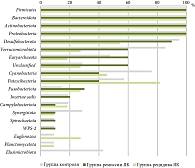
Метагеномный анализ позволил выявить в составе бактериальной микробиоты кишечника у пациентов с ЯК 18 типов микроорганизмов, в том числе 282 рода и 273 вида. Анализ микробиоты в контрольной группе определил в образцах 21 тип микроорганизма и 432 рода. Представители типов Firmicutes, Bacteroidota, Proteobacteria и Actinobacteriota определялись в образцах всех обследуемых пациентов. Таксономический состав флоры на уровне типа представлен на рис. 1.
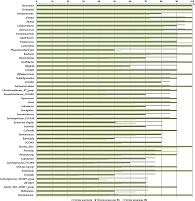
На уровне рода у всех участников из контрольной группы регистрировались Bacteroides, Unclassified и Parabacteroides. Alistipes, Blautia, Colidextribacter, Butyricicoccus обнаруживались у 95,24% обследуемых, остальные – в меньшем числе случаев. У 100% пациентов в группе рецидива обнаруживались роды Bacteroides, Unclassified и Streptococcus; у 90,9% – Faecalibacterium, Prevotella, Blautia, Pelomonas, Incertae Sedis. У всех пациентов группы ремиссии регистрировались 15 родов бактерий: Bacteroides, Unclassified, Faecalibacterium, Alistipes, Bifidobacterium, Lachnospira, Agathobacter, Lachnoclostridium, Blautia, Roseburia, Oscillibacter, Butyricicoccus, Romboutsia, Incertae Sedis и Intestinimonas. Представленность наиболее часто встречающихся родов микроорганизмов в группах отражена на рис. 2.
Для оценки состава микробного сообщества толстой кишки проводилось изучение представленности микроорганизмов в биологических образцах. Доминирующими филумами в образцах всех исследуемых групп были представители четырех типов: Firmicutes, Bacteroidota, Proteobacteria и Actinobacteriota. Основная часть микробиоты контрольной группы представлена родами: Bacteroides, Prevotella, Bifidobacterium и Alistipes. Ключевыми типовыми представителями в образцах пациентов с ЯК являлись Bacteroides, Faecalibacterium, Prevotella, Alistipes, Bifidobacterium и Subdoligranulum.
На основе данных о процентном соотношении выявленных родов бактерий в исследуемых образцах была построена модель логистической регрессии, позволяющая оценить эффективность консервативного лечения в достижении клинико-эндоскопической ремиссии ЯК. С учетом того факта, что между уровнями различных микроорганизмов наблюдалась корреляционная зависимость, в окончательную модель вошли только те таксоны, которые оказывали статистически значимое влияние, демонстрировали наибольшие абсолютные различия в содержании и не имели значимой взаимной корреляции. Оценочные показатели работы модели приведены в табл. 1.
Формула для данной модели:

где χ1 – уровень Enterococcus; χ2 – уровень Streptococcus; χ3 – уровень NK4A214_group; χ4 – уровень Pelomonas; χ5 – уровень Actinomyces; e – основание натурального логарифма.
Если величина р составляет 39,29% и более, то прогнозируют эффективность консервативной терапии и достижение ремиссии у пациента с ЯК [13].
Результаты анализа показали, что предложенная модель является статистически значимой, согласно критерию хи-квадрат Пирсона (p = 0,002). Величины псевдо-коэффициентов детерминации свидетельствуют о высокой объясняющей способности модели: коэффициент Кокса и Снелла составил 0,556, а скорректированный показатель Нэйджелкерка достиг 0,741.
Оценка прогностической валидности модели продемонстрировала высокую дискриминативную способность: чувствительность – 0,833, специфичность – 1,0. Площадь под ROC-кривой (AUC-ROC) составила 0,909 (95%), что указывает на высокую дифференциацию между группами пациентов с ремиссией и рецидивом ЯК (рис. 3). Таким образом, разработанная модель обладает высокой прогностической точностью и может быть рекомендована для клинического применения.
Обсуждение
Основными доминирующими филумами в образцах пациентов с ЯК и в контрольной группе были представители четырех типов: Firmicutes, Bacteroidota, Proteobacteria и Actinobacteriota. Данные микроорганизмы являются типичными и основными представителями нормофлоры, занимая нишу в 98–99% от всего микробного сообщества толстой кишки. Различия в структуре флоры на уровне типа характеризовались повышением уровня филума Actinobacteriota и снижением уровня Verrucomicrobia у пациентов с ЯК как в стадии обострения, так и в стадии ремиссии заболевания при сравнении с группой контроля.
Таксономический ландшафт на уровне рода имел более выраженные композиционные отличия. Так, в группе контроля микробиотическое сообщество в своем большинстве представлено анаэробными короткоцепочечными жирными кислотами-продуцентами (КЦЖК-продуцентами), являющимися ключевыми представителями аутохтонной микробиоты в норме, – Bacteroides, Faecalibacterium, Prevotella, Bifidobacterium и Alistipes. Доминирующими бактериями на уровне рода в группах с ЯК были также «противовоспалительные» КЦЖК-продуцирующие бактерии, составляющие здоровый микробиоценоз толстой кишки: Bacteroides, Faecalibacterium, Prevotella, Alistipes, Bifidobacterium, Subdoligranulum. Однако роды Collinsella и Ruminococcus, обладающие при неблагоприятных условиях провоспалительным потенциалом, занимали ключевые позиции. В группе рецидива ЯК, по сравнению с группой ремиссии, обнаружен более высокий уровень условно-патогенных бактерий – родов Enterococcus, Streptococcus, Granulicatella, Pelomonas, Actinomyces. Кроме этого, отмечено повышение уровня Bifidobacterium – пробиотического рода бактерий, обладающего, однако, при высоких значениях неблагоприятными свойствами для слизистого барьера кишечника. В сравнении со здоровыми добровольцами у пациентов с ЯК отмечалось сниженное количество КЦЖК-продуцентов родов Alistipes, Akkermansia (в группе ремиссии), Phascolarctobacterium (в обеих группах с ЯК) и повышение уровня бактерий патогенных и условно-патогенных родов, в частности рода Dialister, в различные фазы течения ЯК.
Ключевыми стратегическими целями в лечении ЯК являются достижение и поддержание эндоскопической и гистологической ремиссии, что инструментально определяется инвазивными методами исследования [14]. Альтернативные диагностические маркеры: С-реактивный белок (СРБ), скорость оседания эритроцитов (СОЭ), антинейтрофильные цитоплазматические антитела (АНЦА), фекальный кальпротектин демонстрируют ограниченную специфичность и могут использоваться только в качестве дополнительных методов [15]. Микробиомные предикторы представляются новым и многообещающим инструментом для использования в клинической практике и оптимизации персонализированных стратегий лечения. Прогнозная модель, разработанная на основании результатов многофакторного анализа бактериальной микробиоты толстой кишки, представляет возможную перспективу в повышении точности и специфичности определения эффективности лечения и достижения клинической ремиссии заболевания.
Заключение
Рецидивирующее и ремиттирующее течение ЯК обуславливает потребность в оптимизации диагностики, терапии и предотвращении осложнений. Существующие на сегодняшний день стратегии мониторинга являются инвазивными и дорогостоящими. Характеристика ключевых микробных таксонов и их значение в патогенезе ЯК являются предметом активного изучения. Благодаря секвенированию микробиома разрабатываются новые диагностические, прогностические и терапевтические инструменты.
Анализ микробиологического ландшафта толстой кишки и разработка метода прогнозирования ремиссии в рамках проведенного исследования являются важным шагом в понимании микробных сигнатур, ассоциированных с ЯК, и создании точного и оптимального предиктора эффективности терапии.
Исследование проведено при поддержке гранта «Умник» Фонда содействия инновациям (договор № 17315ГУ/2022 от 13.04.2022).
A.D. Zubova, G.N. Tarasova, PhD, Prof.
Rostov State Medical University, Rostov-on-Don
Medical and Sanitary Unit of the Ministry of Internal Affairs of Russia for the Rostov Region, Rostov-on-Don
Contact person: Anna D. Zubova, anna-d-zubova@yandex.ru
Objective – researching colonic bacterial community in patients with ulcerative colitis on various phases of the disease and a group of healthy volunteers and using the collected data to build a model demonstrating a prognosis on the efficacy of conservative treatment in achieving clinical
and endoscopic remission of ulcerative colitis.
Material and methods. The study included 128 patients with UC: 86 patients in the relapse phase of UC and 42 patients in the remission phase of UC. The control group consisted of 56 healthy volunteers. Clinical and instrumental examinations were carried out to establish the activity
and severity of the disease as well as to determine the taxonomic composition of the bacterial component of the colon microbiota – a study of the coprofiltrate by NGS sequencing of 16S ribosomal RNA.
Results. The microbiotic composition of the control group samples at the phylum and genus level was formed by representatives of the healthy microbial community of the colon – the main ones were the phyla Firmicutes, Bacteroidota, Proteobacteria and Actinobacteriota as well as bacteria
of the genera Bacteroides, Faecalibacterium, Prevotella, Bifidobacterium and Alistipes. The structure of the dominant microbiota of the colon in patients with UC was characterized by an increased content of microorganisms associated with the development of inflammation (Collinsella and Ruminococcus). Compositional differences against the group of healthy volunteers included a reduced amount of short-chain fatty acids (SCFAs) produced by the genera Alistipes and Akkermansia (in the remission group) and Phascolarctobacterium (in both groups with UC) as well as an increase in the level of pathogenic and opportunistic bacteria of the genera in all patients with UC. Based on the detected bacterial genera percentage data, a predictive model of response to UC therapy was developed.
Conclusion. Colonic bacterial flora represents a predictive dynamic tool and may serve as a non-invasive biomarker for therapeutic response prognoses.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.