Изменения характеристик дельта-колебаний и бета-ритма на электроэнцефалограмме при самопроизвольном пробуждении из второй стадии дневного сна с последующим выполнением психомоторной деятельности разной длительности
- Аннотация
- Статья
- Ссылки
- English


Введение
Активация мозга, которая участвует в регуляции сна в соответствии с внутренними потребностями и внешним воздействием, является важным объектом исследований в условиях усиливающихся социальных требований, нарушающих естественное течение цикла «сон – бодрствование». Она обеспечивает обратимость сна и определенный уровень бдительности, что позволяет спящему адаптироваться к внешней среде [1]. В то же время активационные процессы вовлечены в патофизиологию нарушений сна [2]. Их возникновение и учащение могут свидетельствовать о фрагментации и нестабильности сна, рассматриваться как маркер качества сна и инсомнии [3]. На электроэнцефалограмме (ЭЭГ) определяются быстрые сдвиги частотного состава ЭЭГ в сторону тета-, альфа- или бета-ритмов, а также высокоамплитудные колебания (дельта-подобные волны или К-комплексы), которые отражают особую активацию, сопровождающуюся тормозными процессами в мозге [1, 2, 4].
В ряде работ показана ассоциация бета-ритма в моторной коре с появлением К-комплекса, за которым следует эпизод активации [4, 5]. В исследованиях с одновременной регистрацией корковой и внутрикорковой ЭЭГ у пациентов с эпилепсией вне периода обострения выявлена связь реакций активации со стадиями сна, областями отведения биоэлектрической активности, а также типом пробуждения – самопроизвольным или вызванным внешним воздействием [6, 7]. В то же время частотные характеристики ЭЭГ при спонтанной активации достаточно информативны, чтобы на основании больших данных и искусственного интеллекта разделить записи здоровых субъектов и пациентов с хронической бессонницей и нарушением восприятия состояния сна. У последних по сравнению со здоровыми лицами менее выражены изменения в дельта- и больше в тета-, альфа- и бета-диапазонах [8].
Эффективность восстановления когнитивных функций при активации изучалась в исследованиях сна в значительно меньшей степени, чем их клинический аспект. Показана ключевая роль реактивности мозга и продолжительности пробуждения после начала паттерна активации в формировании памяти о содержании сновидений [9]. Эти результаты согласуются с данными исследований активности гиппокампа и орбитофронтальной коры, вызванной спонтанной активацией с последующим пробуждением. В исследованиях отмечался прогрессирующий процесс, модулируемый стадией сна, а в лобной коре – первоначальным уровнем активации [7]. Эти факты могут объяснить более успешные воспоминания о сновидениях после длительного пробуждения из REM-сна, поскольку активность гиппокампа приближается к уровню при бодрствовании и позволяет восстановить функции кодирования и консолидации памяти [7].
Наши исследования самопроизвольной активации во время эпизода дневного сна, его второй стадии (N2), и следующего за ним периода пробуждения, включавшего припоминание инструкции и подготовку к психомоторной деятельности, показали следующее. Альфа-ритму при пробуждении часто предшествует появление К-комплексов разной степени выраженности, на которые накладываются альфа-колебания. Подобный паттерн, вероятно, отражает действие универсального таламо-кортикального активирующего механизма. Его появление не зависит от того, завершится ли короткий период активации погружением в сон, или последует пробуждение [10].
Цель данной работы – изучить характеристики ЭЭГ после самопроизвольной активации мозга во время N2 дневного сна, которая завершается эпизодами пробуждения разной длительности и сопровождается выполнением психомоторного теста (ПМТ) [11]. В задачи исследования входила оценка:
- соотношения низких (дельта) и высоких (бета) диапазонов спектра ЭЭГ во время эпизода активации с последующим пробуждением разной длительности, которое сопровождается ПМТ, – для суммарной ЭЭГ и отдельно по областям отведения;
- соотношения этих частот в начале выполнения ПМТ во время пробуждения разной длительности в разные фазы выполнения ПМТ: счет в уме с синхронными нажатиями (первая фаза) и только счет в уме (вторая фаза).
Материал и методы
В исследовании участвовали 34 практически здоровых студента (26 женщин и 8 мужчин, все правши) в возрасте от 18 до 22 лет. Исследование было одобрено этической комиссией Института высшей нервной деятельности и нейрофизиологии Российской академии наук (протокол № 2 от 3 июня 2019 г.) и соответствовало этическим нормам Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками от 2000 г.
Эксперимент начинали в 13.00. Для оценки параметров ночного сна, предшествовавшего исследованию, испытуемые заполняли дневник сна [12]. Для оценки дневной сонливости использовали Каролинскую шкалу сонливости (KSS). Во время опыта (около часа) испытуемый лежал на кушетке с закрытыми глазами в затемненном звукоизолирующем помещении. С помощью ПМТ получали ряд последовательных периодов засыпания и пробуждения. Тест состоял из двух чередующихся фаз. Испытуемые считали «про себя» от одного до десяти, одновременно при каждом отсчете нажимали на кнопку, зафиксированную на указательном пальце правой руки, большим пальцем той же руки (первая фаза). Далее они продолжали считать «про себя» от одного до десяти, но уже без нажатий (вторая фаза). Фазы чередовались до тех пор, пока участники исследования не засыпали. При спонтанных пробуждениях они возобновляли выполнение теста с первой фазы. Регистрировали ЭЭГ от 17 отведений в соответствии со схемой 10–20, электроокулограмму, электромиограмму короткой мышцы, отводящей большой палец кисти правой руки, и механограмму нажатий на кнопку. Регистрацию осуществляли с помощью системы Neocortex-Pro (Neurobotics). Частота дискретизации – 250 Гц, полоса пропускания частот – 0,5–70 Гц. Использовали шлем и хлорсеребряные электроды, сопротивление – менее 5 кОм. Для анализа выбирали отрезки записи ЭЭГ, соответствовавшие эпизодам полного и частичного выполнения ПМТ при самопроизвольном пробуждении из N2, который наблюдался не менее 1,5 минуты. Принадлежность ЭЭГ к N2 оценивали визуально по критериям AASM [13]. Полным считали выполнение теста, если испытуемый после пробуждения правильно выполнял задание первой фазы теста, то есть нажимал десять раз на кнопку, и затем через промежуток, соизмеримый с временем счета «про себя» от одного до десяти (около десяти секунд, вторая фаза теста), полностью воспроизводил первую фазу. О частичном выполнении говорили, когда после первой фазы, осуществленной не полностью (6–9 нажатий), ждать следующего нажатия приходилось не менее минуты.
Отбирали испытуемых, у которых хотя бы по одному разу регистрировалось полное и частичное выполнение теста. Таких оказалось 17 (13 женщин и четверо мужчин). Средняя продолжительность сна в ночь перед опытом в данной группе составила 5,9 ± 2,7 часа, самочувствие при пробуждении и качество сна – 3,2 ± 1,2 и 3,8 ± 1,3 балла соответственно (по пятибалльной шкале, где 5 – отлично), средний уровень сонливости перед опытом – 5,1 ± 1,7 балла (по семибалльной шкале, где 1 – отлично). Если полных и частичных эпизодов выполнения ПМТ было несколько, то выбирали по одному с максимальной продолжительностью. В определенной степени это позволило сблизить уровни активации субъекта в эпизодах выполнения деятельности с разной эффективностью после пробуждения.
Анализировали 40-секундные отрезки записи ЭЭГ, на середину которых приходилось возобновление нажатий на кнопку после N2: по 20 секунд до и после возобновления нажатий. Для оценки мощностных характеристик биоэлектрической активности коры проводили непрерывное вейвлет-преобразование на основе материнского комплексного morlet-вейвлета (Matlab 78.01). Карты распределения значений модуля коэффициента вейвлет-преобразования (КВП) строили в полосе 0,5–40 Гц с шагом 0,5 Гц и разрешением по времени 0,01 с. В дельта- (1–3,5 Гц) и бета-диапазонах (14–21 Гц) усредняли КВП по частоте; далее по времени, в двухсекундных интервалах (по десять до и после начала нажатий). Полученные амплитудно-мощностные характеристики ЭЭГ оценивали с помощью дисперсионного анализа (ANOVA RM). Рассматривали влияние на них факторов, таких как эффективность деятельности – два уровня (полное и частичное выполнение ПМТ) и психомоторная активность – два уровня (периоды до начала нажатий на кнопку и после). Для повторных измерений использовали фактор времени (десять уровней, десять двухсекундных интервалов). ANOVA RM проводили как суммарно (по усредненным мощностным характеристикам всех отведений ЭЭГ для каждого отсчета), так и по отдельности для каждого отведения ЭЭГ. Статистическую обработку осуществляли с учетом поправки Гринхауза – Гессера.
Полученные в результате усреднений амплитудно-мощностные характеристики ЭЭГ с помощью парного критерия Уилкоксона сравнивали при полном и частичном выполнении ПМТ – по каждому выделенному двухсекундному интервалу и в каждом из спектральных диапазонов.
Кроме того, сравнивали изменения спектральных характеристик ЭЭГ между первой и второй фазами теста – по отдельности для каждой из упомянутых ситуаций. На основании механограмм из соответствующих КВП выделяли фрагменты с первым паттерном нажатий после пробуждения и интервала между первым и вторым паттернами нажатий (при полном восстановлении) или десятисекундного интервала непосредственно после паттерна нажатий (при частичном восстановлении). Усредняли выделенные фрагменты по дельта- и бета-диапазонам и далее в целом по времени. Статистическую оценку также проводили с учетом парного критерия Уилкоксона. Все вычисления выполняли с использованием пакета программ SPSS 13.0.
Результаты
Мощностные характеристики дельта- и бета-колебаний ЭЭГ при активации мозга в эпизоде N2 дневного сна и следующего за ней пробуждения зависят от его длительности. Дисперсионный анализ показал значимое влияние факторов «эффективность деятельности» и «психомоторная активность», а также их взаимодействия (таблица).
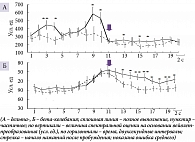
При активации незадолго до выполнения ПМТ (13–16 секунд до начала нажатий, интервалы 3 и 4 анализируемого 40-секундного отрезка ЭЭГ) и непосредственно перед его выполнением (в течение четырех секунд, интервалы 9 и 10) мощностные характеристики суммарной дельта-активности выше при длительном эпизоде пробуждения (рис. 1А). Во время деятельности дельта- (5–6 и 9–12 секунд после начала нажатий, интервалы 13, 15 и 16 соответственно) (рис. 1А) и бета-активность (5–20 секунд, интервалы с 13-го по 20-й) (рис. 1Б) также выше при длительном пробуждении.
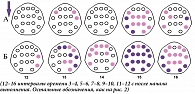
В указанные периоды, до начала выполнения ПМТ, в ситуации с последующим полным его выполнением мощность дельта-колебаний выше в большинстве областей отведения ЭЭГ (рис. 2А), а мощность бета-ритма – только при первом паттерне активации (за 13–16 секунд до начала нажатий, интервалы 3 и 4) и преимущественно в переднецентральных областях (рис. 2Б). После начала деятельности различия между полным и частичным выполнением в дельта-диапазоне наблюдаются на 5–6-й секунде (13-й интервал) билатерально в лобно-височных и правой передневисочной областях, на 9–10-й секунде (15-й интервал) носят генерализованный характер, а на 11–12-й (16-й) отмечаются в отведениях F7, C3, T4, T5 и T6 (рис. 3А). В бета-диапазоне они появляются на 3–4-й секунде (12-й интервал) в правых передне- и задневисочных областях коры, далее захватывают лобно-центральные и каудальные зоны, вначале преимущественно правого полушария, затем перетекая в левое, и далее на 9–12-й секунде (15 и 16-й интервалы) приобретают генерализованный характер (рис. 3Б).
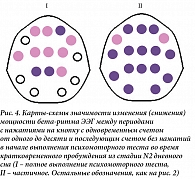
Фазы счета с нажатиями и без них ПМТ в дельта-диапазоне спектра ЭЭГ в ситуациях разной эффективности его выполнения не различаются. Прекращение моторной деятельности с сохранением счета в уме при полном выполнении ПМТ ведет к уменьшению мощности бета-ритма в передних центральных и теменных областях отведения ЭЭГ, а при частичном носит генерализованный характер (рис. 4).
Обсуждение
Дельта-колебания, которые возникают перед пробуждением, имеют более высокие амплитудные значения и сопровождаются более выраженной бета-активностью на ЭЭГ, чем появляющиеся ранее. В свою очередь амплитудно-мощностные характеристики низкочастотных (дельта) и высокочастотных колебаний (бета) ЭЭГ различаются в зависимости от длительности эпизода пробуждения. Более длительное пробуждение из N2 дневного сна, сопровождаемое более эффективным выполнением ПМТ, вызывает рост мощности дельта-колебаний на ранних этапах активации и непосредственно перед началом нажатий на кнопку. Дельта-активность в этих условиях отражает появление на ЭЭГ К-комплексов [4, 5, 10, 14]. Известна двойная роль К-комплексов, участвующих в процессах активации или стабилизирующих сон [4, 14]. В зависимости от функционального значения их можно разделить на основании амплитудно-мощностных характеристик и сопутствующих им колебаний биопотенциалов [4, 5, 15]. Наши результаты подтвердили предположение, что для пробуждения активация, характеризующаяся К-комплексами, должна достигнуть определенной силы. В противном случае она является феноменом, который защищает непрерывность сна, а не фрагментирует и ухудшает его качество [16].
Показано, что увеличение мощности бета-ритма в моторной коре, которое сопровождает К-комплексы, – предиктор предстоящего пробуждения, отражающий, вероятно, сенсомоторную обработку внутренних или внешних возбуждающих стимулов и подготовку мозга к пробуждению при необходимости [4]. Мощность высокочастотных колебаний (бета и гамма) возрастает в конце эпизода микросна (3–15 секунд) с немедленным возобновлением когнитивной деятельности [17]. Скорее всего этот факт характеризует восстановление связи субъекта с внешней средой и синхронизацию процессов внимания и памяти (в том числе припоминание инструкции) для быстрого возобновления выполнения задачи. Наши результаты согласуются с этой точкой зрения с единственным уточнением, что переход от сна к деятельности в нашем случае происходил после относительно длительного (не менее 1,5 минуты) эпизода N2 дневного сна.
Более высокие амплитудные значения дельта-колебаний при эффективном выполнении ПМТ можно рассматривать как реакцию биоэлектрической активности на более длительный паттерн нажатий на кнопку. В похожем наблюдении при ритмическом постукивании пальцем с частотой один удар в секунду во время бодрствования наблюдалось увеличение мощности дельта-колебаний ЭЭГ. Авторы расценили это как явление навязывания ритма [18]. В начале выполнения ПМТ бета-ритм на фоне неполного выполнении десятисекундного паттерна нажатий быстро снижается до величин, наблюдаемых перед активацией. Мы предполагаем, что в этих обстоятельствах субъект начинает засыпать.
Сопоставление ЭЭГ в разные фазы выполнения ПМТ (счет в уме от одного до десяти с синхронными нажатиями на кнопку и только счет) выявило различия в характеристиках бета-ритма. Прекращение нажатий на кнопку приводит к существенному снижению мощности бета-ритма как при более коротком, так и при длительном пробуждении. Полученные результаты подтверждают роль бета-ритма в обеспечении моторной деятельности [19]. Отметим, что, когда субъект продолжает считать в уме без нажатий, снижение мощности этого ритма носит менее генерализованный характер.
Заключение
Исследование активации мозга здоровых субъектов в эпизодах пробуждения из второй стадии дневного сна и возобновления психомоторной деятельности показало следующее. Более высокая амплитуда дельта-колебаний, отражающая появление на ЭЭГ К-комплексов, и более выраженный сопровождающий их бета-ритм создают лучшие условия для пробуждения. В данном исследовании зафиксированы различия дельта- и бета-активности при активации с последующими пробуждениями разной длительности, сопровождающимися психомоторной деятельностью. Перед длительным эпизодом пробуждения амплитуда дельта-колебаний существенно выше, чем перед коротким. При этом бета-ритм в обоих случаях увеличивается одинаково. В ситуации короткого пробуждения на этапе деятельности характеристики дельта-колебаний и бета-ритма быстро снижаются. При длительном пробуждении низкочастотная активность на ЭЭГ уменьшается резко, а высокочастотная – постепенно. Показано генерализованное снижение мощности бета-ритма от паттерна нажатий на кнопку, сопровождающегося счетом в уме от одного до десяти, после пробуждения по отношению к последующему паттерну счета в уме без нажатий.
Наше исследование вносит вклад в изучение активаций во время сна, которые участвуют в его регуляции, но могут учащаться, усиливаться и тем самым приводить к избыточной фрагментации, вызывать моторную активность и нарушать сон. Изменения характеристик низкочастотной и высокочастотной составляющих ЭЭГ во время сна характеризуют эпизоды активации и могут служить объективными показателями его качества.
Работа выполнена в рамках государственного задания Министерства образования и науки Российской Федерации на 2021–2023 гг.
Конфликт интересов отсутствует.
Ye.A. Cheremushkin, PhD, N.Ye. Petrenko, PhD, V.B. Dorokhov, PhD
Institute of Higher Nervous Activity and Neurophysiology RAS
Contact person: Yevgeny A. Cheremushkin, khton@mail.ru
Neurophysiologic correlates of different duration spontaneous awakening episodes from the second stage of daytime sleep, which were accompanied by psychomotor activity, were studied in 17 practically healthy subjects. A psychomotor test was used, which consisted of two repetitive tasks: a pattern of mental counting from 1 to 10 with synchronous button presses with one hand and a counting pattern without presses. In each subject, EEG was analyzed in situations of short (6-9 presses) and long (at least 2 complete patterns with presses and a pattern without presses between them) performance of this activity during an episode of awakening. The amplitude and power characteristics of delta oscillations (K-complexes) and the accompanying beta rhythm were evaluated using wavelet transformation. The amplitude and power characteristics of delta oscillations (K-complexes) and the accompanying beta rhythm were evaluated using wavelet transformation. Their values are larger in the case when activation in the brain during sleep ends with awakening. In turn, before a long episode of awakening, the amplitude of delta oscillations is significantly higher than before a short one. At the same time, the beta rhythm grows equally in both cases and does not differ. Before the onset of tapping, delta activity decreases rapidly in both cases and reaches the level before brain activation and awakening. Beta activity decreases more rapidly during short awakening than during prolonged awakening. During prolonged awakening, a generalized decrease in beta rhythm power is shown from the pattern of counting with tapping to counting without tapping. Activation episodes during sleep are involved in its regulation, but can become more frequent, intensified, and thus lead to excessive fragmentation, induce motor activity, and disrupt it. Changes in the characteristics of low-frequency and high-frequency components of the EEG characterize activation episodes and can be objective indicators of sleep quality. Changes in the level of delta oscillations and beta rhythm during the transition from sleep to activity can be used to assess the efficiency of cognitive function recovery after awakening.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.