Анализ изменений мощностных характеристик электроэнцефалограммы при засыпаниях во время дневного сна после самопроизвольных пробуждений, сопровождаемых монотонной психомоторной деятельностью: в начале опыта и после эпизодов второй стадии сна
- Аннотация
- Статья
- Ссылки
- English
Ухудшение качества сна, в частности его фрагментация разной этиологии, достаточно распространенное явление [1], которое для более успешной терапии требует исследования мозговых коррелятов [2] для оценки нейронных механизмов, когнитивной динамики и клинических последствий [3]. Практически все научные работы в этой области сосредоточены на периоде начала сна (sleep onset, стадия сна N1). Повторные засыпания в случае прерывания сна самопроизвольными пробуждениями остаются мало изученными. Мы попытались восполнить этот пробел.
Нейрофизиологические корреляты процесса начального засыпания хорошо изучены [4, 5]. Этот процесс на электроэнцефалограмме (ЭЭГ) сопровождается кратковременными (несколько секунд) переходами с высокой частотой и низкой амплитудой к низкочастотным, высокоамплитудным медленным волнам и обратно, что характеризует колебания бодрствования и «имеет тенденцию систематически подавлять альфа-ритм в пользу прогрессивного замедления активности ЭЭГ» [4]. Засыпание представляет собой постепенный и неоднородный процесс как с пространственной, так и с временнόй точки зрения [5]. В разных областях коры во время наступления сна наблюдаются локальные паттерны синхронизации активности ЭЭГ, подразумевающие временное сосуществование активности, подобной бодрствованию, и активности, подобной сну. При этом разные области коры демонстрируют снижение активности не одновременно, причем в разных частотных диапазонах [6].
В исследованиях засыпания наряду с нейрофизиологическими коррелятами используются и поведенческие маркеры. Так, непрерывные нажатия на кнопку [7], сжимания мячика для снятия стресса, наполненного гелием, синхронизированные с дыханием [8], и чередование нажатий на кнопку правой и левой рукой по десять раз с синхронным счетом в уме (психомоторный тест, ПМТ) [9] хорошо реагируют на изменения в состоянии обследуемого. Монотонная деятельность погружает большинство субъектов в сон как в начале опыта, так и позже, после спонтанных пробуждений и возобновления деятельности, прерванной сном. Распределение эпизодов засыпания и пробуждения во время сна, их продолжительность, а в последнем случае и правильность выполнения предписанной инструкцией деятельности позволяют оценить функциональное состояние субъекта и уровень его сознания в эти периоды.
Ранее в опытах с дневным сном, исследованиях засыпания после спонтанных пробуждений с помощью ПМТ в его унимануальной модификации (чередование десяти нажатий на кнопку правой рукой со счетом в уме и только счет без нажатий) [10] мы показали следующее. При общей тенденции снижения степени бодрствования во время засыпания сохранение уровня активации лобных областей обеспечивает выполнение в этих условиях психомоторной, когнитивной деятельности. Ее прерывание в начале сна (на первой стадии), вероятно, оставляет следовой эффект в виде продолжающейся активации, которая после пробуждения дает возможность быстро возобновить выполнение заданий теста [11]. Кроме того, мы обнаружили, что более длительное пробуждение по отношению к более короткому (оба сопровождались выполнением ПМТ и далее переходили в засыпание) после эпизода второй стадии сна (N2) сопровождается более выраженным широко распространенным по коре низкочастотным альфа-ритмом [12]. Иными словами, мы установили зависимость характеристик ЭЭГ во время пробуждения от его продолжительности.
Целью данной работы является изучение изменений нейрофизиологических показателей, которые сопровождают колебания функционального состояния испытуемого, и уровня его сознания при повторных засыпаниях после эпизодов возобновления психомоторной деятельности – в начальный период выполнения теста (N1) и на N2.
В задачи исследования входили:
- вычисление мощностных показателей дельта-, тета-, альфа-1-, альфа-2- и бета-ритмов ЭЭГ при засыпаниях в течение дневного сна во время выполнения ПМТ;
- сравнение вычисленных величин:
- на разных стадиях сна (в конце начального периода выполнения теста (N1), за которым следует вторая стадия сна (N2)), и на N2 после спонтанных пробуждений;
- после эпизодов пробуждения разной продолжительности;
- на двух последовательных десятисекундных отрезках засыпания.
Материал и методы
В исследовании принимали участие 34 студента московских вузов (26 женщин и восемь мужчин) в возрасте 19–22 лет, практически здоровые лица, правши. Исследование одобрено этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН (протокол от 3 июня 2019 г. № 2) и соответствовало этическим нормам Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. Неврологические, психиатрические заболевания и расстройства сна у участников исследования ранее не диагностировались, они не принимали лекарственных препаратов. Согласно инструкции, они должны были отказаться от приема алкоголя за сутки до начала исследования. В день эксперимента было рекомендовано воздержаться от приема тонизирующих средств, таких как кофе, крепкий чай, шоколад, энергетические напитки и проч. Продолжительность ночного сна перед дневным исследованием определяли с помощью опросника «Дневник сна» [13]. Испытуемые спали в среднем (M) 5,75 ± 2,26 часа,
Использовали непрерывно-дискретный ПМТ в унимануальной модификации [10]. Испытуемые считали в уме от одного до десяти, одновременно при каждом отсчете они должны были большим пальцем правой руки нажимать на кнопку, зафиксированную на указательном пальце той же руки. Затем следовало продолжить счет в уме от одного до десяти без нажатий. Чередование счета с нажатиями и без нажатий участники исследования продолжали до тех пор, пока не засыпали. Показателем засыпания служило прекращение нажатий на кнопку. При спонтанных пробуждениях испытуемые должны были возобновить выполнение теста.
Начало эксперимента – с 13.00 до 16.00. Продолжительность записи ЭЭГ – от 55 минут до 1 часа 10 минут. Исследование проводилось в затемненном звукоизолирующем проветриваемом помещении, в котором поддерживалась постоянная комфортная температура. Во время записи ЭЭГ испытуемые находились в положении лежа (на кушетке) с закрытыми глазами.
ЭЭГ регистрировали с помощью шлема с хлорсеребряными электродами с 17 отведениями в соответствии со схемой 10–20% (референтные электроды располагались на мастоидах, сопротивление – до 5 кОм, частота дискретизации – 500 Гц, полоса пропускания усилителя – 0,5–40 Гц). Записывались также электроокулограмма и механограмма нажатий на кнопки.
При первом виде исследования засыпаний у каждого испытуемого выделяли два отрезка безартефактной записи ЭЭГ – в конце N1 после последнего паттерна нажатий, за которым через непродолжительное время следовала N2, и по окончании спонтанного пробуждения после первого эпизода N2. Длина отрезков – 30 секунд. Принадлежность участков ЭЭГ к периоду начала сна (sleep onset) оценивали визуально с помощью стандартных критериев AASM [14]. Дополнительным критерием начала засыпания служило отсутствие на механограмме поведенческих показателей выполнения ПМТ.
При втором виде исследования у испытуемых выделяли по четыре безартефактных отрезка ЭЭГ, которые соответствовали засыпанию после эпизода пробуждения. Первые два – в начале опыта, до засыпания, которое приводило к появлению первого эпизода N2. Этому предшествовали следующие обстоятельства. Субъект бездействовал не менее 30 секунд, далее он выходил из дремотного состояния и начинал нажимать на кнопку. В первом случае был один неполный паттерн нажатий (от шести до девяти), во втором – не менее одного полного цикла выполнения теста (десять нажатий и далее цикл счета «про себя») в начале деятельности и неполный паттерн нажатий в конце. В обоих случаях между прекращением нажатий и следующим возобновлением выполнения ПМТ должно было пройти не менее 30 секунд. Далее в обоих случаях выделяли 20-секундный отрезок ЭЭГ. Два других отрезка выбирали аналогичным образом в ситуациях, когда испытуемый не менее 30 cекунд перед пробуждениями находился в N2. Если отрезков, соответствующих этим критериям, было несколько, выбирали тот, которому предшествовал наибольший период дремоты без нажатий на N1 или сон на N2. Условиям такого отбора из 34 испытуемых соответствовали 17 (13 женщин и четыре мужчины в возрасте 19–21 года). Отметим, что в условиях N1 субъект снова начинал нажимать на кнопку через непродолжительное время (от 24 до 31 секунды), а на N2 позже (от 53 секунд до 4,8 минуты). Принадлежность участков ЭЭГ к разным стадиям сна также оценивали визуально по AASM [14].
Для определения амплитудно-мощностных характеристик биоэлектрической активности коры для обоих видов исследования проводили непрерывное вейвлет-преобразование на основе материнского комплексного Morlet-вейвлета (Matlab 78.01). Параметры для скриптов брали из работы C. Tallon-Baudry и соавт. [15]. Перед обработкой фильтровали сигнал на частоте 50 Гц, чтобы исключить влияние наводки аппаратуры. Вычисляли модуль коэффициентов вейвлет-преобразования (КВП). Карты распределения значений КВП строили в полосе 0,5–40,0 Гц с шагом 0,5 Гц и разрешением по времени 0,01 секунды. Внутри дельта- (1–3,5 Гц), тета- (4–7,5 Гц), альфа-1- (8–10,5 Гц), альфа-2- (11–13,5 Гц) и бета-диапозонов (14–21 Гц) проводили усреднение КВП по частотам. Затем полученные на 20-секундных отрезках ЭЭГ частотные характеристики усредняли по времени – по 10 секунд. Полученные значения также усредняли по всем отведениям ЭЭГ.
Суммарные (усредненные по временнм интервалам как для отдельных отведений ЭЭГ, так и для усредненных по всем отведениям) величины амплитудно-мощностных характеристик биоэлектрической активности подвергали дисперсионному анализу (ANOVA RM). При первом виде исследования рассматривали влияние таких факторов, как ситуация (два уровня – засыпание в начале опыта в конце N1, повторное засыпание после пробуждения после эпизода N2) и отведения (17 уровней, по числу отведений ЭЭГ). Анализ осуществляли для каждого выделенного частотного диапазона. Проводили post-hoc-анализ методом Фишера. Для выбранных исходя из результатов дисперсионного анализа частотных диапазонов для каждого отведения ЭЭГ с помощью парного критерия Стьюдента оценивали значимость изменений амплитудно-мощностных характеристик между исследуемыми засыпаниями.
При втором виде исследования рассматривали влияние на амплитудно-частотные характеристики ЭЭГ таких факторов, как стадия сна (два уровня (N1 и N2)), длительность пробуждения (два уровня (засыпания после эпизода пробуждений – короткого и продолжительного)), время (два уровня (два последовательных десятисекундных интервала при засыпании)). Проводили post-hoc-анализ методом Фишера. С помощью парного критерия Стьюдента оценивали значимость различий исследуемых показателей, полученных в ситуациях засыпания после короткого и более длительного эпизода пробуждения – для каждого отведения ЭЭГ. Анализ осуществляли для каждого из исследуемых частотных диапазонов. Все результаты получали с использованием поправки Гринхауза – Гессера. Все статистические вычисления проводили с помощью пакета программ SPSS 13.0.
Результаты
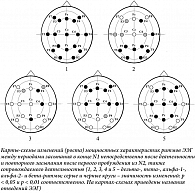
При первом виде исследования с помощью ANOVA RM выявлено изолированное влияние фактора «ситуация» на дельта- (F (1,26) = 26,84; p < 0,001), тета- (F (1,26) = 19,11; p < 0,001), альфа-1- (F (1,26) = 4,41; p = 0,046), альфа-2- (F (1,26) = 6,52; p = 0,017) и бета-ритмы (F (1,26) = 13,38; p = 0,001). При взаимодействии факторов «ситуация» и «отведения» на статистически значимом уровне отмечается влияние на дельта- (F (4,105) = 11,69; p < 0,001) и тета-уровни (F (2,65) = 6,78; p = 0,001). При повторном засыпании наблюдался высоко значимый рост мощностных характеристик ЭЭГ в дельта- (t = -5,18; df = 26; p < 0,001) и тета-диапазонах частот (t = -4,372; df = 26; p < 0,001). В низкочастотном альфа-диапазоне мощность после повторного пробуждения после прекращения нажатий слабо возрастала (t = -2,00; df = 26; p = 0,046). В альфа-2- (t = -2,554; df = 26; p = 0,017) и бета-диапазонах (t = -4,372; df = 26; p < 0,001) увеличение было более выраженное. На рисунке 1 показаны изменения (рост) мощностных характеристик ритмов ЭЭГ между периодами первичного и повторного засыпания.
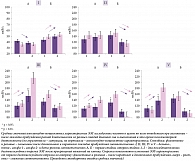
Результаты дисперсионного анализа при втором виде исследования представлены в таблице и на рис. 2.
Post-hoc-анализ показал различия при засыпании в частотных характеристиках ЭЭГ на двух последовательных отрезках записи – в зависимости от длительности предшествовавшего ему эпизода пробуждения (рис. 2). Выявлено также, что на втором отрезке по отношению к первому при засыпании после длительного и короткого пробуждений эти характеристики на N1 возрастают в альфа-1-, альфа-2- и бета-диапазонах и снижаются в дельта-диапазоне. На N2 наблюдается снижение мощности всех диапазонов. При этом значимость различий везде p < 0,001, за исключением случаев снижения в дельта- и роста в альфа-2-диапазонах на N1 после длительного пробуждения (p < 0,05).
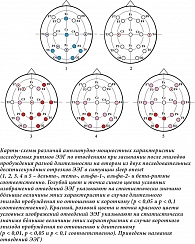
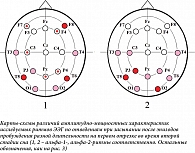
Значимые различия частотных характеристик по отведениям ЭЭГ при засыпании при втором виде анализа показаны на рис. 3 и 4. Результат был получен только для второго десятисекундного исследуемого отрезка ЭЭГ на N1 (рис. 3) и для первого – на N2 (рис. 4). Мы отразили на картах-схемах различия с уровнем значимости p < 0,1 (уровень тенденции), чтобы читатель смог получить более полное представление о распространенности соотношений между величинами исследуемых характеристик ЭЭГ.
Обсуждение
Показано, что спектральные характеристики ЭЭГ при засыпании зависят от стадии сна (N1 и N2) и продолжительности предшествовавшего ему эпизода спонтанного пробуждения, который сопровождался выполнением ПМТ. Исследуемые состояния, на фоне которых происходит засыпание, различаются и по сути. Начальный процесс перехода от бодрствования ко сну – сложный динамический процесс, который охватывает ряд метастабильных состояний от спокойного бодрствования до консолидированного сна [3] и сопровождается возвратно-поступательным движением ритмов ЭЭГ, отражающих колебания бодрствования [4]. В нашем исследовании он сопровождался выполнением ПМТ, который, с одной стороны, в силу монотонности содействует засыпанию, с другой – формирует с помощью инструкции внутреннюю потребность немедленно возобновлять его выполнение при ощущении перехода к бодрствованию. Выдвинуто предположение, что пробуждение связано с активностью бессознательной эпизодической памяти, содержащей инструкции по выполнению теста, и потребностью его выполнять [16]. Тем самым с помощью выполнения заданий ПМТ создаются условия для фрагментации сна и исследования повторных засыпаний. Существует мнение, что взаимодействие когнитивной нагрузки и качества сна, одним из характеристик которого является его фрагментация, играет решающую роль во влиянии на нейронную активность и когнитивные показатели [17].
После прекращения нажатий на кнопку, при засыпании в конце N1, мы наблюдали снижение дельта-ритма, отсутствие значимых изменений в тета-диапазоне и рост амплитудных показателей ЭЭГ во всех остальных диапазонах как после продолжительного эпизода пробуждения, так и после короткого. Снижение дельта-ритма мы связываем с уменьшением следового эффекта навязывания ритма при выполнении моторной деятельности [18]. Увеличение мощности альфа-волн можно объяснить прекращением моторной активности и переходом к состоянию дремоты. Бόльшие амплитудные значения этого ритма в случае с кратковременным выполнением ПМТ перед когнитивной деятельностью и их распространенность не только в затылочных отведениях ЭЭГ могут указывать на признаки большей сонливости [19]. Временнáя задержка в этом случае, возможно, связана с тем, что исследуемые продолжали счет в уме. Наш метод исследования сна относится к так называемым неотчетным, то есть не предполагающим вмешательство словесного отчета о своем состоянии [20], и мы не можем утверждать, что субъект в этот момент прекратил когнитивную активность. Увеличение мощности обоих альфа-ритмов также может быть связано с подготовкой к выполнению теста в следующем эпизоде ПМТ через непродолжительный период времени. Альфа-ритм обеспечивает пространственно-временнόе объединение структур мозга в общую сеть, что необходимо для роста уровня сознания и восстановления сознательной деятельности [21, 22]. Такой взгляд может объяснить и увеличение бета-активности в этот период. Показано, что такой рост коррелирует с усилением бдительности и способностью лучше осуществлять высшие когнитивные функции [23, 24].
Таким образом, обнаруженная нами повышенная активность в альфа-2- и бета-диапазонах может указывать на то, что, несмотря на следовые эффекты монотонной деятельности и сонливость, мозг стремится преодолеть их влияние и продолжить выполнение теста. Обнаружено возрастание мощности высокочастотных колебаний (бета и гамма) в конце эпизода микросна (3–15 секунд) с немедленным возобновлением когнитивной деятельности [25]. Предположительно этот факт характеризует восстановление связи субъекта с внешней средой и синхронизацию процессов внимания и памяти (в том числе припоминание инструкции) для быстрого возобновления выполнения задачи.
В первом виде исследования при повторном засыпании после пробуждения из N2 и деятельности в условиях инерции сна, то есть ощутимой сонливости [26], показано генерализованное увеличение мощности дельта- и тета-ритмов, а также рост альфа-ритма с локализацией в передних областях, что свидетельствует о более выраженном по отношению к засыпанию в конце N1 уровне сонливости [4, 19].
Во втором виде исследования засыпания после пробуждения из N2 отмечается рост уровня дельта-активности на ЭЭГ от первого отрезка (непосредственно после прекращения нажатий) к последующему, что приближает возвращение испытуемого в N2 [24]. Показано также снижение мощности всех высокочастотных ритмов от первого отрезка к последующему, а также бόльшие спектральные величины альфа-1- и альфа-2-ритмов на первом отрезке в ситуации с короткой деятельностью. В последнем случае это может указывать на более выраженный уровень сонливости в начале засыпания у субъектов, которые после пробуждения из N2 смогли выполнить, правда частично, первый паттерн нажатий. Существенное снижение обоих альфа- и бета-ритмов от первого ко второму отрезку после прекращения психомоторной активности как на коротком интервале времени, так и на более длительном может свидетельствовать о снижении уровня сознания и высших когнитивных функций в этот период [21–24]. На фоне поведения всех остальных частот снижение тета-активности мы объясняем в большей степени прекращением психомоторной деятельности и связанным с ней когнитивным контролем [27], чем снижением давления сна. В исследовании тета-колебаний во время выполнения когнитивных задач и лишения сна различий между ними не обнаружено, но получены доказательства, что «в обоих случаях тета-колебания генерируются корковыми областями, которые не требуются для текущего поведения. Поэтому, по крайней мере у людей, тета-колебания могут отражать либо корковое отключение, либо торможение» [28].
Заключение
Наше исследование показало различия в частотных характеристиках ЭЭГ при повторных засыпаниях после пробуждений, сопровождаемых психомоторной деятельностью, на разных стадиях сна. Генерализованное увеличение мощности дельта- и тета-ритмов, а также рост альфа-ритма с локализацией в передних областях после эпизода пробуждения из N2 по отношению к засыпанию в конце N1 указывают на более выраженный уровень сонливости. Обнаруженный нами к концу засыпаний рост мощности альфа-1-, альфа-2- и бета-диапазонов в период sleep onset, особенно после короткого пробуждения, свидетельствует о том, что, несмотря на следовые эффекты монотонной деятельности и дремоту, мозг стремится преодолевать их влияние и быть готовым возобновить деятельность. Засыпание после пробуждений разной длительности из N2 сопровождается существенным ростом дельта- и снижением альфа-1-, альфа-2- и бета-активности, что может говорить о быстром снижении уровня сознания и высших когнитивных функций в этот период. Функциональное состояние субъекта при засыпании зависит в большей степени от стадии сна, чем от длительности предшествовавшего ему эпизода пробуждения, сопровождаемого деятельностью.
Настоящее исследование вносит вклад в понимание перехода от деятельности ко сну, способствует лучшему распознаванию периода сонливости и позволяет глубже изучить характеристики колебаний бдительности и внимания в этот период. Полученные объективные нейрофизиологические характеристики засыпаний на разных стадиях сна могут быть использованы для лучшей диагностики и лечения расстройств сна при нарушениях его качества и избыточной фрагментации, а такжe для контроля и прогнозирования нежелательных засыпаний в повседневной работе.
Работа выполнена в рамках Государственного задания Министерства образования и науки Российской Федерации на 2024–2026 гг.
Конфликт интересов отсутствует.
Ye.A. Cheremushkin, PhD, N.Ye. Petrenko, PhD
Institute of Higher Nervous Activity and Neurophysiology of the Russian Academy of Sciences
Contact person: Yevgeny A. Cheremushkin, khton@mail.ru
In healthy young adults in the first and second stages of daytime sleep, falling asleep after episodes of spontaneous awakening of different duration accompanied by psychomotor activity was investigated. A generalized increase in the power of delta and theta EEG rhythms, as well as an increase in alpha with localization in the anterior regions after an episode of awakening from the second stage relative to falling asleep at the end of the first stage indicates a more pronounced level of sleepiness. The increase in the power of the alpha1, alpha2, and beta bands in the first stage, especially after a short awakening, that we found toward the end of falling asleep indicates that despite the trace effects of monotonous activity and drowsiness, the brain tends to overcome their influence and be ready to resume activity. Falling asleep after awakenings of different durations from the second stage is accompanied by an increase in delta and a decrease in alpha1, alpha2 and beta activity, which may indicate a rapid decline in consciousness and higher cognitive functions, during this period. The subject's functional state when falling asleep depends more on the stage of sleep than on the duration of the episode of awakening accompanied by activity that preceded it. The study contributes to the understanding of the transition from activity to sleep, helps to better recognize the period of sleepiness, and allows for a deeper study of the characteristics of vigilance and attention fluctuations during this period.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.