К вопросу эффективности терапии доброкачественной патологии молочных желез
- Аннотация
- Статья
- Ссылки
- English


Введение
Экология мегаполисов, неправильное питание, отсутствие физических нагрузок, стрессы и возрастающий темп жизни способствуют неуклонному росту болезней цивилизации. Стресс-индуцированные перестройки нервной, эндокринной и иммунной систем негативно влияют на физиологический гомеостаз женской репродуктивной системы. Этим обусловлено частое сочетание у одной пациентки нескольких нозологий, в основе патогенеза которых лежит феномен патологической клеточной пролиферации (миома матки, эндометриоз, гиперпластические процессы эндометрия, доброкачественная патология молочных желез).
Доброкачественные дисплазии молочных желез (ДДМЖ) лидируют среди патологии женской репродуктивной системы. Наиболее часто наблюдается диффузная форма (N60 по Международной классификации болезней 10-го пересмотра), на ее долю приходится 60–80% всей совокупности ДДМЖ.
На современном этапе ДДМЖ не является облигатным предраком. Однако ранняя диагностика патологии молочных желез на стадии диффузного процесса, проведение эффективного патогенетического лечения, а также динамическое наблюдение реализуют программу ранней профилактики рака молочной железы, который занимает первое место в онкологической заболеваемости и смертности женщин России [1–3].
С 2009 г. диагностика и лечение доброкачественной патологии молочных желез входят в обязанности специалиста акушера-гинеколога. Сегодня практически все регионы России имеют, кроме приказа Министерства здравоохранения Российской Федерации от 1 ноября 2012 г. № 572-н, утвержденные на местном уровне рекомендации по диагностике и маршрутизации женщин с патологией молочных желез, а также схемы терапии ДДМЖ. Однако необходимо признать, что до сих пор в клинической практике используются препараты, доставшиеся в наследие от коллег-онкологов, или лекарственные средства без показания для терапии патологии молочных желез [4, 5].
Установлено, что важную роль в патогенезе ДДМЖ играет активность пролиферации и апоптоза клеток ткани молочных желез, за которую отвечает определенный баланс цитокинов. Триггерные механизмы патологической пролиферации многочисленны и зачастую точно не установлены. До сих пор активно изучаются клинические и иммунологические аспекты инициализации онкопролиферации. Известен широкий спектр цитокинов, которые принимают участие в предраковых и злокачественных превращениях клеток на фоне хронического воспаления или стресса [6, 7].
При анализе данных доступной современной литературы можно обратить внимание на небольшое количество исследований, в которых изучалось состояние баланса цитокинов, ответственных за «пролиферативный потенциал» клеток ткани молочной железы, а также их уровень в динамике при оценке эффективности терапии ДДМЖ.
Цель
Нами было проведено исследование с целью комплексной оценки показателей цитокинового баланса при терапии ДДМЖ.
Материал и методы
В рамках целевой межведомственной научно-практической программы «Здоровье женщины», совместного проекта Сибирского государственного медицинского университета, Научно-исследовательского института фармакологии и регенеративной медицины им. Е.Д. Гольдберга, Научно-исследовательского института психического здоровья было обследовано 85 женщин репродуктивного возраста и проведена оценка эффективности терапии диффузной ДДМЖ лекарственным препаратом Мастопол® (Россия). Клиническое исследование (фаза IV) являлось проспективным (параллельные группы), рандомизированным (метод «случай – контроль») и моноцентровым.
Основную группу составили 60 пациенток (средний возраст 34,3 ± 0,4 года) с диагнозом «диффузная доброкачественная дисплазия молочных желез», категория 2 по системе BI-RADS (Breast Imaging Reporting and Data System – система описания и обработки данных лучевых исследований молочной железы). Наличие патологии молочных желез верифицировалось с помощью ультразвукового исследования (линейный датчик 14 МГц, цветовое и энергетическое допплеровское картирование) в первую фазу менструального цикла (на пятый – десятый день). Пациенткам старше 35 лет дополнительно выполнялась рентгенологическая маммография. Полученные эхографические показатели позволили разделить пациенток с ДДМЖ в соответствии с клинико-рентгенологической классификацией Н.И. Рожковой (1993) на три клинических группы: первая группа (n = 20) с преобладанием железистого компонента, вторая группа (n = 20) с преобладанием кистозного компонента, третья группа (n = 20) с преобладанием фиброзного компонента. Контрольную группу составили 25 практически здоровых женщин соответствующего возраста без соматической и гинекологической патологии.
Концентрации цитокинов (интерлейкинов (ИЛ) 4 и 10, фактора некроза опухоли альфа (ФНО-альфа), интерферона-гамма (ИФН-гамма) в сыворотке крови и супернатантах клеточных культур определялись методом твердофазного иммуноферментного анализа с использованием коммерческих тест-систем (ЗАО «Вектор-Бест», Новосибирск, Россия). Измерение и обработка результатов иммуноферментного анализа проводились при помощи оборудования Bio-Rad (Microplate Reader, Model 3550).
Из статистических методов обработки результатов обследования выполнялся анализ вариационных рядов методами описательной статистики с вычислением медианы (Ме) и верхнего и нижнего квартилей. Качественные признаки оценивались путем вычисления абсолютных и относительных частот. Для анализа различий по количественным признакам использовались методы множественного сравнения независимых групп (ANOVA Краскела – Уоллиса) и методы сравнения двух независимых групп (U-тест Манна – Уитни). Для изучения связей между признаками применялся корреляционный анализ Кенделла. Разницу значений принимали статистически значимой при p < 0,05. Статистический анализ данных осуществлялся при помощи пакета программ Statistica 6.0 (StatSoft, USA).
Результаты и их обсуждение
Препарат Мастопол® – отечественное гомеопатическое лекарственное средство, представляющее собой комбинацию трех растительных и одного минерального компонентов с доказанной эффективностью при терапии патологии молочных желез благодаря противовоспалительному, антиоксидантному, противоотечному, анальгезирующему, иммуномодулирующему действию. Опубликованы данные о противоопухолевом эффекте Thuja occidentalis (туя), а также антиканцерогенном и антиметастатическом действии Conium maculatum (болиголов пятнистый) и Hydrastis canadensis (желтокорень канадский). Calcium fluoratum (флюорат кальция) активно используется в гомеопатических препаратах при гипотиреозе, ожирении, метаболических нарушениях, нервных и психических расстройствах, а также для снижения риска онкопатологии [8–12].
Мастопол® принимается по одной таблетке три раза в день за полчаса до еды или через час после еды сублингвально. Согласно инструкции курс лечения составляет восемь недель с возможностью продления или повторения лечения по согласованию с врачом. Нами была выбрана длительность лечения 12 недель с учетом цели получения данных об эффективности терапии в зависимости от формы ДДМЖ.
К окончанию курса терапии Мастополом было зарегистрировано достоверное (р < 0,05) улучшение клинической симптоматики заболевания относительно болевого синдрома и пальпаторных характеристик состояния молочных желез у всех пациенток. Однако относительно симптомов патологических выделений из сосков достоверных отличий в группах после курса терапии не установлено. Следует отметить, что наиболее высокая эффективность терапии по купированию масталгии получена при ДДМЖ с преобладанием железистого и кистозного компонентов, а по характеру и степени «уплотнения» молочных желез – при ДДМЖ с преобладанием фиброзного компонента (табл. 1).
Проблема правильной интерпретации полученных клинико-анамнестических, лабораторных и эхоскопических данных, а также определения формы ДДМЖ по-прежнему актуальна для специалистов гинекологов, онкологов и врачей ультразвуковой диагностики. Полученные при объективном осмотре с применением методов лучевой диагностики данные были автоматически обработаны с помощью разработанного нами диагностического алгоритма (патент РФ от 10.06.2012 № 2452389 «Способ дифференциальной диагностики форм фиброзно-кистозной болезни у женщин с сохраненной репродуктивной функцией»). Данная математическая модель позволяет не только просто и объективно диагностировать форму ДДМЖ у пациенток любого возраста, но и оценить эффективность проводимых лечебных мероприятий с позиции доказательной медицины. Результаты лучевых методов исследования в виде абсолютных значений признаков были внесены в предлагаемый алгоритм с последующим пересчетом диагностических коэффициентов. Математическая обработка полученных результатов показала, что основными значимыми объективными критериями оценки эффективности проводимой терапии были показатели толщины премаммарной клетчатки, фиброгландулярного слоя и ретромаммарной клетчатки в виде значения каждого из них, диапазона, в который попадает признак, и диагностического коэффициента, соответствующего данному диапазону [13].
При сравнительном анализе данных, полученных в ходе исследования эффективности терапии пациенток с ДДМЖ препаратом Мастопол®, сумма всех диагностических коэффициентов составила -3,0557220. Это меньше, чем пороговое значение, равное -1,255272505. Согласно анализу полученных результатов, ошибка риска составляет 0,3–0,7 при 95%-ном доверительном интервале. Следовательно, полученные показатели состояния молочных желез после лечения препаратом Мастопол® входили в диапазон значений, соответствующих показателям здоровых женщин (контрольная группа) (табл. 2).
На сегодняшний день доказано, что пролиферация клеток тканей молочной железы может быть эстрогензависимой, пролактинзависимой и прогестеронзависимой. На современном этапе развития науки изучаются иммунологические аспекты инициализации онкопролиферации. Из широкого спектра цитокинов именно ИЛ-4, ИЛ-10, ФНО-альфа, ИФН-гамма принимают участие в реализации механизмов «неправильной» пролиферации клеток и коррелируют со стадией рака молочной железы [14].
На настоящий момент в России зарегистрировано несколько препаратов с целевым показанием терапии ДДМЖ. Препарат трансдермального микронизированного прогестерона ингибирует процессы пролиферации стромы и эпителия протоков, поддерживает дифференцировку эпителиальных клеток и прекращает митотическую активность, обусловленную эстрогенами на фоне дефицита прогестерона. Препарат экстракта Vitex agnus-castus (витекс священный) нормализует уровень пролактина, который непосредственно стимулирует пролиферативные процессы в молочных железах, и опосредованно повышает чувствительность эстрогеновых рецепторов к наиболее активной фракции эстрогенов – эстрадиолу. Препарат на основе индолов позитивно влияет на баланс метаболитов эстрогенов, имеющих разную способность к инициации и активации клеточной пролиферации [15–17].
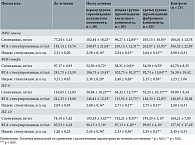
Эффективность применения препарата Мастопол® как средства для снижения активности процессов гормонозависимой пролиферации оценивалась по результатам его влияния на состояние уровней основных цитокинов – регуляторов молекулярных механизмов клеточной пролиферации. Известно, что уровень цитокинов в циркуляции зависит от многих факторов и не всегда отражает реальные изменения, особенно в зоне непосредственной локализации активных физиологических либо патологических процессов. В этой связи была изучена спонтанная секреция цитокинов (ИЛ-4, ИЛ-10, ФНО-альфа, ИФН-гамма) суточными культурами клеток крови и их секреция при стимуляции митогенами (табл. 3).
При изучении уровней спонтанной и стимулированной фитогемагглютинином (ФГА) продукции лимфоцитами периферической крови цитокинов было установлено, что после лечения средние значения показателей достоверно (р < 0,05) изменились у всех пациенток с ДДМЖ вне зависимости от клинической формы заболевания. До лечения у всех обследованных пациенток с ДДМЖ статистически значимо (р < 0,01) была повышена ФГА-стимулированная продукция дискриминантных в реализации стимулирующего влияния на пролиферативный потенциал клеток ФНО-альфа и ИЛ-4. Уровень конституционального синтеза этих интерлейкинов также был выше нормы. При терапии препаратом Мастопол® зарегистрировано достоверное (р < 0,01) снижение спонтанного и ФГА-стимулированного уровней ФНО-альфа и ИЛ-4 при всех формах ДДМЖ, а также показателей индекса стимуляции секреции данных цитокинов.
Спонтанная продукция ИЛ-10 и ИФН-гамма была понижена у пациенток с ДДМЖ по сравнению с женщинами соответствующего возраста без патологии молочных желез. Это может свидетельствовать о наличии у пациенток с ДДМЖ функционального иммунодефицитного состояния. При лечении препаратом Мастопол® происходила частичная адаптация организма – нормализовалась спонтанная продукция ИЛ-10 и ИФН-гамма, значимо повышалась ФГА-стимулированная продукция ИФН-гамма, направленная на активацию синтеза каскада провоспалительных цитокинов. Прием препарата Мастопол® в течение 12 недель лечения сопровождался также повышением индексов стимуляции продукции ИЛ-10 и ИФН-гамма за счет повышения их спонтанной продукции, а также параллельным снижением митогениндуцированной продукции ФНО-альфа. Выявленные закономерности по развитию функциональной иммуносупрессии при ДДМЖ указывают на целесообразность терапии препаратом Мастопол® длительностью не менее 12 недель.
Таким образом, исследование показало, что благодаря компонентам препарата Мастопол®, оказывающим антипролиферативное действие, на фоне применения препарата достоверно снижается содержание ФНО-альфа и ИЛ-4, ответственных за стимуляцию пролиферативных процессов, и повышается содержание ИЛ-10 и ИФН-гамма, обладающего антипролиферативным и иммуномодулирующим свойством. Применение препарата Мастопол® при различных клинических формах ДДМЖ эффективно как в монотерапии, так и особенно в комплексе с препаратами, патогенетически действующими на уровне гормональной регуляции.
Заключение
Лекарственный препарат Мастопол® действительно имеет доказанную высокую эффективность при терапии диффузной дисгормональной ДДМЖ. При этом значимыми объективными критериями оценки эффективности признаны не только клинические симптомы, но и определенные нами объективные эхографические показатели (толщина премаммарной клетчатки, фиброгландулярного слоя и ретромаммарной клетчатки). Разработанная нами математическая модель позволяет максимально объективно проводить диагностику и оценку эффективности терапии ДДМЖ, что дает возможность существенно ускорить и облегчить работу специалистов в практическом здравоохранении [18].
В нашей работе показано, что при ДДМЖ наряду с известными нарушениями в системе гормонального гомеостаза индуцируется иммунологическая недостаточность на уровне продукции цитокинов. Цитокины обеспечивают межклеточное взаимодействие не только в иммунной системе, но и в гормональной и нервной. Формируется феномен взаимного отягощения, или «порочный круг». По многочисленным данным литературы, снижение общей иммунобиологической реактивности патогенетически предрасполагает к возникновению онкопатологии [7].
Полученные нами данные свидетельствуют о том, что у пациенток с ДДМЖ, в отличие от здоровых женщин, дисбаланс цитокинов, осуществляемый через иммунную систему, ориентирован на повышение продукции ИЛ-4 и ФНО-альфа и снижение продукции ИЛ-10 и ИФН-гамма. Подобное смещение цитокинового профиля создает предпосылки для стимуляции пролиферативных процессов в тканях молочных желез через молекулярные механизмы регуляции гиперпластических процессов.
Степень онкологической безопасности в отношении гормонально чувствительных органов считается одним из самых важных факторов при подборе современной патогенетической терапии. В этой связи особую актуальность приобретает поиск ранних маркеров патологической пролиферации, позволяющих оценить риск развития этого состояния на доклинической стадии. Уровни цитокинов в крови слишком вариабельны и зависят от многих факторов, поэтому не могут использоваться в диагностике и прогнозе в качестве самостоятельных маркеров. Напротив, оценка их локального синтеза тканями и продукции их иммунокомпетентными клетками более точна для фундаментальной науки, но технически затруднительна для широкого применения в клинической практике. Исследование цитокинпродуцирующей функции мононуклеаров крови у пациенток с ДДМЖ позволило констатировать факт изменения показателей, характеризующих способность иммунокомпетентных клеток секретировать цитокины.
Наибольший риск для развития гормонзависимого рака молочных желез имеет эстрогензависимая пролиферация. Диагностика гормонального статуса по уровню гормонов сыворотки крови зачастую не дает точной картины гормонального баланса. Клиническая эффективность препарата Мастопол® доказана многочисленными исследованиями [19]. Препарат нормализует состояние уровней ключевых метаболитов эстрогенов: 16-альфа-гидроксиэстрона и 2-гидроксиэстрона. В этой связи представляют интерес данные об эффективности применения препарата Мастопол® в качестве средства снижения активности процессов гормонозависимой пролиферации [20].
Таким образом, в ходе проведенного исследования получены достоверные (р < 0,05) положительные результаты применения препарата Мастопол®, который использовался для нормализации соотношения основных цитокинов, участвующих в молекулярной регуляции патологической клеточной пролиферации гормонозависимой ткани молочных желез.
L.S. Sotnikova, E.V. Golubyatnikova
Siberian State Medical University, Tomsk
Contact person: Larisa Stepanovna Sotnikova, sotnikova-larisa@mail.ru
Тhe fundamental knowledge presents about the state of cytokine profile in benign breast pathology. The data obtained demonstrate the high efficiency therapy of drug Mastopol® during 3 months for normalization of the balance the main cytokines involved in the molecular regulation of abnormal cell proliferation hormone-dependent breast tissue.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.