К вопросу о микробиоме кожи
- Аннотация
- Статья
- Ссылки
- English
В данной работе приведены данные собственного клинического исследования линейки косметических средств, содержащих лизаты трех бактерий. По результатам исследования выявлено, что использование топических средств с про- и пребиотиками способствует улучшению корнеометрических показателей кожи (влажности, жирности и эластичности) и купированию сухости, зуда и шелушения.
В данной работе приведены данные собственного клинического исследования линейки косметических средств, содержащих лизаты трех бактерий. По результатам исследования выявлено, что использование топических средств с про- и пребиотиками способствует улучшению корнеометрических показателей кожи (влажности, жирности и эластичности) и купированию сухости, зуда и шелушения.
Кожа является самым большим органом человека и покрывает всю поверхность тела. Основная функция кожи заключается в формировании физического, химического и иммунологического защитного барьера между телом и внешней средой. Кожа состоит из многослойного ороговевшего эпителия, который подвергается терминальной дифференциации для приобретения прочной структуры. Нормальная поверхность кожи представляет собой кислую, высокосоленую, сухую и аэробную среду, но фолликулярно-сальные единицы являются относительно анаэробными и гораздо более богатыми липидами [1]. Всю поверхность кожи населяет микробиом, включая бактерии, грибы и вирусы. Комменсальный микробиом необходим для поддержания барьерной функции кожи и участия в основных физиологических процессах, происходящих в коже: физических, химических, микробных и как врожденных, так и адаптивных иммунологических способах выполнения барьерных функций кожи [1, 2]. Однако постоянное воздействие различных внешних и внутренних факторов может оказывать влияние на эту сбалансированную систему, вследствие чего возникают патофизиологические проблемы, связанные с воспалительными заболеваниями кожи, такими как инфекции, аллергические заболевания и аутоиммунные расстройства.
Микробиом кожи чрезвычайно разнообразен по количеству и активности организмов, его состав зависит от физиологии кожи, которая связана с микросредой, характеризующейся влажностью, сухостью и содержимым сальных желез. Кроме того, микробиом кожи претерпевает временные изменения с возрастом [3–5].
Предполагается, что формирование микробиома кожи начинается у плода. Наличие ДНК в микробиоме, например, видов родов Cutibacterium и Staphylococcus, было картировано в амниотической жидкости [6]. Во время нормальных родов кожа новорожденного подвергается воздействию микробов, населяющих родовые пути. Затем на микробиом кожи новорожденного начинает оказывать влияние взаимодействие с внешней средой. Микробиом кожи новорожденного сильно зависит от микробиома матери при рождении, и существуют значительные различия как в микробиоме кожи, так и в микробиоме кишечника между детьми, рожденными естественным путем, и теми, кто родился с помощью кесарева сечения [7–8]. Исследование M.G. Dominguez-Bello и соавт. показало, что с помощью мультиплексного пиросеквенирования гена 16S рРНК дети, рожденные естественным путем, приобрели бактериальные сообщества, похожие на микробные сообщества влагалища матери, в которых доминируют Lactobacillus, Prevotella или Sneathia spp., в то время как у детей, рожденных с помощью кесарева сечения, бактериальные сообщества кожи напоминают те, которые обнаруживаются на нормальной поверхности кожи, с доминированием Staphylococcus, Corynebacterium и Cutibacterium spp. [7]. В период полового созревания микробиом кожи претерпевает значительные изменения, поскольку секреция половых гормонов стимулирует созревание сальных желез и выработку кожного сала, переходя к более взрослому микробиому. Среди бактерий преобладают липофильные виды рода Cutibacterium, а среди грибов – Malassezia, при этом разнообразие в этот период уменьшается. Виды родов Staphylococcus и Streptococcus, которые более заметны у девочек, постепенно уменьшаются к окончанию пубертата [9].
Было показано, что микробиом необходим для целостности эпителиального барьера и функции кожного барьера. При повреждении кожи микробы вырабатывают метаболиты, которые активируют арильный углеводородный рецептор (AHR) в кератиноцитах, способствуя эпителиальной дифференциации и поддерживая эпителиальную целостность [10]. Другая роль микробиома заключается в секреции компонентов, составляющих липидную структуру. Результаты исследования с использованием модели мышей показало, что S. epidermidis секретирует сфингомиелиназу, которая помогает хозяину получать необходимые питательные вещества для бактерий и вырабатывать церамид, ключевой компонент эпителиального барьера, который предотвращает обезвоживание и старение кожи. В этом исследовании S. epidermidis способствует значительному повышению уровня церамида в коже и предотвращению потери воды поврежденной кожей с помощью сфингомиелиназы [11].
Химический барьер кожи организован многочисленными липидами и кислотами, секретируемыми эпидермисом и микробиомом. По сути, микробиом участвует в поддержании уровня нормального рН кожи и создании химической среды, которая враждебна для патогенных бактериальных колоний [12–13].
В дополнение к вышеупомянутым барьерам микробиом также стимулирует ряд врожденных иммунных реакций и поддерживает симбиотические отношения с кожей, когда кожный барьер нарушается. Например, S. epidermidis модулирует врожденную иммунную систему, активируя Т-клетки и повышая уровень перфорина-2, антимикробного пептида с уникальными свойствами против внутриклеточных патогенов [14]. Кроме того, специфический гликан, экспрессируемый в S. epidermidis, необходим для гомеостатической активации Т-клеток S. epidermidis с помощью взаимодействия с лектином C-типа в иммунных клетках человека [15]. Аналогичным образом Candida albicans, который является диморфным грибком, вызывающим слизисто-кожные и системные инфекции, может стимулировать иммунные реакции Т-хелперов (Th) 1 или Th17 в коже, защищая от кожной или системной инфекции [16]. Микробиом кожи модулирует выработку различных врожденных факторов, включая интерлейкин 1α (ИЛ-1α) [17], компоненты рецептора комплемента C5a [18] и антимикробные пептиды, полученные из кератиноцитов и себоцитов, для усиления врожденной иммунной системы посредством различных механизмов [19–21].
Микробиом кожи изменяется под влиянием факторов окружающей среды, диеты, некоторых лекарств, например антибиотиков, и ряда заболеваний [4, 22]. Такие же изменения микробиома происходят при ряде дерматологических патологий, и в некоторых исследованиях показано, что у лиц с дисфункцией кожного барьера, с реактивной кожей, которая чувствительна к физическим и химическим раздражителям, структура и разнообразие микробиома имеют значимые отличия от микробиома лиц с нечувствительной кожей [23–24].
В научном сообществе довольно давно рассматриваются вопросы нормализации кожного микробиома с помощью топического применения пробиотиков и пребиотиков [25–26]. Так, недавнее исследование показало, что с использованием пробиотического лизата – экстракта Bifidobacterium longum – возможно улучшить состояние реактивной кожи [27]. Было обнаружено статистически значимое улучшение по сравнению с плацебо по различным параметрам, связанным с воспалением, таким как уменьшение вазодилатации, отека, дегрануляции тучных клеток и высвобождения ФНО-альфа. Клиническое испытание на 66 женщинах в течение 29 дней продемонстрировало уменьшение сухости кожных покровов и других симптомов реактивной кожи и снижение чувствительности кожи, предположительно благодаря снижению реактивности нейронов [27].
Нами также проведено клиническое исследование линейки косметическим средств LE SANTI® с пробиотическим компонентом. В линейке предоставлен широкий выбор средств: крем липидовосстанавливающий «LE SANTI®» интенсивное питание для лица и тела, крем увлажняющий «LE SANTI®» с защитой от потери влаги для лица и тела, мусс увлажняющий «LE SANTI®» с тройным действием, крем-гель очищающий «LE SANTI®» липидовосстанавливающий для лица и тела, шампунь «LE SANTI®» восстановление чувствительной и сухой кожи головы и волос. В состав каждого средства входит BIOTIC COMPLEX3, представляющий собой комбинацию лизатов трех бактерий (Lactococcus lactis, Lactobacillus rhamnosus и Bifidobacterium longum) и пребиотиков (трегалозы и инулина). Также эти средства содержат различные увлажняющие и смягчающие агенты – растительные масла и экстракты, пантенол, натрия гиалуронат и другие.
Существуют данные, демонстрирующие противовоспалительную активность Lactococcus lactis, осуществляемую путем ингибирования люциферазы STAT3, индуцированную провоспалительным цитокином ИЛ-6 [28]. Стоит отметить, что повышенная экспрессия STAT3 встречается при ряде кожных воспалительных состояний, в частности при псориазе [29], а также по последним данным связана с зудом [30]. Помимо прочего Lactococcus lactis поддерживает микробиом кожи, активирует ее иммунитет и влияет на гены, связанные с гомеостазом кожи [31].
Лизат Lactobacillus rhamnosus оказывает защитное действие на кожный барьер. Он увеличивает экспрессию белков плотных контактов (клаудина 1 и окклюдина) и барьерных белков кожи, в частности филлагрина, который, как известно, играет значимую роль в патогенезе атопического дерматита [32]. Сочетание L. Rhamnosus с B. longum способствует экспрессии факторов заживления и ангиогенных факторов [33]. B. longum, как уже упоминалось ранее, в топических средствах выступает как противовоспалительный и увлажняющий агент [27].
В собственном клиническом исследовании приняло участие 50 волонтеров в возрасте от 18 до 64 лет. У всех волонтеров отмечался выраженный ксероз кожных покровов лица, рук и туловища. У части волонтеров также присутствовали такие неприятные симптомы, как гиперемия и зуд. Девять волонтеров имели в анамнезе диагноз розацеа эритематозно-телеангиэктатическая форма. 11 человек имели диагноз вульгарный псориаз в стадии ремиссии.
Волонтеры случайным образом были распределены в пять групп и получали следующие средства:
- первая группа – плацебо средств ухода;
- вторая группа – моющие средства ухода;
- третья группа – моющие средства ухода + увлажняющий мусс;
- четвертая группа – моющие средства ухода + увлажняющий крем;
- пятая группа – моющие средства ухода + липидовосстанавливающий крем.
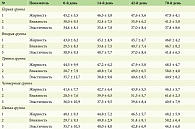
Для контроля за эффективностью назначенных средств ухода до начала применения были измерены корнеометрические показатели состояния кожных покровов: влажность, жирность и эластичность. Также данные показатели замеряли на 14-й, 42-й, 70-й день от начала применения средств ухода.
По результатам измерения влажности кожи было выявлено ее значительное снижение, клинически также отмечалась выраженная сухость кожи, жирность, напротив, либо находилась в пределах нормы, либо была повышена.
Лучшие результаты по увлажненности кожи были продемонстрированы в группе пациентов, применявших увлажняющий крем. Также положительная динамика корнеометрических показателей, особенно эластичности, была отмечена в группе пациентов, использовавших липидовосстанавливающий крем, и также нормализовались показатели увлажненности и эластичности в группе пациентов, применявших в качестве средства ухода увлажняющий мусс.
В третьей – пятой группах наблюдалось значительное улучшение состояния кожных покровов. Волонтеры отмечали снижение чувства стянутости кожи, исчезновение зуда. Также средства линейки LE SANTI® не оставляют ощущения жирности после применения и быстро впитываются. Во второй группе отмечен хороший эффект от применения шампуня LE SANTI® у волонтеров с шелушением на волосистой части головы, они также отмечали снижение интенсивности неприятных ощущений на коже головы и отсутствие ощущения сухости и ломкости волос.
За время применения средств линейки LE SANTI® не было отмечено ни одного случая нежелательных явлений у волонтеров, что говорит о безопасности и хорошей переносимости средств.
Клинический эффект от применения крема липидовосстанавливающего «LE SANTI®» интенсивное питание для лица и тела, мусса увлажняющего «LE SANTI®» с тройным действием, крема увлажняющего «LE SANTI®» с защитой от потери влаги для лица и тела достигается в период от 14 до 42 дней. Длительное использование средств также благоприятно сказывается на корнеометрических показателях кожи – увлажненности и эластичности, позволяя нормализовать их или значимо приблизить к нормальным значениям. Как показывают результаты корнеометрии, средства LE SANTI® не ожиривают кожу избыточно (показатели жирности достигают нормы и остаются в пределах нормальных значений), что также подтверждается субъективной оценкой волонтеров (таблица).
Понимание нормальной физиологии кожи и микробных взаимодействий позволяет лучше оценить гомеостатические механизмы, а также дает представление о том, как нарушения нормальной функции кожи связаны с ее микробиомом. Топография кожи, ее функция и микробный состав определяются не только месторасположением на теле, но и могут зависеть от ряда эндогенных и экологических факторов. Присущая микробиому кожи высокая сложность и изменчивость затрудняют определение его роли в конкретных физиологических процессах. В связи с этим требуются дальнейшие исследования взаимосвязи микробиома кожи и ее состояния, а также возможных вариантов терапии и ухода при заболеваниях кожи через воздействие на состав микробиома, в т.ч. и топическими средствами.
L.R. Sakaniya, PhD, I.V. Olenich, I.M. Korsunskaya, PhD, Prof.
Center for Theoretical Problems of Physicochemical Pharmacology of the Russian Academy of Sciences, Moscow
Moscow Scientific and Practical Center for Dermatovenereology and Cosmetology, Moscow
Contact person: Louise R. Sakaniya, sakania.luiz@yandex.ru
The skin is a physical, chemical, immunological protective barrier between the body and the environment. The community of bacteria, fungi and viruses living on the surface of the body is called the microbiome and helps maintain the protective functions of the skin. The microbiome is involved in maintaining epithelial integrity and is involved in the secretion of components of the lipid layer of the skin. Microorganisms inhabiting the skin regulate the pH level of the skin and stimulate a number of innate immune responses. Changes in the composition of the microbiome occur throughout a person's life. However, under the influence of various factors, for example, in a number of diseases, including dermatological ones, the balance of the microbiome can be disturbed, which entails dysfunction of the skin barrier. A number of studies in recent years on topical products containing pro- and prebiotics have shown that the use of such products improves skin characteristics and reduces inflammation.
This paper presents data from our own clinical study of a line of cosmetics containing lysates of three bacteria. The results of the study revealed that the use of topical products with pro- and prebiotics helps improve skin corneometric parameters (moisture, oiliness, and elasticity) and relieve dryness, itching, and flaking.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.