количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
ХI Российский конгресс «Инновационные технологии в педиатрии и детской хирургии»: Микробиота кишечника у детей: новые представления
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" №5
- Аннотация
- Статья
- Ссылки
Становление микрофлоры кишечника у младенца имеет важное значение для его роста и дальнейшего развития. Нарушение микробиоценоза кишечника может сопровождаться дисфункцией иммунитета, развитием аллергии с кожными и гастроинтестинальными проявлениями.
В своем докладе, прочитанном на ХI Российском конгрессе «Инновационные технологии в педиатрии и детской хирургии», заведующая кафедрой педиатрии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава РФ, д.м.н., заслуженный врач России, главный внештатный педиатр Центрального федерального округа России, профессор Ирина Николаевна ЗАХАРОВА, опираясь на широкую доказательную базу, осветила основные вехи истории изучения создания пробиотиков, изложила современные представления о формировании кишечного микробиоценоза у младенцев, концепцию применения пробиотиков в педиатрической практике, очертила перспективы развития этого направления в коррекции нарушений кишечной микробиоты.
Профессор И.Н. Захарова также сообщила результаты собственного исследования эффективности и безопасности применения синбиотика Нормобакт у детей с клиническими проявлениями дисбиоза толстой кишки.
Становление микрофлоры кишечника у младенца имеет важное значение для его роста и дальнейшего развития. Нарушение микробиоценоза кишечника может сопровождаться дисфункцией иммунитета, развитием аллергии с кожными и гастроинтестинальными проявлениями.
В своем докладе, прочитанном на ХI Российском конгрессе «Инновационные технологии в педиатрии и детской хирургии», заведующая кафедрой педиатрии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава РФ, д.м.н., заслуженный врач России, главный внештатный педиатр Центрального федерального округа России, профессор Ирина Николаевна ЗАХАРОВА, опираясь на широкую доказательную базу, осветила основные вехи истории изучения создания пробиотиков, изложила современные представления о формировании кишечного микробиоценоза у младенцев, концепцию применения пробиотиков в педиатрической практике, очертила перспективы развития этого направления в коррекции нарушений кишечной микробиоты.
Профессор И.Н. Захарова также сообщила результаты собственного исследования эффективности и безопасности применения синбиотика Нормобакт у детей с клиническими проявлениями дисбиоза толстой кишки.

Профессор И.Н. Захарова

Таблица 1. Функции микрофлоры кишечника

Таблица 2. Возрастная динамика смены штаммов бифидобактерий у детей
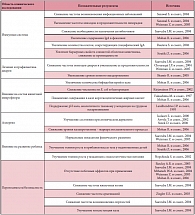
Таблица 3. Клиническая эффективность штамма BB-12 у детей

Таблица 4. Исходные результаты суммарного содержания короткоцепочечных жирных кислот (КЖК) у исследуемых групп

Рис. Результаты суммарного содержания короткоцепочечных жирных кислот (КЖК) в динамике у детей, получавших базисную терапию с и без синбиотика Нормобакт
История изучения кишечной микробиоты насчитывает более трех столетий. Еще в 1681 г. Антони ван Левенгук обнаружил микроорганизмы в фекалиях и выдвинул гипотезу о совместном существовании различных видов микроорганизмов в желудочно-кишечном тракте (ЖКТ). В 1850 г. Л. Пастер создал теорию о функциональной роли бактерий в процессе пищеварения, а Р. Кох продолжил исследования в этом направлении и разработал методику разграничения болезнетворных и полезных микроорганизмов. Учение о роли симбионтной микрофлоры в организме человека связано с именем великого русского ученого, лауреата Нобелевской премии И.И. Мечникова, который в 1888 г. обосновал теорию о том, что в кишечнике человека обитает комплекс микроорганизмов, оказывающих на организм «аутоинтоксикационный эффект».
Он полагал, что введение в ЖКТ «здравословных» бактерий способно стабилизировать действие кишечной микрофлоры и противодействовать интоксикации. Существенный вклад в изучение микрофлоры человека внес немецкий ученый Альфред Ниссле, который с 1912 г. активно занимался изучением бактерий. Им же в 1916 г. был впервые введен термин «дисбактериоз». «Второе дыхание» учение о кишечной микрофлоре получило уже в 70-е годы XX века, во многом благодаря работам А.М. Уголева, который определил дисбактериоз кишечника как изменение качественного и количественного состава бактериальной его флоры, возникающее под влиянием различных факторов: питания, изменения перистальтики кишечника, возраста, воспалительных процессов, лечения антибактериальными препаратами, стресса, тяжелых соматических заболеваний.
Новая эпоха в изучении кишечной микробиоты наступила 5–10 лет назад и связана с появлением молекулярно-генетических методов исследования, буквально перевернувших старые представления о микробиоценозе кишечника. По инерции мы еще продолжаем назначать бактериологический анализ кала на дисбактериоз. Так, согласно опросу педиатров, обучавшихся на циклах повышения квалификации, проводимых кафедрой педиатрии РМАПО (2011 г.), среди наиболее частых причин назначения исследования кала на дисбактериоз врачи назвали изменения стула на фоне антибиотикотерапии – 42,8% случаев, снижение аппетита у ребенка (нарушение прибавки в весе) – 23,8%, атопический дерматит – 76,2%, функциональные нарушения ЖКТ – 31,4%, изменение характера стула – 71,4%, желание родителей – 16,7%. При этом только 2,4% врачей считают, что дисбиоз кишечника первичен и при выявлении нарушений возможно предотвратить патологию ЖКТ. Подавляющее большинство врачей – 73,8% – уверены: дисбиоз кишечника вторичен, то есть необходимо устранить первопричину симптомов со стороны ЖКТ, и изменения микрофлоры в большинстве случаев исчезнут самостоятельно. Более того, 16,7% педиатров считают необходимым проводить коррекцию дисбиоза даже при отсутствии клинических проявлений.
Недостатки культурального метода исследования фекалий недавно обобщила в своих статьях блестящий российский микробиолог, профессор Людмила Ивановна Кафарская: дороговизна, длительность и трудоемкость, зависимость результата от техники сбора, вариабельность нормы, низкая разрешающая способность (100 жизнеспособных бактериальных клеток), а главное – большинство микроорганизмов в кале являются некультивируемыми. Активное внедрение молекулярно-генетических технологий в практику микробиологических исследований позволило получить новую информацию о составе и свойствах интестинальной микрофлоры у людей разного возраста. В последние годы был разработан целый арсенал методов с использованием полимеразной цепной реакции (ПЦР), позволяющих не только быстро и достоверно определить видовую принадлежность выделяемых микроорганизмов, но и проводить их количественную оценку непосредственно в исследуемом материале без этапа культивирования. К основным преимуществам молекулярно-генетических методов исследования профессор Л.И. Кафарская относит высокую специфичность, чувствительность (позволяет выявить единичные клетки бактерий и вирусы), возможность прямого определения наличия возбудителя, универсальность выявления различных возбудителей и высокую скорость получения результатов.
С внедрением метода секвенирования ДНК (1999) – определения нуклеотидной последовательности генов 16S РНК – удалось установить, что только 10% микрофлоры кишечника культивируется. Это значит, что наши представления о микрофлоре кишечника до сих пор весьма скудны. Метод полимеразной цепной реакции позволил установить, что в кишечнике живет около тысячи видов микроорганизмов, 99% из них – это анаэробы, состав которых существенно отличается от того, который ранее представлялся по данным посева. Согласно данным Национального института здоровья США (National Institutes of Health, NIH), только 10% клеток, входящих в состав человеческого организма, являются собственно человеческими клетками, а остальные 90% принадлежат бактериям, населяющим различные биотопы человека. Таким образом, homo sapiens является «суперорганизмом», в котором сосуществует большое количество различных организмов.
В 2008 г. запущен глобальный проект «Микробиом человека» (НМР), ставивший своей целью расшифровку генома бактерий, населяющих организм человека. Термин «микробиом» был впервые внедрен в 2001 г. для обозначения коллективных геномов микробиоты. Расшифровкой генома бактерий, населяющих ЖКТ, занимается Европейский консорциум MetaHIT. Уже расшифровано около 3 млн генов, что примерно в 150 раз больше набора генов человека. Результаты проекта позволят производить дальнейшие исследования взаимосвязей этих генов, состояния здоровья человека, развития заболеваний и его фенотипа. В 2010 г. в исследование метагенома человека также активно включились российские ученые. По версии журнала Science, расшифровка метагенома человека входит в число величайших научных открытий последнего десятилетия.
Удалось установить, что по составу микрофлоры всех людей можно разделить на три энтеротипа, каждый из которых включает множество видов бактерий, вне зависимости от места проживания, состояния здоровья или возраста. Исследователи объединили популяции бактерий в кластеры, названные согласно доминирующим в них родам. Данное открытие можно сравнить с делением людей на группы крови. Bacteriodes являются доминирующими у первого энтеротипа, Prevotella преобладает у второго энтеротипа, а Ruminococcus – у третьего. Так, энтеротип Bacteroides отличается активностью в отношении разложения углеводов, а также способствует выработке витаминов C, B2, B5 и H. Можно предположить, что первый энтеротип будет реже страдать атеросклерозом, либо его старт начнется в более позднее время. Ruminococcus, наоборот, улучшают всасывание углеводов и повышают уровень сахара в крови. Они синтезируют фолиевую кислоту и витамин B1. Prevotella в процессе жизнедеятельности разрушают защитный слизистый покров, что, вероятно, предрасполагает к дефектам слизистой оболочки кишечника. Следовательно, наличие определенного энтеротипа позволит прогнозировать особенности обмена веществ и указывать на предрасположенность к определенным заболеваниям. В то же время использование такого диагностического метода, как ПЦР, показало, что микрофлора кишечника каждого человека индивидуальна и постоянна.
C нарушенной микрофлорой кишечника ассоциируется широкий спектр заболеваний: инфекции, диарея, язвенная болезнь, рак желудка и рак толстой кишки, ожирение, мальабсорбция, сахарный диабет, пищевая аллергия, бронхиальная астма, воспалительные заболевания кишечника, кишечная колика, синдром раздраженного кишечника, поведенческие нарушения. Это обусловлено тем, что нормальная микрофлора кишечника участвует в разнообразных физиологических функциях организма: защитной, пищеварительной, детоксикационной и антиканцерогенной, синтетической, генетической, иммуногенной, в регуляции обмена холестерина и оксалатов (табл. 1).
Микрофлора кишечника участвует в формировании как местного (активация продукции иммуноглобулинов класса А (IgA), фагоцитарной активности), так и системного иммунитета. Само наличие бактерий в кишечнике приводит к постоянному антигенному тренирующему эффекту. В этом смысле кишечник можно образно назвать самым большим «иммунным органом» человека. В слизистой оболочке кишечника локализовано около 80% иммунокомпетентных клеток. Еще один факт, свидетельствующий о важной роли микробиоты: около 20% питательных веществ, поступающих в кишечник, и 10% энергии, вырабатываемой организмом человека, расходуется на питание кишечной микрофлоры.
Хотя, как упоминалось выше, кишечная микробиота индивидуальна и в целом постоянна, она не существует как нечто неизменное, представляя собой динамически меняющуюся смесь микробов, типичных для каждого человека. Основная защитная роль микробиоты у младенцев реализуется за счет наиболее многочисленной ее части – бифидобактерий. К факторам, влияющим на становление кишечной микробиоты у младенцев, относятся микрофлора матери (вагинальная, кишечная, кожная), окружающая среда, условия родов и способ родоразрешения, гестационный возраст, антибиотикотерапия матери и ребенка, характер вскармливания. Профессор Л.И. Кафарская выделяет следующие особенности микрофлоры толстой кишки у здоровых детей раннего возраста:
- эшерихии выявляются у 78% детей на 1-м месяце жизни и у 100% детей в возрасте старше 6 месяцев;
- клебсиеллы в повышенной концентрации (6,9–8,3 log КОЕ/г) обнаруживаются у 80–100% детей в возрасте 7–12 месяцев. К 2 годам их количество уменьшается;
- цитробактеры, ацинетобактеры определяются у 30% детей;
- стафилококки коагулазонегативные – у 100%, коагулазопозитивные (Staphylococcus aureus) – в 30–60% случаев;
- энтерококки стабильно выявляются у 100% детей в концентрации 7,5 ± 0,8 log КОЕ/г;
- грибы рода Candida обнаруживаются у 40–50% детей раннего возраста.
Присутствие условно-патогенной флоры в кишечнике приводит не только к стимуляции иммунной системы, но иногда сопровождается появлением признаков воспаления в слизистой оболочке кишечника. В этой связи возникает вопрос: является ли воспаление отражением процесса адаптации, то есть физиологическим, или свидетельствует о срыве адаптации и поражении слизистой оболочки кишечника, то есть патологическим? Одним из возможных маркеров воспаления в кишечнике может служить уровень кальпротектина в кале. Кальпротектин – воспалительный белок, который отражает степень гранулоцитарной инфильтрации слизистой оболочки, свойственной воспалению. Проведенное в 2010 г. N. Kapel и соавт. исследование уровня кальпротектина у здоровых доношенных и недоношенных младенцев показало повышенный уровень этого белка при некротическом энтероколите, инфекциях, аллергии, аутоиммунной энтеропатии и пониженный уровень – у детей с врожденными аномалиями энтероцитов.
Исследование кальпротектина в кале детей первых месяцев жизни с младенческими кишечными коликами и без них, проведенное J.H. Roads и соавт. (2009), показало, что он повышен у всех детей, что косвенно подтверждает наличие слабой степени воспаления слизистой оболочки кишечника в этом возрасте8. Однако у детей с кишечными коликами уровень кальпротектина оказался выше, чем в контрольной группе, более чем в 2 раза. С помощью молекулярно-генетического метода авторы обнаружили, что у всех детей с коликами имеются дисбиотические изменения, в частности более частое присутствие Klebsiella. На основании полученных данных был сделан вывод о важной роли альтерации кишечной микробиоты и связанного с ней воспаления слизистой оболочки кишечника в генезе кишечных колик у младенцев.
Таким образом, изучение состава кишечной флоры у детей первого года жизни позволило Л.И. Кафарской установить, что у младенцев, страдающих коликами, отмечается малое количество лактобацилл, большое количество грамотрицательных (культивируемых) бактерий, в том числе Escherichia coli, Klebsiella и др. Для снижения риска нарушений кишечной микробиоты у детей с кишечными коликами целесообразно назначение пробиотической терапии, которая позволит предотвратить рост патогенной и условно-патогенной микрофлоры, будет способствовать улучшению функции кишечника и модуляции иммунного ответа к потенциально патогенным микроорганизмам.
Пробиотики – это живые микроорганизмы, назначение которых в достаточном количестве оказывает положительное воздействие на организм человека. Основоположником концепции пробиотической терапии является И.И. Мечников, который в 1903 г. предложил практическое использование микробных культур-антагонистов для борьбы с болезнетворными бактериями. На сегодняшний день существует солидная доказательная база, посвященная пробиотикам, – 663 рандомизированных контролируемых исследования и 77 метаанализов. Показано, что использование пробиотиков у детей раннего возраста возможно только при соблюдении ряда требований, предъявляемых к «штаммам-кандидатам». Важнейшим из этих требований по причине незрелости защитного барьера слизистой оболочки ЖКТ у младенцев является безопасность. Таким образом, применяемые в педиатрической практике производственные штаммы должны удовлетворять следующим условиям:
- быть непатогенными и иметь человеческое происхождение;
- иметь антагонистическую активность по отношению к патогенным и условно-патогенным микроорганизмам;
- обладать жизнеспособностью, обусловленной устойчивостью к действию кислот и ферментов ЖКТ;
- обладать способностью прочно адгезироваться на слизистой оболочке толстой кишки;
- иметь стабильные генетические характеристики, в частности, не содержать R-плазмид (внехромосомных генетических элементов, детерминирующих множественную устойчивость к антибиотикам). Плазмидные фрагменты ДНК, содержащие R-гены, опасны по причине их вероятного распространения на другие микроорганизмы в нормальной флоре.
В клинической практике в основном используются три группы пробиотиков: бифидобактерии, лактобациллы и Saccharomyces boulardii. Они должны оказывать трехуровневый эффект:
1. Люминальный эффект:
- конкурентное ингибирование адгезии патогенов;
- антимикробный эффект;
- продукция органических кислот;
- синтез перекиси водорода;
- продукция бактериоцинов;
- влияние на pH кишечного содержимого.
2. Эпителиальный эффект:
- барьерная функция;
- синтез муцина;
- секреция секреторного IgA;
- инактивация токсинов к рецепторам.
3. Иммунный эффект:
- модуляция выработки цитокинов (фактора некроза опухоли альфа (ФНО-альфа), интерферона-гамма, интерлейкина-12 (ИЛ-12) и нормативных ИЛ-4, ИЛ-10);
- стимуляция врожденного иммунитета;
- модуляция дендритных клеток и моноцитов;
- повышенная экспрессия Fox3 + Treg-клеток.
К пробиотикам с доказанной эффективностью относятся Bifidobacterium longum BB 536, Bifidobacterium lactis BL BB12, Lactobacillus rhamnosus ATCC53103 (LGG), Lactobacillus casei DN-114001, Lactobacillus reuteri. Кстати, последняя в 2008 г. получила статус GRAS (generally recognized as safe), то есть «безусловно безопасной бактерии». Практическому врачу очень важно помнить, что бифидобактерии специфичны для определенного возраста (табл. 2) и патологии. Так, согласно Рекомендациям по применению пробиотиков (Recommendations for Probiotic Use), разработанным группой ученых Йельского университета, штаммы LGG, B. lactis, L. acidophilus, L. plantarum, L. johnsonil обладают уровнем доказательности А при лечении и профилактике аллергии; LGG, L. reuteri, S. boulardii, L. casei – уровнем доказательности А при лечении инфекционной диареи у детей; B. infantis – уровнем доказательности B, а B. animalis и L. plantarum – уровнем доказательности C при лечении детей с синдромом раздраженного кишечника.
В целом доказана эффективность пробиотиков при инфекционной диарее (подтвержденный эффект), антибиотик-ассоциированной диарее (скорее всего превентивный эффект, неподтвержденный терапевтический эффект), непереносимости лактозы (подтвержденный эффект), воспалительных заболеваниях толстой кишки (возможный эффект) и аллергии (возможный превентивный эффект, возможный терапевтический эффект). Различные штаммы отличаются по своим свойствам – L. casei стимулирует синтез ИЛ-12, ФНО-бета, L. rhamnosus GG стимулирует синтез ИЛ-10 и снижает концентрацию ФНО-альфа в кале у больных атопическим дерматитом и аллергией к коровьему молоку, B. longum снижает синтез IgE. Наиболее доказанной клинической эффективностью и безопасностью обладает Bifidobacterium BB-12, которая демонстрирует положительное влияние на иммунную систему ребенка, на состав кишечной микрофлоры, на развитие ребенка в целом, а также высокую эффективность в лечении и профилактике диареи и аллергии (табл. 3).
Среди современных методов определения состава микрофлоры кишечника следует выделить ионную и газожидкостную хроматографию (ГЖХ). ГЖХ – это метод экспресс-диагностики, так как проведение исследования занимает 30–40 минут. В основе метода лежит определение летучих жирных кислот, которые считаются бактериальными метаболитами. Биологическая роль летучих жирных кислот заключается в энергообеспечении колоноцитов, поддержании барьерной функции эпителия слизистой оболочки, участии в гомеостазе, поддержании водного электролитного баланса, влиянии на детоксикационную функцию печени, участии в энтерогепатической циркуляции желчных кислот, регуляции моторики толстой кишки, иммунорегуляции, антибактериальном и антиканцерогенном действии.
Установлено, что в процессе пищеварения при участии микрофлоры толстой кишки образуются низкомолекулярные метаболиты, в том числе газы, аминокислоты, монокарбоновые, дикарбоновые кислоты, оксикислоты. Среди них в количественном отношении лидируют короткоцепочечные жирные кислоты (КЖК). Установлено, что КЖК образуются при ферментации углеводов анаэробными бактериями, при расщеплении которых образуются уксусная, пропионовая и масляная кислоты. Источниками КЖК являются и аминокислоты, из которых образуются изо-бутират, изо-валериат и 2-метилбутират. Каждая КЖК образуется при ферментации субстрата бактериями определенного вида, что позволяет судить о функциональной активности конкретных представителей кишечной микрофлоры. Исследование КЖК методом ГЖХ обладает высокой чувствительностью, которая составляет 96 ± 2%.
Эффективность применения пробиотиков у детей младшего возраста доказана не только результатами многочисленных международных клинических исследований, но и подтверждена собственным опытом докладчика. Профессор И.Н. Захарова ознакомила участников симпозиума с результатами исследования эффективности терапии синбиотиком Нормобакт (саше) для коррекции микрофлоры кишечника у детей. Будучи синбиотиком, Нормобакт содержит Bifidobacterium BB12, Lactobacillus acidophilus LA-5 и фруктоолигосахарид (FOS). Штаммы, входящие в состав препарата, устойчивы к кислой среде и антибиотикам. Препарат выпускается в виде саше (один пакетик саше содержит 4 млрд бифидо- и лактобактерий) и может назначаться детям с шестимесячного возраста.
В проведенном исследовании приняли участие 60 детей (25 мальчиков и 35 девочек) в возрасте 3–7 лет с функциональными нарушениями толстой кишки, находившиеся в детском санатории ФГУ ЦКС «Малаховка». Дети были разделены на две равнозначные группы. На фоне базисной терапии 30 детей основной группы (15 мальчиков и 15 девочек) получали синбиотик Нормобакт по 1 саше 2 раза в день в течение 10 дней. В группу сравнения были включены 30 детей (10 мальчиков и 20 девочек), получавших только базисную терапию. При анализе исходных результатов суммарного содержания КЖК у исследуемых групп удалось выделить 2 типа изменения профиля КЖК (табл. 4). При 1-м типе наблюдалось повышение относительного содержания пропионовой и масляной кислот по сравнению с нормой, при 2-м типе – повышение относительного количества уксусной кислоты. Значения анаэробного индекса (АИ) при различных типах изменения профиля кислот свидетельствовали об изменении среды обитания микроорганизмов, способствующей росту либо анаэробных (1-й тип), либо аэробных (2-й тип) популяций микрофлоры. Повышение уровня изокислот (при обоих типах) и отношения изоC5/C5 (при 2-м типе) свидетельствует о повышении протеолитической активности факультативных и остаточных аэробных и анаэробных микроорганизмов и условно-патогенной флоры (в основном аэробов) при 2-м типе.
После проведенного курса лечения Нормобактом отмечалось изменение уровня КЖК у наблюдаемых детей. У детей с 1-м типом на фоне лечения Нормобактом произошла нормализация уровней уксусной и масляной кислот при тенденции к снижению относительного содержания пропионовой кислоты. У пациентов группы сравнения к концу наблюдения отмечалось достоверное повышение уровня уксусной кислоты, однако не достигшее нормальных значений, и тенденция к снижению относительного содержания пропионовой и масляной кислот, что свидетельствовало о сохраняющейся повышенной активности факультативных анаэробных микроорганизмов. Изменения показателей АИ в сторону нормальных значений к концу лечения свидетельствовали о тенденции к восстановлению среды обитания индигенной микрофлоры, наиболее выраженной у пациентов, принимавших Нормобакт. У детей со 2-м типом изменения профиля кислот к концу лечения синбиотиком Нормобакт произошла нормализация уровней уксусной, пропионовой и масляной кислот, что говорит о восстановлении соотношения аэробных/анаэробных микроорганизмов (рис.).
Изучение отношения абсолютного содержания изовалериановой кислоты к валериановой кислоте (изоС5/С5) и уровня изокислот показало к концу курса лечения у пациентов основной группы и группы сравнения при обоих типах профиля кислот тенденцию к уменьшению суммарного относительного содержания изокислот, наиболее выраженную при приеме Нормобакта. Кроме того, при 2-м типе профиля отмечалось достоверное уменьшение отношения содержания изовалериановой кислоты к валериановой у пациентов, принимавших Нормобакт. Изменение уровня изокислот и отношения содержания изовалериановой кислоты к валериановой кислоте свидетельствовало, с одной стороны, о тенденции к нормализации процесса протеолиза, наиболее выраженной в основной группе, с другой стороны – о естественной элиминации остаточных условно-патогенных микроорганизмов под воздействием синбиотика Нормобакт. Результаты проведенного исследования позволили сделать вывод о том, что Нормобакт является высокоэффективным средством для нормализации микрофлоры кишечника у детей с дисбиотическими нарушениями.
В ходе исследования было показано, что изучение пула летучих жирных кислот методом ГЖХ позволяет в режиме реального времени оценить состояние микробиоценоза кишечника и охарактеризовать инфраструктуру микрофлоры, метаболическую активность кишечной флоры, энергообеспечение эпителия, процесс микробного симбиотического пищеварения, интегральное количество летучих жирных кислот (метаболитов условно-патогенной флоры, обладающих определенным патогенным потенциалом), структурные и функциональные нарушения экосистемы толстой кишки.
В заключение профессор И.Н. Захарова отметила, что уже сейчас создаются пробиотики нового поколения, основой которых являются штаммы микроорганизмов с заданными свойствами, то есть способные продуцировать рекомбинантные человеческие белки – цитокины, ферменты, антитела. Такая, основывающаяся на современных достижениях науки, пробиотикотерапия будет способствовать созданию медицины будущего – так называемой персонифицированной медицины.
1. Eckburg P.B., Bik E.M., Bernstein C.N. et al. Diversity of the human intestinal microbial flora // Science. 2005. Vol. 308. № 5728. P. 1635–1638.
2. Turnbaugh P.J., Ley R.E., Hamady M. et al. The human microbiome project // Nature. 2007. Vol. 449. № 7164. P. 804–810.
3. Goodacre R. Metabolomics of a superorganism // J. Nutr. 2007. Vol. 137. № 1. Suppl. P. 259S–266S.
4. Qin J., Li R., Raes J. et al. A human gut microbial gene catalogue established by metagenomic sequencing // Nature. 2010. Vol. 464. № 7285. P. 59–65.
5. Arumugam M., Raes J., Pelletier E. et al. Enterotypes of the human gut microbiome // Nature. 2011. Vol. 473. № 7346. P. 174–180
6. Budding A.E., Grasman M.E., Lin F. et al. IS-pro: high-throughput molecular fingerprinting of the intestinal microbiota // FASEB J. 2010. Vol. 24. № 11. P. 4556–4564.
7. Kapel N., Campeotto F., Kalach N. et al. Faecal calprotectin in term and preterm neonates // J. Pediatr. Gastroenterol. Nutr. 2010. Vol. 51. № 5. P. 542–547.
8. Rhoads J.M., Fatheree N.Y., Norori J. et al. Altered fecal microflora and increased fecal calprotectin in infants with colic // J. Pediatr. 2009. Vol. 155. № 6. P. 823–828.e1.
9. Rijkers G.T., Bengmark S., Enck P. et al. Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research // J. Nutr. 2010. Vol. 140. № 3. P. 671S–676S.
10. Floch M.H., Walker W.A., Guandalini S. et al. Recommendations for probiotic use – 2008 // J. Clin. Gastroenterol. 2008. Vol. 42. Suppl. 2. P. S104–S108.
Новости на тему
07.04.2022 16:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Становление микрофлоры кишечника у младенца имеет важное значение для его роста и дальнейшего развития. Нарушение микробиоценоза кишечника может сопровождаться дисфункцией иммунитета, развитием аллергии с кожными и гастроинтестинальными проявлениями.
В своем докладе, прочитанном на ХI Российском конгрессе «Инновационные технологии в педиатрии и детской хирургии», заведующая кафедрой педиатрии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава РФ, д.м.н., заслуженный врач России, главный внештатный педиатр Центрального федерального округа России, профессор Ирина Николаевна ЗАХАРОВА, опираясь на широкую доказательную базу, осветила основные вехи истории изучения создания пробиотиков, изложила современные представления о формировании кишечного микробиоценоза у младенцев, концепцию применения пробиотиков в педиатрической практике, очертила перспективы развития этого направления в коррекции нарушений кишечной микробиоты.
Профессор И.Н. Захарова также сообщила результаты собственного исследования эффективности и безопасности применения синбиотика Нормобакт у детей с клиническими проявлениями дисбиоза толстой кишки.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
