количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
ХI Российский конгресс «Инновационные технологии в педиатрии и детской хирургии»: Клинические варианты течения пищевой аллергии у детей первого года жизни
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" №1
- Аннотация
- Статья
- Ссылки
Особый интерес у участников VII Российского конгресса по детской аллергологии и клинической иммунологии – программного мероприятия, прошедшего в рамках ХI Российского конгресса «Инновационные технологии в педиатрии и детской хирургии», – вызвало выступление заведующей кафедрой педиатрии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава РФ, д.м.н., заслуженного врача России, главного внештатного педиатра Центрального федерального округа России, профессора Ирины Николаевны ЗАХАРОВОЙ.
Одной из наиболее острых медицинских проблем детского возраста является пищевая аллергия, которая отмечается у 6–8% детей раннего возраста. Для практического врача диагностика и лечение аллергических заболеваний у детей первого года жизни представляются весьма сложной задачей.
Особый интерес у участников VII Российского конгресса по детской аллергологии и клинической иммунологии – программного мероприятия, прошедшего в рамках ХI Российского конгресса «Инновационные технологии в педиатрии и детской хирургии», – вызвало выступление заведующей кафедрой педиатрии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава РФ, д.м.н., заслуженного врача России, главного внештатного педиатра Центрального федерального округа России, профессора Ирины Николаевны ЗАХАРОВОЙ.

Профессор Захарова И. Н.
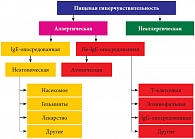
Рис. 1. Классификация видов гиперчувствительности (EAACI, 2001)
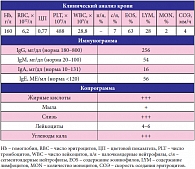
Таблица 1. Клинический пример 1. Результаты клинического анализа крови, иммунограммы и копрограммы ребенка 3,5 месяцев с проявлениями атопического дерматита

Таблица 2. Клинический пример 2. Результаты клинического анализа крови ребенка 7 месяцев с проявлениями атопического дерматита
Еще сравнительно недавно считали: для постановки диагноза пищевой аллергии у ребенка необходимо выявить повышенный уровень иммуноглобулина (Ig) класса Е. Однако в последние годы мы говорим о том, что среди детей первого года жизни значительная часть иммунологически опосредованных пищевых реакций не являются IgE-зависимыми, то есть имеют иной механизм развития. Так, в ходе исследования, проведенного T. Klemola и соавт. (2002) у 170 детей в возрасте 2–11 месяцев с верифицированным диагнозом аллергии к белкам коровьего молока, только у 36% из них (61 ребенок) были выявлены специфические IgE-антитела к белку коровьего молока1. Таким образом, диагностика, основанная лишь на определении количественного содержания IgE-антител к антигенам пищевых продуктов, приведет к тому, что двум из трех пациентов диагноз будет поставлен неправильно, то есть пропущен. Это свидетельствует о том, что у детей раннего возраста тест на определение специфических IgE не может исключать или подтверждать диагноз пищевой аллергии, но, тем не менее, может определять прогноз заболевания, поскольку раннее формирование толерантности к аллергену более вероятно у детей с исходно отрицательным результатом теста на специфические IgE-антитела2.
С пищевой аллергией ассоциирован широкий спектр болезней кожи, желудочно-кишечного и респираторного трактов, включая генерализованные проявления. Аллергические реакции на пищу 1-го типа (IgE-опосредованные) характеризуются острым началом и клинически проявляются анафилаксией, оральным аллергическим синдромом, крапивницей, острым риноконъюнктивитом, бронхообструктивным синдромом. В основе энтероколита, проктита, контактного дерматита, гемосидероза легких (синдром Гейнера) лежат клеточно-опосредованные иммунные механизмы, приводящие к развитию гиперчувствительности замедленного типа. В развитии таких хронических заболеваний, как эозинофильный эзофагит, эозинофильная гастроэнтеропатия, атопический дерматит, бронхиальная астма, участвуют как IgE-зависимые, так и клеточно-опосредованные аллергические реакции (смешанная гиперчувствительность). Пищевая аллергия, как правило, развивается у детей раннего возраста. Причиной ее развития может стать практически любой пищевой продукт, однако, как показано S.A. Bock и соавт. (1988) при помощи двойного слепого плацебоконтролируемого исследования с провокацией, в котором участвовало 710 взрослых и детей, чаще всего (в 93% случаев) в развитии пищевой аллергии «виновны» всего лишь 8 пищевых продуктов: яйцо, арахис, молоко, соя, лесной орех, рыба, ракообразные, пшеница3.
Пищевые воздействия имеют огромную значимость для ребенка раннего возраста, поскольку именно через пищу он получает первый контакт с возможными аллергенами. По данным некоторых авторов, 0,4–0,5% детей, находящихся на грудном вскармливании, имеют такие клинические проявления пищевой аллергии, как атопический дерматит, крапивница, отек Квинке, рвота, кишечные колики, гемоколит, астма, аллергический ринит, анафилаксия, задержка роста. Белок, содержащийся в молоке, яйцах, сое, рыбе, кунжутном семени, какао, цитрусовых, свинине, яблоках, бананах и других пищевых продуктах – потенциальных аллергенах, поступает через молоко матери и может спровоцировать развитие у ребенка аллергической реакции. При этом одним из наиболее значимых аллергенов, индуцирующих пищевую аллергию у детей раннего возраста, являются белки коровьего молока. Проявления пищевой аллергии у младенцев, находящихся на грудном вскармливании, прежде всего, обусловлены особенностями диеты матери. В случае выявления пищевой аллергии у ребенка, находящегося на грудном вскармливании, мы должны назначить матери «жесткую» элиминационную диету. Диетотерапия является основой лечения атопического дерматита у детей раннего возраста, одновременно являясь и диетодиагностикой.
Клинический пример 1. Илья Д., 3,5 месяца, находится на грудном вскармливании с рождения. С трех недель – проявления себорейного дерматита на щечках, волосистой части головы, сухость на наружной поверхности предплечий и голеней. Врач ошибочно рекомендовал матери исключить сладкое и фрукты из ее рациона питания, и, как следствие, мама пациента увеличила потребление молочных продуктов. В возрасте 2 месяцев пациент получает терапию по поводу дисбактериоза кишечника (пробиотики, сорбенты, фурановые препараты). С 3 месяцев ему назначают увлажняющие кремы (Эмолиум), преднизолон в/м, гормональные мази (Пимафукорт). Состояние ребенка ухудшается, и он поступает в клинику с тяжелым атопическим дерматитом, наличием слизи в фекалиях, высоким уровнем эозинофилии (63%) в крови, вторичной лактазной недостаточностью. При этом иммунограмма демонстрирует нормальный уровень IgЕ (табл. 1). Первым и важнейшим шагом, который необходимо предпринять в данном случае, является назначение матери диеты, исключающей белки коровьего молока. Подчеркну: очень важно объяснить, что необходимо исключить любые продукты, содержащие белки коровьего молока, в том числе творог, сливки, кисломолочные продукты, а также сдобные хлебобулочные изделия, содержащие молоко, и т.п.
Клинический пример 2. Соня, 7 месяцев, находится на грудном вскармливании с рождения. В конце 1-й недели жизни учащается стул до 12 раз в сутки с зоной обводнения и примесью большого количества слизи. С 2 месяцев отмечается молочница полости рта, ребенок часто срыгивает, наблюдается примесь крови в стуле. Результаты бактериологического посева кала показали содержание бифидобактерий – 106, лактобацилл – 105, клебсиеллы – 104, золотистого стафилококка – 104 КОЕ/г фекалий. По данным копрологии лейкоциты и эритроциты отсутствуют. Содержание углеводов в кале – 1,6%. Врач диагностировал дисбактериоз кишечника и вторичную лактазную недостаточность. Были назначены пробиотики (Энтерол), кишечные антисептики (Энтерофурил), бактериофаги, энтеросорбенты (Смекта), ферментные препараты (Лактаза Бэби). Как и в первом клиническим примере, матери была ошибочно рекомендована диета с исключением фруктов, овощей, сладкого. В возрасте 3 месяцев у ребенка появился частый жидкий стул со слизью и прожилками крови в слизи, ребенок продолжал срыгивать. Наблюдалась сухость кожных покровов в типичных местах, характерных для атопического дерматита. Однако врач этого не увидел, для лечения «дисбактериоза кишечника» назначил пробиотики, содержащие молоко и лактозу, а также Хилак форте. Мама продолжала употреблять молочные продукты. В возрасте 7 месяцев ребенок получал исключительно грудное вскармливание, прикорм введен не был, сохранялся учащенный водянистый стул со слизью и прожилками крови в ней, развилось железодефицитное состояние (табл. 2).
Приведенные клинические примеры иллюстрируют типичную ситуацию, когда врач, «увлекшись» коррекцией дисбактериоза и вторичной лактазной недостаточности, упускает из виду симптомы развивающегося атопического дерматита на фоне аллергии к белкам коровьего молока. Главными клиническими проявлениями атопического дерматита у детей являются кожный зуд и типичная морфология и локализация высыпаний (у детей первых лет жизни – эритема, папулы, микровезикулы с локализацией на лице и разгибательных поверхностях конечностей; у детей старшего возраста – папулы, лихенификация симметричных участков сгибательных поверхностей конечностей). Важно помнить, что для атопического дерматита характерна ранняя манифестация первых клинических симптомов, хроническое и рецидивирующее течение. Вероятность развития атопического дерматита существенно повышается в случае отягощенного аллергологического анамнеза. Младенческая стадия атопического дерматита (от 0 до 3 лет) проявляется гиперемией кожи, отечностью, наличием микровезикул, экссудацией (мокнутием), шелушением, трещинами на коже лица, наружной поверхности верхних и нижних конечностей, локтевых и подколенных ямок, запястий, туловища, а также зудом, красным или смешанным дермографизмом. В этом возрасте патологические изменения затрагивают в основном эпидермис. Высокий риск развития аллергии в младенческом возрасте может возникнуть на фоне раннего искусственного или смешанного вскармливания.
Приведенные клинические примеры иллюстрируют типичную ситуацию, когда врач, «увлекшись» коррекцией дисбактериоза и вторичной лактазной недостаточности, упускает из виду симптомы развивающегося атопического дерматита на фоне аллергии к белкам коровьего молока. Главными клиническими проявлениями атопического дерматита у детей являются кожный зуд и типичная морфология и локализация высыпаний (у детей первых лет жизни – эритема, папулы, микровезикулы с локализацией на лице и разгибательных поверхностях конечностей; у детей старшего возраста – папулы, лихенификация симметричных участков сгибательных поверхностей конечностей). Важно помнить, что для атопического дерматита характерна ранняя манифестация первых клинических симптомов, хроническое и рецидивирующее течение. Вероятность развития атопического дерматита существенно повышается в случае отягощенного аллергологического анамнеза. Младенческая стадия атопического дерматита (от 0 до 3 лет) проявляется гиперемией кожи, отечностью, наличием микровезикул, экссудацией (мокнутием), шелушением, трещинами на коже лица, наружной поверхности верхних и нижних конечностей, локтевых и подколенных ямок, запястий, туловища, а также зудом, красным или смешанным дермографизмом. В этом возрасте патологические изменения затрагивают в основном эпидермис. Высокий риск развития аллергии в младенческом возрасте может возникнуть на фоне раннего искусственного или смешанного вскармливания.
Клинический пример 3. Тимур, 6 месяцев, страдает эритематозно-сквамозной, распространенной формой атопического дерматита, период обострения. Первые признаки атопического дерматита на лице и разгибательных поверхностях конечностей проявились в возрасте 2 недель. С рождения ребенок получал искусственное вскармливание, с 3-го дня до 2,5 месяцев – грудное вскармливание, с 2,5 месяцев начал получать докорм высокогидролизованной смесью на основе казеина со среднецепочечными глицеридами. В возрасте 3 месяцев было принято решение перевести ребенка на высокогидролизованную смесь на основе сывороточного белка, однако клинические проявления атопического дерматита сохранялись, прикорм введен не был. Полного купирования кожных проявлений атопического дерматита у этого ребенка удалось достичь спустя две недели после его перевода на аминокислотную смесь Неокейт.
Эффективность и безопасность аминокислотной смеси Неокейт в сравнении со смесями на основе гидролизата у детей раннего возраста с атопическим дерматитом изучалась в ходе нескольких рандомизированных клинических исследований. Так, E. Isolauri и соавт. (1995) показали, что по клиническим и биохимическим показателям смеси на основе аминокислот Неокейт и высокогидролизованного белка сопоставимы, в обеих группах отмечено снижение интенсивности проявлений атопического дерматита и уровней общего и специфического IgE. Однако у детей, получавших аминокислотную смесь Неокейт, средние концентрации незаменимых аминокислот были выше, чем у детей, получавших высокогидролизованную смесь, и приближались к таковым у детей на грудном вскармливании. Кроме того, отмечались статистически достоверные межгрупповые различия в прибавке веса (p = 0,09) и роста (p = 0,006), более высокая динамика этих показателей наблюдалась в группе приема аминокислотной смеси. На основании данных исследования был сделан вывод о том, что при подозрении на поливалентную пищевую аллергию и в тех ситуациях, когда выявлены гипотрофия, задержка роста и развития, более предпочтительными могут быть аминокислотные смеси4. Сравнительная эффективность аминокислотной смеси Неокейт и смеси на основе высокогидролизованных молочных белков в отношении купирования симптомов атопического дерматита у 73 детей (средний возраст 5,7 месяца) с непереносимостью или аллергией к белкам коровьего молока изучали B. Niggemann и соавт. (2001) в проспективном контролируемом многоцентровом исследовании.
Эффективность и безопасность аминокислотной смеси Неокейт в сравнении со смесями на основе гидролизата у детей раннего возраста с атопическим дерматитом изучалась в ходе нескольких рандомизированных клинических исследований. Так, E. Isolauri и соавт. (1995) показали, что по клиническим и биохимическим показателям смеси на основе аминокислот Неокейт и высокогидролизованного белка сопоставимы, в обеих группах отмечено снижение интенсивности проявлений атопического дерматита и уровней общего и специфического IgE. Однако у детей, получавших аминокислотную смесь Неокейт, средние концентрации незаменимых аминокислот были выше, чем у детей, получавших высокогидролизованную смесь, и приближались к таковым у детей на грудном вскармливании. Кроме того, отмечались статистически достоверные межгрупповые различия в прибавке веса (p = 0,09) и роста (p = 0,006), более высокая динамика этих показателей наблюдалась в группе приема аминокислотной смеси. На основании данных исследования был сделан вывод о том, что при подозрении на поливалентную пищевую аллергию и в тех ситуациях, когда выявлены гипотрофия, задержка роста и развития, более предпочтительными могут быть аминокислотные смеси4. Сравнительная эффективность аминокислотной смеси Неокейт и смеси на основе высокогидролизованных молочных белков в отношении купирования симптомов атопического дерматита у 73 детей (средний возраст 5,7 месяца) с непереносимостью или аллергией к белкам коровьего молока изучали B. Niggemann и соавт. (2001) в проспективном контролируемом многоцентровом исследовании.
Данные исследования продемонстрировали, что в группе приема аминокислотной смеси Неокейт симптомы атопического дерматита, оценивавшиеся по шкале SCORAD, уменьшились с исходного уровня 24,6 балла до 10,7 балла через 6 месяцев (p < 0,0001). Было также показано, что в группе приема аминокислотной смеси Неокейт отмечено статистически значимое увеличение показателей роста, что позволило авторам рекомендовать эти продукты детям с аллергией к белку коровьего молока для предотвращения развития атопии и задержки роста5. Полезны такие смеси и у детей с тяжелыми формами атопического дерматита. Например, тяжелые формы атопического дерматита могут являться клиническим проявлением синдрома Джоба, или гипериммуноглобулинемии Е. При этом иммунодефицитном заболевании детского возраста отмечается очень высокий уровень общего IgE в крови (> 2000 МЕ/мл), характерно наличие рецидивирующих инфекционных осложнений – деструктивных пневмоний, холодных абсцессов кожи, гнойного отита, хронической экземы, кандидоза кожи и слизистых оболочек, выраженного лейкоцитоза в крови. Характерными признаками данного заболевания являются диспластические черты лица, спонтанные переломы трубчатых костей.
Клинический пример 4. Мальчик В.Д., 1,5 года, с отягощенной наследственностью по аллергии по линии матери и отца. Первые дни жизни находился на искусственном вскармливании с последующим переходом на грудное вскармливание. С 2 недель жизни отмечены начальные проявления атопического дерматита, с 2 месяцев появилась кровь в стуле. В 6 месяцев были выявлены положительные антитела IgM к цитомегаловирусу, в 9 месяцев – антитела IgM к вирусу герпеса 1-го и 2-го типа. Общий IgE составил 9000 ME/мл, отмечались высокие титры антител к белкам коровьего, козьего молока. Ребенку был поставлен диагноз: «Гипер-IgE-синдром (синдром Джоба?), распространенный атопический дерматит, младенческая стадия, эритематозно-сквамозная форма с вторичным инфицированием, недостаточность питания 2–3-й степени, гипохромная анемия». Через 2 недели после того, как ребенка перевели на аминокислотную смесь Неокейт, он прибавил в массе 400 г. В дальнейшем пациент наблюдался у иммунолога.
В зависимости от иммунологического механизма выделяют следующие типы гастроинтестинальной формы гиперчувствительности. К IgE-опосредованным желудочно-кишечным проявлениям пищевой аллергии относят немедленную гастроинтестинальную гиперчувствительность и оральный аллергический синдром. В клинической практике все чаще приходится сталкиваться со смешанной гиперчувствительностью, по этому варианту реализуются эозинофильный эзофагит, эозинофильный гастрит, эозинофильный гастроэнтерит и эозинофильный гастроэнтероколит. Среди не-IgE-зависимых аллергических заболеваний пищеварительного тракта следует выделить энтероколитический синдром (FPIES), проктоколит, индуцированный пищевыми белками, пищевую энтеропатию и целиакию6.
Нередко начальным проявлением аллергии к белкам коровьего молока является гастроэзофагеальный рефлюкс (ГЭР). Считается, что ГЭР, который появился у ребенка, почти в половине случаев связан с аллергией. Аллергическую природу ГЭР можно заподозрить в случае сохранения ГЭР на фоне антирефлюксного лечения, при наличии отягощенного семейного анамнеза по атопии и при таких сопутствующих клинических симптомах, как экзема, диарея, недостаточность питания, аллергические реакции немедленного типа (крапивница, бронхоспазм, ангионевротический отек). Однако на практике подтвердить, что ГЭР у ребенка аллергического генеза, довольно сложно, особенно при отсутствии кожных проявлений заболевания. Для постановки диагноза не всегда могут помочь иммунологические тесты. В этой связи доступным и высокоэффективным диагностическим методом представляется диетотерапия, которая является и диетодиагностикой, предполагающая исключение из рациона наиболее вероятных аллергенов.
В зависимости от иммунологического механизма выделяют следующие типы гастроинтестинальной формы гиперчувствительности. К IgE-опосредованным желудочно-кишечным проявлениям пищевой аллергии относят немедленную гастроинтестинальную гиперчувствительность и оральный аллергический синдром. В клинической практике все чаще приходится сталкиваться со смешанной гиперчувствительностью, по этому варианту реализуются эозинофильный эзофагит, эозинофильный гастрит, эозинофильный гастроэнтерит и эозинофильный гастроэнтероколит. Среди не-IgE-зависимых аллергических заболеваний пищеварительного тракта следует выделить энтероколитический синдром (FPIES), проктоколит, индуцированный пищевыми белками, пищевую энтеропатию и целиакию6.
Нередко начальным проявлением аллергии к белкам коровьего молока является гастроэзофагеальный рефлюкс (ГЭР). Считается, что ГЭР, который появился у ребенка, почти в половине случаев связан с аллергией. Аллергическую природу ГЭР можно заподозрить в случае сохранения ГЭР на фоне антирефлюксного лечения, при наличии отягощенного семейного анамнеза по атопии и при таких сопутствующих клинических симптомах, как экзема, диарея, недостаточность питания, аллергические реакции немедленного типа (крапивница, бронхоспазм, ангионевротический отек). Однако на практике подтвердить, что ГЭР у ребенка аллергического генеза, довольно сложно, особенно при отсутствии кожных проявлений заболевания. Для постановки диагноза не всегда могут помочь иммунологические тесты. В этой связи доступным и высокоэффективным диагностическим методом представляется диетотерапия, которая является и диетодиагностикой, предполагающая исключение из рациона наиболее вероятных аллергенов.
Клинический пример 5. Ребенок П., 3 месяца. Вес при рождении – 4 кг 200 г, рост – 54 см, с рождения находится на грудном вскармливании, семейный аллергоанамнез не отягощен. За 1-й месяц ребенок прибавил в массе 800 г. После 1-го месяца жизни младенца мама ввела в свой рацион питания молочные продукты, и с 1,5 месяцев у ребенка появились частые обильные срыгивания, разжиженный стул, отмечена потеря веса. Ребенок поступил в стационар в связи с рвотой фонтаном в течение 3 дней и с подозрением на пилоростеноз. После исключения хирургической патологии была проведена рентгенография желудочно-кишечного тракта с барием (отмечена замедленная эвакуация бариевой взвеси через 24 часа), ультразвуковое исследование (недостаточность эзофагокардиального отдела пищевода, ГЭР, аэрофагия), клинический анализ крови выявил легкую форму гипохромной анемии, в фекалиях обнаружены жирные кислоты, большое количество слизи, лейкоциты – до 15–20 в поле зрения. В течение 1,5 месяцев ребенок получал медикаментозную терапию по поводу ГЭР без эффекта. В возрасте 3 месяцев дефицит массы составил 34%, эпизоды срыгивания и рвоты фонтаном сохранялись, в стуле часто отмечалось большое количество слизи. Была проведена диетодиагностика. Ребенок был снят на месяц с грудного вскармливания, в течение этого времени он получал аминокислотную смесь Неокейт, мама сцеживала грудное молоко и в течение месяца соблюдала безмолочную диету. Через месяц возврат к грудному вскармливанию сопровождался возобновлением рвоты фонтаном. На основании проведенной диетодиагностики ребенку была диагностирована гастроинтестинальная форма пищевой аллергии к белкам коровьего молока. Вскармливание аминокислотной смесью Неокейт привело к быстрому разрешению симптомов и увеличению массы тела.
G. Iacono и соавт. (1996) обследовали 204 ребенка (средний возраст 6,3 месяца) с подтвержденным данными 24-часового мониторинга внутрижелудочного уровня pH и биопсией пищевода диагнозом ГЭР. Только у 9% детей до начала обследования была заподозрена аллергия к белкам коровьего молока. После исключения из рациона продуктов, содержащих белки коровьего молока, и проведения двойной слепой пероральной пищевой провокационной пробы диагноз аллергии к белкам коровьего молока был подтвержден у 42% детей с ГЭР неясной этиологии7. Именно диетотерапия помогает «справиться» с ГЭР, который сохраняется на фоне антирефлюксного лечения. В ходе оценки эффективности аминокислотной смеси Неокейт у 19 детей с выраженной раздражительностью и ГЭР, у которых отсутствовал эффект от терапии смесями на основе высокогидролизованного белка и антирефлюксными препаратами, D.J. Hill и соавт. (2000) установили, что на фоне приема смеси Неокейт в течение 2 недель симптомы ГЭР у этих детей полностью разрешились, а через 3 месяца использования Неокейта проведенная двойная слепая плацебоконтролируемая провокационная проба показала толерантность к смесям на основе высокогидролизованного белка у 37% детей. Таким образом, диетотерапия ГЭР, связанного с аллергией к белкам коровьего молока, с использованием Неокейта эффективна и при длительном использовании способствует более раннему формированию толерантности к аллергенам8.
Еще одним заболеванием, в клинической картине которого у детей младшего возраста доминируют рефлюксподобные симптомы (рвота – в 65% случаев, боли в животе – 40%, задержка роста – 35%, изжога – 25%, диарея – 23%, дисфагия – 18%)9, является эозинофильный эзофагит. Трудности дифференциальной диагностики эозинофильного эзофагита связаны с тем, что только в 50% случаев отмечается повышенный уровень общего IgE и в 25% – незначительное увеличение уровня эозинофилов в крови. При подозрении на это заболевание нередко проводят эндоскопическое исследование, однако следует помнить, что, как показали M. Marlais и соавт. (2011), чувствительность этого метода составляет порядка 18%, а в более чем 60% случаев эндоскопические признаки заболевания вообще отсутствуют9. В этой связи «золотым стандартом» диагностики эозинофильного эзофагита является гистологическое исследование. В настоящее время гистологические, в отличие от клинических, критерии эозинофильного эзофагита четко определены. Исследования показали, что положительных результатов в борьбе с эозинофильным эзофагитом можно достичь при помощи диетотерапии с исключением аллергенов. В исследовании, проведенном J.M. Spergel и соавт. (2005) у 146 детей с эозинофильным эзофагитом, 75% пациентов положительно ответили на элиминационную диету. Исследователи сделали вывод, что использование аминокислотной смеси Неокейт в качестве элиминационной диеты приводит к разрешению симптомов заболевания и снижению эозинофильного воспаления, особенно у детей с поливалентной пищевой аллергией10.
G. Iacono и соавт. (1996) обследовали 204 ребенка (средний возраст 6,3 месяца) с подтвержденным данными 24-часового мониторинга внутрижелудочного уровня pH и биопсией пищевода диагнозом ГЭР. Только у 9% детей до начала обследования была заподозрена аллергия к белкам коровьего молока. После исключения из рациона продуктов, содержащих белки коровьего молока, и проведения двойной слепой пероральной пищевой провокационной пробы диагноз аллергии к белкам коровьего молока был подтвержден у 42% детей с ГЭР неясной этиологии7. Именно диетотерапия помогает «справиться» с ГЭР, который сохраняется на фоне антирефлюксного лечения. В ходе оценки эффективности аминокислотной смеси Неокейт у 19 детей с выраженной раздражительностью и ГЭР, у которых отсутствовал эффект от терапии смесями на основе высокогидролизованного белка и антирефлюксными препаратами, D.J. Hill и соавт. (2000) установили, что на фоне приема смеси Неокейт в течение 2 недель симптомы ГЭР у этих детей полностью разрешились, а через 3 месяца использования Неокейта проведенная двойная слепая плацебоконтролируемая провокационная проба показала толерантность к смесям на основе высокогидролизованного белка у 37% детей. Таким образом, диетотерапия ГЭР, связанного с аллергией к белкам коровьего молока, с использованием Неокейта эффективна и при длительном использовании способствует более раннему формированию толерантности к аллергенам8.
Еще одним заболеванием, в клинической картине которого у детей младшего возраста доминируют рефлюксподобные симптомы (рвота – в 65% случаев, боли в животе – 40%, задержка роста – 35%, изжога – 25%, диарея – 23%, дисфагия – 18%)9, является эозинофильный эзофагит. Трудности дифференциальной диагностики эозинофильного эзофагита связаны с тем, что только в 50% случаев отмечается повышенный уровень общего IgE и в 25% – незначительное увеличение уровня эозинофилов в крови. При подозрении на это заболевание нередко проводят эндоскопическое исследование, однако следует помнить, что, как показали M. Marlais и соавт. (2011), чувствительность этого метода составляет порядка 18%, а в более чем 60% случаев эндоскопические признаки заболевания вообще отсутствуют9. В этой связи «золотым стандартом» диагностики эозинофильного эзофагита является гистологическое исследование. В настоящее время гистологические, в отличие от клинических, критерии эозинофильного эзофагита четко определены. Исследования показали, что положительных результатов в борьбе с эозинофильным эзофагитом можно достичь при помощи диетотерапии с исключением аллергенов. В исследовании, проведенном J.M. Spergel и соавт. (2005) у 146 детей с эозинофильным эзофагитом, 75% пациентов положительно ответили на элиминационную диету. Исследователи сделали вывод, что использование аминокислотной смеси Неокейт в качестве элиминационной диеты приводит к разрешению симптомов заболевания и снижению эозинофильного воспаления, особенно у детей с поливалентной пищевой аллергией10.
В другом исследовании (J.E. Markowitz и соавт., 2003), в котором участвовал 51 ребенок с подтвержденным с помощью эзофагогастродуоденоскопии с биопсией слизистой оболочки диагнозом эозинофильного эзофагита, в течение 1 месяца пациенты получали аминокислотную смесь Неокейт. Статистически достоверное (p < 0,01) уменьшение выраженности клинических проявлений эозинофильного эзофагита у этих пациентов (боль в эпигастрии, рвота, изжога, дисфагия) произошло уже на 10-й день использования Неокейта, а гистологических проявлений по данным повторной эзофагогастродуоденоскопии – через 1 месяц11. C.A. Liacouras и соавт. (2005) опубликовали результаты своего 10-летнего опыта лечения детей с эозинофильным эзофагитом (n = 381). Ретроспективный анализ показал, что основой этиотропной терапии этого заболевания является элиминация аллергена, при этом использование Неокейта было высокоэффективно и безопасно у 98% пациентов12.
Энтеропатия, обусловленная аллергией к белкам пищи, клинически проявляется диареей, рвотой, метеоризмом, увеличением в объеме живота, недостаточным набором веса, отставанием в физическом развитии, отеками. При биопсии кишечника выявляются участки атрофии ворсинчатого эпителия, лимфогистиоцитарная инфильтрация. Симптомы энтероколита, индуцированного белками пищи, встречаются у детей первых дней – месяцев жизни и проявляются немедленной рвотой в течение 2–4 часов с последующей диареей. Возможно обнаружение крови в стуле. Наиболее частыми продуктами, вызывающими энтероколит у детей первого года жизни, являются коровье молоко и соя. При этом индуцированный пищевыми белками энтероколит может наблюдаться у детей, находящихся не только на искусственном, но и исключительно на грудном вскармливании (50% случаев).
Аллергический колит (проктит), индуцированный пищевыми белками, обнаруживается у детей первых 6 месяцев жизни и характеризуется появлением примеси крови в кале (иногда диареей) при общем удовлетворительном состоянии ребенка. Заболевание выявляется у детей, находящихся как на грудном, так и на искусственном вскармливании. Чаще всего ребенок реагирует на белки коровьего, козьего молока и сои. Диагноз основывается на постановке кожных проб, определении содержания IgE (тест отрицательный). Полная ликвидация симптомов энтеропатии, индуцированной пищевыми белками, аллергического энтероколита и колита наступает после устранения причинного аллергена из питания13. При проктите, индуцированном пищевыми белками, в ряде случаев (если, например, заболевание развивается на фоне гидролизованных смесей) эффективно использование аминокислотных смесей. Поскольку на третьем месте среди причин пищевой аллергии после белков коровьего молока и куриных яиц стоит непереносимость глютена, содержащегося в пшенице, ржи, ячмене и овсе, необходимо проводить дифференциальный диагноз между пищевой аллергией и целиакией.
Энтеропатия, обусловленная аллергией к белкам пищи, клинически проявляется диареей, рвотой, метеоризмом, увеличением в объеме живота, недостаточным набором веса, отставанием в физическом развитии, отеками. При биопсии кишечника выявляются участки атрофии ворсинчатого эпителия, лимфогистиоцитарная инфильтрация. Симптомы энтероколита, индуцированного белками пищи, встречаются у детей первых дней – месяцев жизни и проявляются немедленной рвотой в течение 2–4 часов с последующей диареей. Возможно обнаружение крови в стуле. Наиболее частыми продуктами, вызывающими энтероколит у детей первого года жизни, являются коровье молоко и соя. При этом индуцированный пищевыми белками энтероколит может наблюдаться у детей, находящихся не только на искусственном, но и исключительно на грудном вскармливании (50% случаев).
Аллергический колит (проктит), индуцированный пищевыми белками, обнаруживается у детей первых 6 месяцев жизни и характеризуется появлением примеси крови в кале (иногда диареей) при общем удовлетворительном состоянии ребенка. Заболевание выявляется у детей, находящихся как на грудном, так и на искусственном вскармливании. Чаще всего ребенок реагирует на белки коровьего, козьего молока и сои. Диагноз основывается на постановке кожных проб, определении содержания IgE (тест отрицательный). Полная ликвидация симптомов энтеропатии, индуцированной пищевыми белками, аллергического энтероколита и колита наступает после устранения причинного аллергена из питания13. При проктите, индуцированном пищевыми белками, в ряде случаев (если, например, заболевание развивается на фоне гидролизованных смесей) эффективно использование аминокислотных смесей. Поскольку на третьем месте среди причин пищевой аллергии после белков коровьего молока и куриных яиц стоит непереносимость глютена, содержащегося в пшенице, ржи, ячмене и овсе, необходимо проводить дифференциальный диагноз между пищевой аллергией и целиакией.
Клинический пример 6. Мальчик, 3 лет. Наследственность отягощена по аллергии по линии отца. Находился на грудном вскармливании с первых суток жизни. Начиная с месячного возраста появились клинические проявления атопического дерматита в виде сухости, гиперемии кожи щек, наружной поверхности предплечий и голеней. Матери рекомендовано исключение из рациона питания молочных продуктов. С 6-месячного возраста ребенку в рацион питания введены каши – гречневая и мультизлаковая. С момента введения злаков сухость кожных покровов усилилась, распространились пятнисто-папулезные элементы на кожу груди и спины, появилась лихенификация на кистях рук. Проводилась терапия антигистаминными препаратами, сорбентами, мазями на основе глюкокортикостероидов. Усиление проявлений атопического дерматита сопровождалось появлением учащенного, разжиженного, непереваренного стула. В кале были обнаружены золотистый стафилококк и клебсиелла. Проводилось лечение дисбактериоза кишечника биопрепаратами, ферментами, которое не давало никакого эффекта, отмечалось ухудшение течения атопического дерматита. В 8-месячном возрасте у ребенка выявлен повышенный уровень антиглиадиновых антител IgG (129 Ед/мл). На основании только клинических и серологических данных (морфологическая диагностика не проводилась!) ребенку была диагностирована целиакия, после чего он был переведен на безглютеновую и безмолочную диету.
Соблюдение безглютеновой диеты не улучшило течение атопического дерматита. При обследовании в возрасте 1 года 7 месяцев у ребенка выявлен высокий уровень общего IgE сыворотки крови (390 МЕ/мл), сенсибилизация к аллергенам риса (++), коровьего молока, яйца (+) при отсутствии сенсибилизации к глютену, а также стойкая эозинофилия (10–14%). Спустя три недели после начала провокации глютеном наблюдалось обострение атопического дерматита и появление жидкого стула. Через 3 месяца от начала глютеновой нагрузки было проведено стационарное обследование, результаты которого выявили высокий уровень общего IgE (> 3000 МЕ/мл), поливалентную высокую (3+) степень IgE-сенсибилизации к пищевым аллергенам (в том числе к глютену и молоку). При этом антитела к тканевой трансглутаминазе IgA были в норме, по данным эзофагогастродуоденоскопии не было выявлено характерных признаков целиакии (толщина слизистой оболочки тонкой кишки в норме – 650 мкм, ворсинки – 350 мкм, крипты – 225 мкм, невысокая степень инфильтрации межэпителиальных лимфоцитов – 26,5%). Ребенку была назначена строгая безмолочная диета, но с употреблением злаков (рожь, рис, кукуруза, овес, ячневая каша), мяса и овощей. На фоне данной диеты сохранялись проявления атопического дерматита, а после употребления овсяной каши однократно отмечался отек Квинке. Ребенку был диагностирован атопический дерматит, гастроинтестинальные проявления пищевой аллергии и назначены антигистаминные препараты, сорбенты, проводилась наружная терапия с использованием мазей с глюкокортикостероидами и увлажняющих средств. Проведенное через год обследование выявило повышенный уровень общего IgE, поливалентную сенсибилизацию (коровье молоко, яйцо, глютен, пшеничная мука). Антитела к тканевой трансглутаминазе IgA оказались в норме, данных за целиакию по результатам эзофагогастродуоденоскопии не получено.
Как видно из представленного клинического примера, клиническая картина энтеропатии, связанной с аллергией к глютену, и целиакии очень схожа: отмечаются боли в животе, снижение аппетита, диарея, метеоризм, срыгивания, рвота, задержка физического развития. Однако целиакия чаще дебютирует во втором полугодии жизни ребенка (типично наличие латентного периода) и характеризуется прогрессированием тяжелых нарушений нутритивного статуса. К атипичным симптомам целиакии относят алопецию, железодефицитную анемию, рецидивирующие стоматиты, дефекты эмали зубов, герпетиформный дерматит, эпилепсию, раннее формирование остеопенического синдрома, задержку полового и физического развития. При морфологическом исследовании биоптатов слизистой оболочки тонкой кишки выявляется атрофический энтерит. Для подтверждения диагноза целиакии необходимо определение серологических маркеров целиакии: аутоантител к тканевой трансглутаминазе, антител к эндомизию (EMA). В настоящее время для диагностики целиакии не рекомендуется определение антиглиадиновых антител (IgA, IgG) ввиду низкой чувствительности и специфичности (NASPGHAN, 2006). Кроме того, целиакия – генетически детерминированное заболевание тонкой кишки, связанное с повышенной чувствительностью к глиадину, гетеродимеры DQ8 и DQ2 обнаруживаются приблизительно у 5–10% и 90–95% больных целиакией соответственно, что предопределяет высокую прогностическую ценность молекулярно-генетических диагностических методов исследования.
Младенческие кишечные колики, связанные с едой, могут быть одним из клинических симптомов аллергии к белкам коровьего молока. Некоторые исследователи считают, что младенческая кишечная колика может являться первым (а значит, единственным) проявлением атопического заболевания14, в этом случае матери рекомендуется строгая диета с полным исключением продуктов, содержащих белки коровьего молока, в сочетании с приемом препаратов кальция, а детей, находящихся на искусственном вскармливании, необходимо переводить на высокогидролизованные смеси. Если кишечные колики наблюдаются у ребенка с атопическим дерматитом, кровью в стуле, пациента необходимо перевести на диетотерапию аминокислотными смесями. У детей первого года жизни аллергия к белкам коровьего молока может стать причиной хронических запоров. Морфологической основой патологического процесса являются лимфоцитарная инфильтрация, интерстициальный отек, эозинофильная инфильтрация собственной пластинки слизистой оболочки толстой кишки. Повышение количества эозинофилов в слизистой прямой кишки приводит к замедлению пассажа каловых масс. Запоры, обусловленные аллергией к белкам коровьего молока, резистентны к традиционной терапии, но благополучно разрешаются на фоне элиминационной диеты15.
С учетом разнообразия аллергических реакций к пищевым белкам диагностика пищевой аллергии в целом и установление причинно-значимого аллергена в частности представляется весьма сложной задачей. Пищевую аллергию следует подозревать при положительном семейном аллергологическом анамнезе (в 65% случаев пищевой аллергии у детей раннего возраста), а также при наличии следующих наиболее характерных симптомов и расстройств:
Как видно из представленного клинического примера, клиническая картина энтеропатии, связанной с аллергией к глютену, и целиакии очень схожа: отмечаются боли в животе, снижение аппетита, диарея, метеоризм, срыгивания, рвота, задержка физического развития. Однако целиакия чаще дебютирует во втором полугодии жизни ребенка (типично наличие латентного периода) и характеризуется прогрессированием тяжелых нарушений нутритивного статуса. К атипичным симптомам целиакии относят алопецию, железодефицитную анемию, рецидивирующие стоматиты, дефекты эмали зубов, герпетиформный дерматит, эпилепсию, раннее формирование остеопенического синдрома, задержку полового и физического развития. При морфологическом исследовании биоптатов слизистой оболочки тонкой кишки выявляется атрофический энтерит. Для подтверждения диагноза целиакии необходимо определение серологических маркеров целиакии: аутоантител к тканевой трансглутаминазе, антител к эндомизию (EMA). В настоящее время для диагностики целиакии не рекомендуется определение антиглиадиновых антител (IgA, IgG) ввиду низкой чувствительности и специфичности (NASPGHAN, 2006). Кроме того, целиакия – генетически детерминированное заболевание тонкой кишки, связанное с повышенной чувствительностью к глиадину, гетеродимеры DQ8 и DQ2 обнаруживаются приблизительно у 5–10% и 90–95% больных целиакией соответственно, что предопределяет высокую прогностическую ценность молекулярно-генетических диагностических методов исследования.
Младенческие кишечные колики, связанные с едой, могут быть одним из клинических симптомов аллергии к белкам коровьего молока. Некоторые исследователи считают, что младенческая кишечная колика может являться первым (а значит, единственным) проявлением атопического заболевания14, в этом случае матери рекомендуется строгая диета с полным исключением продуктов, содержащих белки коровьего молока, в сочетании с приемом препаратов кальция, а детей, находящихся на искусственном вскармливании, необходимо переводить на высокогидролизованные смеси. Если кишечные колики наблюдаются у ребенка с атопическим дерматитом, кровью в стуле, пациента необходимо перевести на диетотерапию аминокислотными смесями. У детей первого года жизни аллергия к белкам коровьего молока может стать причиной хронических запоров. Морфологической основой патологического процесса являются лимфоцитарная инфильтрация, интерстициальный отек, эозинофильная инфильтрация собственной пластинки слизистой оболочки толстой кишки. Повышение количества эозинофилов в слизистой прямой кишки приводит к замедлению пассажа каловых масс. Запоры, обусловленные аллергией к белкам коровьего молока, резистентны к традиционной терапии, но благополучно разрешаются на фоне элиминационной диеты15.
С учетом разнообразия аллергических реакций к пищевым белкам диагностика пищевой аллергии в целом и установление причинно-значимого аллергена в частности представляется весьма сложной задачей. Пищевую аллергию следует подозревать при положительном семейном аллергологическом анамнезе (в 65% случаев пищевой аллергии у детей раннего возраста), а также при наличии следующих наиболее характерных симптомов и расстройств:
- Атопический дерматит (50–70%).
- Респираторные проявления – кашель/хрипы (20–30%).
- Гастроинтестинальные проявления:
- ГЭР или регургитация (42%);
- диарея, кровь в стуле (50–60%);
- задержка развития (25%);
- частый плач / раздражительность (27%).
Клинический пример 7. Мария Р., 10 месяцев, с отягощенной наследственностью по аллергии – у матери бронхиальная астма. На грудном вскармливании до 5 месяцев, затем переведена на смесь Микамилк, после чего у ребенка были отмечены первые проявления атопического дерматита в виде очагов сухости на наружной поверхности предплечий и голеней, гиперемии кожи лица. Переведена на смесь «MD мил Козочка», что привело к распространению элементов атопического дерматита на все тело, усилению сухости кожи. С 5 месяцев введен прикорм овощами и безмолочными кашами, с 6 месяцев – творог, с 7 месяцев – мясо, с 8 месяцев – кефир. Как следствие – с 6 месяцев наблюдается учащенный стул с постоянной примесью большого количества слизи. С 10 месяцев отмечен распространенный атопический дерматит, аппетит снижен, дважды в неделю отмечается рвота фонтаном съеденной пищей, прибавка в весе за 9-й месяц – всего 200 граммов, уровень общего IgE в сыворотке крови повышен – 300 кЕ/л (норма < 120 кЕ/л). Таким образом, детям с аллергией к белкам коровьего и козьего молока необходимо назначать аминокислотные или высокогидролизованные смеси. Так, по данным P.G. Giampietro и соавт. (2001), 97% детей, страдавших аллергией к белкам коровьего молока, переносят смесь Нутрилон Пепти ТСЦ (на основе 100%-ного гидролизата сывороточного белка), 94% – смесь Profylac (полный гидролизат) и лишь 64% – смесь Nan HA (частичный гидролизат)16.
Однако и на полные гидролизаты возможно развитие аллергических реакций17, что может быть связано с перекрестной аллергической реакцией на содержащиеся в некоторых смесях (например, Нутрамиген) кукурузные белки (из кукурузного крахмала). С. Caffarelli и соавт. (2002) изучали переносимость и аллергенность гидролизованных и аминокислотных смесей у 20 детей с IgE-обусловленной аллергией к белкам коровьего молока: у 5 из 17 детей развились симптомы аллергии при введении частичного гидролизата, у 3 из 16 – при введении полного сывороточного гидролизата, у 1 из 10 – при введении аминокислотной смеси и у 1 из 16 – при введении полного казеинового гидролизата. При этом использование гидролизатов белка провоцировало появление ранней и отсроченной аллергической реакции, а использование аминокислотной смеси – отсроченную. Повышение уровня специфических IgE-антител отмечено у 2 детей, получавших полный сывороточный гидролизат, у 1 ребенка – при использовании частичного гидролизата, у 1 ребенка, получавшего полный казеиновый гидролизат, и ни в одном случае на фоне применения аминокислотной смеси18. При тяжелом течении аллергии для формирования пищевой толерантности к аллергенам возможно применение следующей терапевтической тактики: начать диетотерапию с введения аминокислотной смеси, затем перевести пациента на смесь на основе гидролизата казеина, после этого перейти на смесь на основе гидролизата сывороточного белка и затем – на частичный гидролизат.
Одной из наиболее эффективных и безопасных (в том числе при длительном применении) в лечении детей раннего возраста с пищевой аллергией является аминокислотная смесь Неокейт. Применение данного продукта имеет 25-летнюю доказательную базу по лечению аллергии к белкам коровьего молока19–22, множественной пищевой непереносимости23, атопического дерматита4, 5, ГЭР8, 24, эозинофильного эзофагита10–12. Аминокислотная смесь Неокейт включена в европейские (Рекомендации по диагностике и лечению аллергии к белкам коровьего молока у детей, 2007)25 и международные (DRACMA 2010)26 рекомендации, а также в Национальную программу оптимизации вскармливания детей первого года жизни в Российской Федерации (2010). В заключение отмечу: педиатры должны быть внимательны к проявлению гастроинтестинальных симптомов пищевой аллергии, особенно в сочетании с кожными. Своевременно поставленный диагноз и правильное лечение останавливают развитие заболевания и дают шанс на полное избавление от аллергии.
Одной из наиболее эффективных и безопасных (в том числе при длительном применении) в лечении детей раннего возраста с пищевой аллергией является аминокислотная смесь Неокейт. Применение данного продукта имеет 25-летнюю доказательную базу по лечению аллергии к белкам коровьего молока19–22, множественной пищевой непереносимости23, атопического дерматита4, 5, ГЭР8, 24, эозинофильного эзофагита10–12. Аминокислотная смесь Неокейт включена в европейские (Рекомендации по диагностике и лечению аллергии к белкам коровьего молока у детей, 2007)25 и международные (DRACMA 2010)26 рекомендации, а также в Национальную программу оптимизации вскармливания детей первого года жизни в Российской Федерации (2010). В заключение отмечу: педиатры должны быть внимательны к проявлению гастроинтестинальных симптомов пищевой аллергии, особенно в сочетании с кожными. Своевременно поставленный диагноз и правильное лечение останавливают развитие заболевания и дают шанс на полное избавление от аллергии.
1. Klemola T., Vanto T., Juntunen-Backman K. et al. Allergy to soy formula and to extensively hydrolyzed whey formula in infants with cow's milk allergy: a prospective, randomized study with a follow-up to the age of 2 years // J. Pediatr. 2002. Vol. 140. ¢ 2. P. 219–224.
2. Koletzko S., Niggemann B., Arato A. et al. Diagnostic approach and management of cow’s-milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines // J. Pediatr. Gastroenterol. Nutr. 2012. Vol. 55. № 2. P. 221–229.
3. Bock S.A., Sampson H.A., Atkins F.M. et al. Double-blind, placebo-controlled food challenge (DBPCFC) as an office procedure: a manual // J. Allergy Clin. Immunol. 1988. Vol. 82. № 6. P. 986–997.
4. Isolauri E., Sütas Y., Mäkinen-Kiljunen S. et al. Efficacy and safety of hydrolyzed cow milk and amino acid-derived formulas in infants with cow milk allergy // J. Pediatr. 1995. Vol. 127. № 4. P. 550–557.
5. Niggemann B., Binder C., Dupont C. et al. Prospective, controlled, multi-center study on the effect of an amino-acid-based formula in infants with cow's milk allergy/intolerance and atopic dermatitis // Pediatr. Allergy Immunol. 2001. Vol. 12. № 2. P. 78–82.
6. Sampson H.A., Anderson J.A. Summary and recommendations: Classification of gastrointestinal manifestations due to immunologic reactions to foods in infants and young children // J. Pediatr. Gastroenterol. Nutr. 2000. Vol. 30. Suppl. P. S87–S94.
7. Iacono G., Carroccio A., Cavataio F. et al. Gastroesophageal reflux and cow’s milk allergy in infants: a prospective study // J. Allergy Clin. Immunol. 1996. Vol. 97. № 3. P. 822–827.
8. Hill D.J., Heine R.G., Cameron D.J. et al. Role of food protein intolerance in infants with persistent distress attributed to reflux esophagitis // J. Pediatr. 2000. Vol. 136. № 5. P. 641–647.
9. Hill D.J., Heine R.G., Cameron D.J. et al. Role of food protein intolerance in infants with persistent distress attributed to reflux esophagitis // J. Pediatr. 2000. Vol. 136. № 5. P. 641–647.
10. Spergel J.M., Andrews T., Brown-Whitehorn T.F. et al. Treatment of eosinophilic esophagitis with specific food elimination diet directed by a combination of skin prick and patch tests // Ann. Allergy Asthma Immunol. 2005. Vol. 95. № 4. P. 336–343.
11. Markowitz J.E., Spergel J.M., Ruchelli E. et al. Elemental diet is an effective treatment for eosinophilic esophagitis in children and adolescents // Am. J. Gastroenterol. 2003. Vol. 98. № 4. P. 777–782.
12. Liacouras C.A., Spergel J.M., Ruchelli E. et al. Eosinophilic esophagitis: a 10-year experience in 381 children // Clin. Gastroenterol. Hepatol. 2005. Vol. 3. № 12. P. 1198–1206.
13. Maloney J., Nowak-Wegrzyn A. Educational clinical case series for pediatric allergy and immunology: allergic proctocolitis, food protein-induced enterocolitis syndrome and allergic eosinophilic gastroenteritis with protein-losing gastroenteropathy as manifestations of non-IgE-mediated cow's milk allergy // Pediatr. Allergy Immunol. 2007. Vol. 18. № 4. P. 360–367.
14. Hill D.J., Roy N., Heine R.G. et al. Effect of a low-allergen maternal diet on colic among breastfed infants: a randomized, controlled trial // Pediatrics. 2005. Vol. 116. № 5. P. e709–e715.
15. Carroccio A., Scalici C., Maresi E. et al. Chronic constipation and food intolerance: a model of proctitis causing constipation // Scand. J. Gastroenterol. 2005. Vol. 40. № 1. P. 33–42.
16. Giampietro P.G., Kjellman N.I., Oldaeus G. et al. Hypoallergenicity of an extensively hydrolyzed whey formula // Pediatr. Allergy Immunol. 2001. Vol. 12. № 2. P. 83–86.
17. Nilsson C., Oman H., Halldén G. et al. A case of allergy to cow's milk hydrolysate // Allergy. 1999. Vol. 54. № 12. P. 1322–1326.
18. Caffarelli C., Plebani A., Poiesi C. et al. Determination of allergenicity to three cow’s milk hydrolysates and an amino acid-derived formula in children with cow's milk allergy // Clin. Exp. Allergy. 2002. Vol. 32. № 1. P. 74–79.
19. De Boissieu D., Matarazzo P., Dupont C. Allergy to extensively hydrolyzed cow milk proteins in infants: identification and treatment with an amino acid-based formula // J. Pediatr. 1997. Vol. 131. № 5. P. 744–747.
20. Vanderhoof J.A., Murray N.D., Kaufman S.S. et al. Intolerance to protein hydrolysate infant formulas: an underrecognized cause of gastrointestinal symptoms in infants // J. Pediatr. 1997. Vol. 131. № 5. P. 741–744.
21. De Boissieu D., Dupont C. Time course of allergy to extensively hydrolyzed cow's milk proteins in infants // J. Pediatr. 2000. Vol. 136. № 1. P. 119–120.
22. De Boissieu D., Dupont C. Allergy to extensively hydrolyzed cow's milk proteins in infants: safety and duration of amino acid-based formula // J. Pediatr. 2002. Vol. 141. № 2. P. 271–273.
23. Hill D.J., Cameron D.J., Francis D.E. et al. Challenge confirmation of late-onset reactions to extensively hydrolyzed formulas in infants with multiple food protein intolerance // J. Allergy Clin. Immunol. 1995. Vol. 96. № 3. P. 386–394.
24. Thomson M., Wenzl T.G., Fox A.T. et al. Effect of an amino acid-based Milk – Neocate® – on gastro-oesophageal reflux in infants assessed by combined intraluminal impedance/pH // Pediatr. Asthma Allergy Immunol. 2006. Vol. 19. № 4. P. 205–213.
25. Vandenplas Y., Koletzko S., Isolauri E. et al. Guidelines for the diagnosis and management of cow's milk protein allergy in infants // Arch. Dis. Child. 2007. Vol. 92. № 10. P. 902–908.
26. Fiocchi A., Brozek J., Schünemann H. et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) Guidelines // World Allergy Organ. J. 2010. Vol. 3. № 4. P. 57–161.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.