Холелитиаз и билиарный сладж: современные методы диагностики и лечения
- Аннотация
- Статья
- Ссылки
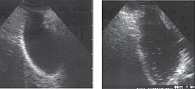
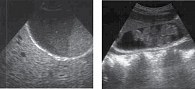




Актуальность проблемы холелитиаза и билиарного сладжа
Желчнокаменной болезнью (ЖКБ) люди страдают более 4 тысяч лет. Раскопки археологов древнего кладбища Мусенае (Греция) среди сокровищ обнаружили не только драгоценные камни, но и человеческие желчные конкременты, относящиеся к XVII в. до н.э. По прошествии нескольких тысячелетий проблема ЖКБ не потеряла актуальности. Истинную распространенность заболевания установить трудно, так как его течение нередко носит латентный характер. ЖКБ значительно «помолодела» – она встречается не только в молодом, но и в раннем детском возрасте. Общепризнанными факторами риска развития ЖКБ являются женский пол, пожилой возраст, частые беременности и роды, избыточная масса тела, гиподинамия, неблагоприятная наследственность, нарушения липидного обмена, метаболический синдром, перенесенный эпидемический гепатит, заболевания органов малого таза, отрицательные эмоции, нерациональное питание и т.д. Болезнь стала довольно часто появляться не только у женщин, но и у мужчин. Наряду с распространенностью ЖКБ отмечается увеличение осложненных форм ее течения. Наиболее частыми из них являются механическая желтуха (13–43%) и гнойный холангит (при холедохолитиазе – 66,4–88,1%). Согласно последней классификации ЖКБ, которая была утверждена на 3-м внеочередном съезде Научного общества гастроэнтерологов России (2002), билиарный сладж (БС) отнесен к начальной стадии ЖКБ (табл. 1).
Термин «билиарный сладж» впервые появился в 1970-х гг. в англоязычной литературе (англ. sludge – грязь, муть, ил). К сожалению, адекватного эквивалента в русском языке, который мог бы быть использован в отечественной медицинской литературе, не найдено, и термин был заимствован в оригинальной транскрипции.
В настоящее время в литературе нет четкого определения БС. Термином «БС» обозначают любую неоднородность желчи, выявляемую при эхографическом исследовании. Однако специалистам ультразвукового исследования (УЗИ) хорошо известно, что эхографическая картина измененной желчи весьма разнообразна. При этом могут выявляться: взвешенный осадок мелких частиц; расслоение желчи с образованием горизонтального уровня «жидкость – жидкость» (более эхогенная часть желчи в области задней стенки желчного пузыря с ее последующим смещением при изменении положения тела больного); образование сгустков эхогенной желчи, фиксированных или смещаемых к стенке желчного пузыря и иногда симулирующих опухолевидное образование; тотальное повышение эхогенности желчи, по плотности сопоставимое с паренхимой печени (замазкообразная желчь).
С практической точки зрения целесообразно выделять три основных варианта БС, имеющих наиболее четко очерченную эхографическую картину.
- Микролитиаз – взвесь гиперэхогенных частиц (ВГЧ) в виде точечных, единичных или множественных, смещаемых гиперэхогенных образований, не дающих акустической тени, выявляемых после изменения положения тела пациента.
- Эхонеоднородная желчь с наличием различной плотности сгустков (ЭЖС), смещаемых и не дающих акустической тени или, в редких случаях, с эффектом ослабления за сгустком.
- Сочетание замазкообразной желчи (ЗЖ) с микролитами. При этом микролиты могут быть одновременно как в составе сгустка ЗЖ, так и в полости желчного пузыря.
В общей популяции населения среди лиц, не страдающих ЖКБ, частота БС не превышает 1,7–4%, а среди лиц, имеющих жалобы со стороны органов желудочно-кишечного тракта, встречается в 7,5% случаев. В то же время у пациентов с жалобами, характерными для диспепсии билиарного типа, частота БС значительно увеличивается и достигает 24–55%. По данным С.Н. Мехтиева и соавт., из 400 пациентов с различной патологией желудочно-кишечного тракта (ЖКТ) БС был выявлен у 192 (48%). По данным А.А. Ильченко, из 1500 больных с различной билиарной патологией БС был выявлен у 612 (40,8%). В исследовании, проведенном нами в ООО «Медицинские центры» среди 1056 пациентов с билиарной диспепсией, наиболее часто БС встречался в виде взвеси гиперэхогенных частиц (74,4%), в то время как частота остальных вариантов не превышала 11,8%. Все причины образования БС неизвестны, однако предрасполагающими являются те же факторы, что и при ЖКБ. В нашем исследовании семейный анамнез прослеживался в 46,3% случаев.
Этиология и патогенез БС и ЖКБ
Основной причиной, приводящей к развитию БС и ЖКБ, является перенасыщение желчи холестерином, в результате которого она приобретает литогенные свойства. Это состояние развивается при изменении активности ключевых ферментов, участвующих в формировании литогенной желчи, – повышении активности гидрокси-метил-глутарил-коэнзим-А-редуктазы (ГМГ-КоА-редуктазы) и/или снижении активности холестерин-7a-гидроксилазы. При изменении активности этих ферментов в печени синтезируется много холестерина и мало желчных кислот. Следует отметить, что холестерин нерастворим в водной среде и выводится из печени в виде смешанных мицелл (в соединении с желчными кислотами и фосфолипидами), которые являются водорастворимыми соединениями. Смешанные мицеллы способны удерживать холестерин в стабильном (солюбилизированном) состоянии. Такое состояние характеризуется низким индексом насыщения холестерином (ИНХ), рассчитываемым из соотношения холестерина, желчных кислот и фосфолипидов. Высокий ИНХ отмечается либо при перенасыщении желчи холестерином, либо при снижении концентрации желчных кислот.
При высоком ИНХ весь холестерин не может быть транспортирован в виде смешанных мицелл. Его избыток транспортируется в фосфолипидных пузырьках (везикулах), которые являются нестабильными; холестерин легко агрегируется и осаждается в виде кристаллов моногидрата холестерина, создавая основу для формирования различных вариантов БС, а далее – ЖКБ. В состав БС и ЖКБ кроме кристаллов моногидрата холестерина могут входить соли кальция – билирубинат кальция, карбонат и фосфат кальция, муцин-гликопротеиновый гель и другие компоненты желчи. Причины, обусловливающие образование той или иной формы БС, на сегодняшний день неизвестны, как неизвестны причины образования в одних случаях единичного, а в других – множественных желчных конкрементов. Однако факторы, способствующие формированию БС, те же, что и при холецистолитиазе: перенасыщение желчи холестерином, снижение сократительной функции желчного пузыря (СФЖП) и нарушение динамического равновесия между активностью пронуклеирующих (гликопротеины слизи, иммуноглобулины M и G, аминопептидаза-N, свободный ионизированный кальций, фосфолипаза-С, билирубин, ряд белков с выраженными гидрофильными свойствами и др.) и антинуклеирующих факторов (желчные кислоты, аполипопротеин АI и АII, ряд низкомолекулярных белков с гидрофобными свойствами, лецитин, аспирин и другие нестероидные противовоспалительные средства). При хорошей СФЖП все агломерировавшие частицы выбрасываются в двенадцатиперстную кишку. У больных БС и ЖКБ выявляют различные варианты функциональных нарушений. Наиболее быстрому прогрессированию процессов холелитиаза способствует билиарная дисфункция в виде гипотонии желчного пузыря и гипертонуса сфинктера Одди. В настоящее время получены данные, свидетельствующие о том, что снижение СФЖП является результатом прямого воздействия холестерина на сарколеммную мембрану миоцита. In vitro амплитуда сокращения миоцитов, изолированных из только что извлеченных желчных пузырей больных ЖКБ, в ответ на действие холецистокинина уменьшена до 10 раз, несмотря на увеличение мышечной массы стенки желчного пузыря в 2 раза. Желчный пузырь обладает мощной концентрационной функцией. В результате этого соотношение концентраций основных компонентов в печеночной и пузырной желчи составляет 1:10. Снижение эвакуаторной функции желчного пузыря при сохранении его концентрационной функции способствует формированию БС, а в последующем и желчных камней. Выделяют следующие этапы формирования БС и холестериновых желчных камней: 1) перенасыщение желчи холестерином; 2) нуклеация и преципитация кристаллов моногидратного холестерина; 3) агрегация кристаллов в микролиты и их последующий рост. Одним из важных аргументов, позволяющих расценивать БС как начальную стадию формирования желчных камней, является тот факт, что со временем у 8–20% больных БС образуются конкременты. Немаловажным является и тот факт, что в 30–60% случаев наблюдается персистенция БС, когда он исчезает и появляется вновь. Последнее обстоятельство позволяет, с одной стороны, говорить об обратимости ЖКБ на ранних стадиях, с другой стороны, «благодаря» БС создается достаточно большой «резерв» для формирования в последующем у таких больных желчных камней.
Диагностика билиарного сладжа и желчнокаменной болезни
Основным методом диагностики БС и ЖКБ является трансабдоминальная ультрасонография (ТУС). Исследование проводят в положении больного на спине, левом боку и после перемены положения. При необходимости ТУС дополняется эндоскопической ультрасонографией (ЭУС). ЭУС показана и в тех случаях, когда имеются трудности в проведении дифференциального диагноза, например, между фиксированным к стенке желчного пузыря сгустком ЗЖ и пристеночными образованиями, в первую очередь опухолевого генеза. С помощью УЗИ изучают состояние стенки желчного пузыря (наличие холестероза или воспаления), что в ряде случаев может объяснить причину формирования БС и ЖКБ. Важно исследование СФЖП. С этой целью изучают объем желчного пузыря базальный и после желчегонного завтрака. При сохраненной СФЖП коэффициент опорожнения составляет не менее 50%. Биохимическое исследование желчи демонстрирует снижение холатохолестеринового коэффициента и повышение ИНХ (табл. 2).
Клинические признаки билиарного сладжа
Клиническая картина при БС не имеет специфической симптоматики. Больные жалуются на дискомфорт или боли в правом подреберье, чаще связанные с погрешностью в питании, которым может сопутствовать ощущение горечи во рту, возникающее, как правило, в утренние часы. Начальной формой БС является эховзвесь в ЖП – легко смещаемый осадок мелких частиц. Частота ее составила 22%. Эта форма БС чаще протекает без клинических проявлений, легко обратима, СФЖП сохранена. Наиболее часто выявляемая форма БС проявляется неоднородной желчью, сгустками, занимающими не более 2/3 ЖП. В исследовании С.Н. Мехтиева и соавт. частота этой формы БС составила 64%. Указанная форма БС отличается рецидивирующим течением, наличием болевого и диспепсического синдромов. Отмечается умеренное снижение СФЖП. Данная форма БС в наблюдении С.Н. Мехтиева и соавт. прогрессировала до холелитиаза в 20% случаев. Следующая форма БС, частота которой, по данным С.Н. Мехтиева, составила 14%, включала в себя УЗИ-проявления БС-нозологии, сочетающиеся со значительно сниженной или утраченной СФЖП («отключенный» ЖП). Авторы предложили использовать термин «особые формы БС» с указанием вида нарушения реологии желчи. Формы заболевания значимы в определении прогноза. К особым формам БС следует отнести микрохолелитиаз – множественные мелкие (1–2 мм) плавающие конкременты, заполняющие весь просвет ЖП, СФЖП значительно снижена. Клинически проявляется рецидивирующим, резистентным к консервативной терапии болевым синдромом. На фоне микрохолелитиаза возможно быстрое прогрессирование хронического панкреатита. Еще одним вариантом БС являются холестериновые полипы – фиксированные к стенке ЖП несмещаемые образования с неоднородной структурой. Отмечаются боли билиарного типа, нарушения холестеринового обмена и снижение СФЖП. Холецистэктомия при этой патологии не всегда оправдана. Холестериновые полипы при отсутствии лечения приводят к быстрому (6–24 месяца) формированию конкрементов в ЖП (40%). Вариантом БС является также замазкообразная желчь, напоминающая солидное образование в ЖП. Клиническая картина варьирует, преобладают гипомоторные характеристики болевого синдрома, выраженные диспепсические проявления, запоры, клиника дисбактериоза. Данный вариант БС практически полностью резистентен к консервативному лечению и более чем в 80% случаев сочетается со значительным снижением СФЖП или «отключенным» ЖП.
Исследования показывают, что течение БС часто (до 75% случаев) осложняется билиарным панкреатитом, дисфункцией или стенозом сфинктера Одди, реже – острым холециститом, холангитом, «отключением» желчного пузыря. Эти факты обосновывают необходимость своевременного устранения причин, способствующих формированию БС и развитию осложнений (табл. 3).
Однако сопоставление описания УЗИ-картины и УЗИ-заключения в исследовании, проведенном нами в 2010 г. в первичном звене здравоохранения Москвы, выявило следующие закономерности: проводя описание БС в протоколе исследования, врачи УЗИ-диагностики в большинстве случаев не выносят данный диагноз в заключение, останавливаясь лишь на наличии или отсутствии признаков холецистита или дискинезии желчевыводящих путей при проведении пробы с желчегонным завтраком. В свою очередь, врачи амбулаторного приема по таким заключениям также не уделяют должного внимания проблеме БС, и фактически выявление ЖКБ на ее физико-химической стадии не проводится, а следовательно, отсутствует и адекватная коррекция лечения.
Лечение билиарного сладжа и ЖКБ
В связи с вышесказанным не вызывает сомнения, что все пациенты с БС нуждаются в наблюдении и терапии. Аналогично существующим терапевтическим подходам у пациентов с ЖКБ, задачами терапии для больных с БС можно назвать следующие: улучшение реологических свойств желчи; нормализация моторики ЖП, СФО, тонкой кишки; восстановление нормального состава кишечной микрофлоры; нормализация пищеварения и всасывания. Больные калькулезным холециститом в большинстве случаев должны подвергаться плановой операции (холецистэктомии), причем чем раньше проведена операция (до первого приступа желчной колики или вскоре после него), тем лучше исход. Несвоевременно проведенная холецистэктомия является одной из главных причин постхолецистэктомического синдрома в связи с развитием задолго до операции осложнений со стороны кишечника, поджелудочной железы, печени, желудка. Неотложной также является холецистэктомия при развитии флегмонозного, гангренозного, перфоративного калькулезного холецистита. Холецистэктомия показана также при так называемом отключенном, нефункционирующем желчном пузыре. При наличии крупных (более 3 см) конкрементов, создающих угрозу возникновения пролежней, а также мелких (5 мм и менее) камней из-за опасности выхода их в желчные протоки с развитием холедохолитиаза оперативное лечение целесообразно даже при маловыраженной клинической картине заболевания. Внедрение в клиническую практику лапароскопической холецистэктомии позволило сократить сроки пребывания больного в стационаре после операции и исключить косметический дефект. Перспективным является внедрение в клиническую практику контактной литотрипсии и эндоскопической папиллосфинктеротомии с извлечением камня из холедоха через эндоскоп.
Бесспорно положение о том, что больные с частыми приступами желчной колики подлежат хирургическому лечению. Лекарственное растворение камней может быть рекомендовано пациентам без клинических проявлений холелитиаза («отключенный» желчный пузырь), лицам группы повышенного риска операции, а также категорически отказывающимся от хирургического лечения.
Вопросы улучшения реологических свойств желчи составляют основу программы лечения при данной патологии. С точки зрения патогенетических механизмов, участвующих в формировании БС, идеальными являются лекарственные средства, которые влияют на основные звенья билиарного литогенеза. К таким средствам, напрямую действующим на эти звенья, относятся препараты желчных кислот. Ряд исследователей рассматривают проведение литолитической терапии БС с помощью препаратов желчных кислот. Показанием при этом служит его стойкое выявление по данным УЗИ на протяжении 3 месяцев даже при отсутствии клинической симптоматики. В настоящее время из указанной фармакологической группы в клинической практике активно применяются препараты урсодеоксихолевой кислоты (УДХК). Именно они являются основой лечения пациентов с БС. Среди общего пула желчных кислот доля УДХК в норме не превышает 5%, тогда как при трехмесячном (и более) пероральном приеме препарата УДХК становится доминирующей, составляя более 60% всех желчных кислот. Таким образом, с помощью этого лекарственного средства можно добиться быстрого и значительного изменения физико-химических свойств одной из сред человеческого организма – желчи. УДХК действует на разные этапы метаболизма холестерина и синтеза желчи. Так, она тормозит всасывание холестерина в кишечнике, оказывает ингибирующее влияние на синтез холестерина, образует жидкие растворимые кристаллы с холестерином. Следует заметить, что в материалах III Римского консенсуса относительно лечения дисфункций ЖП и СФО обсуждалась потенциальная профилактическая роль УДХК в отношении развития ЖКБ и лечения ее начальной стадии. Авторы Римских критериев в заключительной части документа, намечая перспективы лечения в данной области, отмечают, что УДХК имеет наиболее значимый терапевтический потенциал. Кроме этого, говоря об уже известных эффектах, они сообщили еще об одном положительном аспекте ее применения, который заключается в том, что данная гидрофильная кислота не только уменьшает избыток холестерина в мышечных клетках ЖП с литогенной желчью, но и нормализует эффекты окислительного стресса. Исходя из этого, она может быть применима и к лечению функциональных расстройств ЖП, связанных с ранней стадией заболевания. Продолжительность курса лечения зависит от выраженности клинической картины и формы БС. Для БС в виде эховзвеси обычно достаточно месячного курса УДХК. При других формах курс лечения более длительный, но, как правило, не превышает 12 месяцев. УДХК назначается однократно на ночь из расчета 10–15 мг/кг массы тела в сутки. Помимо уменьшения литогенности желчи, снижения холатохолестеринового коэффициента, растворения холестериновых желчных камней и предупреждения образования новых кристаллов, УДХК обладает и гепатопротекторным действием и в настоящее время широко применяется для лечения сопутствующих гепатитов, не только реактивных при ПХЭС, но также алкогольной и вирусной этиологии. Доказана эффективность УДХК при описторхозе, препарат может применяться и при беременности.
Исследования последних лет показали, что Гепабене можно назначать лицам с различными формами БС, как протекающего самостоятельно, так и развившегося на фоне холестероза ЖП. В течение 7–14 дней у большинства больных купируются боли и диспепсический синдром, а при лечении от 1 до 2 месяцев в 60–100% случаев БС исчезает. Подобный эффект обусловлен, с одной стороны, способностью препарата нормализовывать работу сфинктерного аппарата желчных путей, а с другой – влиянием на литогенные свойства желчи в результате улучшения функции гепатоцита. Исследованиями, проведенными в Центральном НИИ гастроэнтерологии (Ю.Н. Орлова), установлено, что уже после двухнедельного приема Гепабене по 1 капсуле 3 раза в день у 75% больных с гипокинезией ЖП увеличивается ФВ в среднем на 6,7 мл. В нашем исследовании Гепабене назначали пациентам, имеющим экономический статус, ограничивающий приобретение УДХК для длительного применения. На фоне приема Гепабене (346 пациентов) симптомы билиарной диспепсии были ликвидированы в 100%, однако эффективность ликвидации БС в течение 6 месяцев составила 36,8%. В то же время не наблюдалось ни одного случая побочных эффектов.
Дисфункции билиарного тракта у детей наблюдаются при расстройствах нейрогуморальных регуляторных механизмов (нередко являются следствием невроза), возникают с множественными очагами вторичной инфекции, при лямблиозе, глистной инвазии, после перенесенного вирусного гепатита, дизентерии, при неправильном режиме дня (малоподвижный образ жизни, переутомление в школе), нарушенном режиме питания (нерегулярные или редкие приемы пищи с большими интервалами), насильственном кормлении, конфликтных ситуациях в школе, семье. В то же время назначение препаратов УДХК этой группе пациентов имеет определенные возрастные ограничения.
Под нашим наблюдением находились 156 детей с БС в возрасте от 3 до 16 лет. Из них 89,1% пациентов с дисфункцией билиарного тракта жаловались на боли в правом подреберье. У 36,4% детей отмечалось чувство тяжести в эпигастрии после приема пищи. На чувство дискомфорта в эпигастральной области и области правого подреберья жаловались 28,3% больных. Вздутие живота отмечали 51,7% детей. На нарушение аппетита, тошноту указывали 22,3% пациентов, на запоры – 74,6% детей. На УЗИ у 41,4% детей выявлены перегибы ЖП, увеличение ЖП отмечено у 64,7% пациентов. У 52,3% детей в полости ЖП определялся БС. У 24,7% детей выявлены реактивные изменения поджелудочной железы в виде повышенной эхогенности и неоднородности эхоструктуры. В копрограмме 32,1% детей обнаруживался нейтральный жир, у 48,1% – мышечные волокна, у 32,8% – мыло, у 21,1% – крахмал, у 26,7% – йодофильная флора. Пациентам назначался препарат растительного происхождения из листьев артишока Хофитол. Хофитол снижает уровень холестерина путем усиления холеретического действия и снижения его внутрипеченочного синтеза. Являясь холеретическим препаратом, он стимулирует желчеотделение и ослабляет литогенные свойства желчи, что снижает риск развития холелитиаза. Хофитол защищает печеночные клетки, укрепляет мембрану гепатоцита за счет антиоксидантного действия, стимулирует антитоксическую функцию печени, улучшает жировой и углеводный обмен, улучшает аппетит. Препарат способствует устранению воспалительных и застойных явлений в ткани печени и желчевыводящих путях. В результате перорального приема Хофитола в течение 2 недель у всех пациентов отмечалось улучшение общего самочувствия. Боли в правом подреберье, чувство дискомфорта, метеоризм купировались у всех детей к концу 1-й недели от начала приема препарата. Стул к концу 1-й недели от начала лечения нормализовался у 68,2% детей, к концу 2-й недели – у 90,3%. В 2,3% случаев отмечалось некоторое усиление болей в правом подреберье через 3–4 суток от начала приема препарата, что обусловило необходимость его отмены. У всех больных с увеличенным ЖП нормализовались или значительно сократились его размеры. У 39,5% детей наблюдалось исчезновение осадка в ЖП после 2 недель лечения Хофитолом, а к концу 3-й недели от начала приема Хофитола у 86,3% детей БС исчез, в остальных случаях отмечалось значительное его уменьшение по данным ультразвукового исследования. У всех детей произошла нормализация копрограммы.
Нарушения моторики болевого синдрома обусловливают целесообразность применения при билиарном ФРСО, ФРЖП и БС препаратов со спазмолитическим действием. В ряду миотропных спазмолитиков следует отметить препарат Мебеверин (Дюспаталин). В отличие от неселективных спазмолитиков, он приводит к кратковременному выходу ионов калия из клетки, купирует спазм, но не вызывает гипотонию гладкой мускулатуры, что особенно актуально при сочетании сниженной СФЖП и гипертонуса СФО. Препарат эффективен при купировании болей, дискомфорта и нарушений стула у больных с начальной стадией ЖКБ. При панкреатическом ФРСО механизм возникновения боли связан с повышением давления в мелких протоках поджелудочной железы. При лечении пациентов с панкреатическим ФРСО кроме спазмолитиков добавляют препараты с секретолитическим действием: холиноблокаторы, и/или блокаторы протонной помпы, и/или Н2-гистаминоблокаторы. При неэффективности спазмолитической терапии используют эндоскопические методы (сфинктеропапиллотомию). В материалах Римского консенсуса сфинктеропапиллотомию рекомендуется проводить при стенозе СФО, сопутствующем рецидивирующем панкреатите, отсутствии эффекта от консервативной терапии БС и прогрессировании изменений в ЖП, при особых формах БС (в некоторых случаях).
Изменения липидного состава крови всегда отмечаются на фоне глубоких микроэкологических нарушений в кишечнике. Микроорганизмы пищеварительного тракта вмешиваются в холестериновый метаболизм, воздействуя непосредственно на ферментативные системы клеток хозяина, синтезирующие эндогенный холестерин. Микробная контаминация тонкой кишки, особенно анаэробов с их повышенной способностью деконъюгировать связанные желчные кислоты и формировать токсические эндогенные соли желчных кислот, нарушает природный механизм холестеринового гомеостаза – энтерогепатическую циркуляцию желчных кислот – и способствует развитию и прогрессированию в последующем дислипопротеидемии. Антибактериальные препараты рекомендуются только при верифицированной чувствительной условно-патогенной флоре кишечника. Препаратами выбора при этом считаются фторхинолоны первого поколения, которые накапливаются в желчи (Ципрофлоксацин), и не всасывающиеся в кишечнике антисептики (Рифаксимин). Для восстановления микроэкологической системы кишечника, его стабильности научно обоснованным следует считать назначение не антибиотиков широкого спектра действия, как это распространено в общей врачебной практике, а пробиотиков и пребиотиков. Их санирующее действие обусловлено продукцией антибактериальных метаболитов, ингибирующих рост потенциально патогенных микробов, и высокой способностью к адгезии – прикреплению к мукозному слою, к кишечному эпителию. Это повышает колонизационную антиинфекционную резистентность кишечного барьера, стимулирующего лимфоидный аппарат, достаточный уровень секреторного IgA. У больных с БС, дополнительно получающих Эубикор, уменьшается выраженность дисбактериоза, проявлений метаболического синдрома и дислипопротеидемии, что улучшает реологию желчи. Дюфалак реализует свое действие в толстой кишке, способствует нарастанию биомассы сахаролитической флоры, увеличению объема кишечного содержимого. Кроме этого, препарат обладает слабительным действием. Однако в некоторых случаях Дюфалак может способствовать возникновению дополнительного болевого синдрома.
В случаях сочетанного обнаружения БС и хеликобактериоза путем проведения дыхательного хелик-теста (18,5% взрослых пациентов и 5,3% детей) лечебный алгоритм предполагал последовательную антихеликобактерную терапию и следующую за ней литолитическую терапию.
Диетотерапия занимает существенное место в лечении больных с ЖКБ и БС. При проведении анкетирования было выяснено, что 100% пациентов до начала лечения не имели информации о принципах рациональной диетотерапии при заболеваниях ЖП. Со всеми пациентами (а при работе с детьми – со всеми родителями) проводились беседы о принципах рациональной диетотерапии и раздавались учебно-методические пособия, что позволило добиться не только повышения приверженности терапии, но и в 78,5% случаев – изменения стереотипов питания. Ограничения в приверженности диетотерапии продемонстрировали 12,5% взрослых пациентов. Наибольшую сложность вызывало не столько изменение диетического рациона, сколько оптимизация режима питания с частыми приемами небольших количеств пищи (5–6-разовое питание). В группе детей школьного возраста была ограничена возможность контроля приема пищи в период нахождения в школе. Практически все взрослые пациенты до выявления БС и начала лечения не имели информации о влиянии на сократительную функцию ЖП температурных характеристик употребляемой пищи, алкогольных напитков, психоэмоциональных и физических нагрузок. Женщинам (61,2% взрослого контингента пациентов) дополнительно давались разъяснения по поводу влияния на сократительную функцию ЖП женских половых гормонов и предлагалось ведение дневника боли в зависимости от фазы менструального цикла. Таким образом, в ходе проведенного исследования был не только оптимизирован алгоритм диагностики, медикаментозного и немедикаментозного лечения БС, но и была проведена работа по оптимизации профилактики данного заболевания внутри семьи. В настоящее время 35,6% взрослых пациентов, включенных в исследование, понимают необходимость выявления и лечения БС и хеликобактериоза у других членов семьи. В то же время проведенное нами исследование показало недостаток информационных материалов для пропаганды рационального питания и здорового образа жизни по конкретной проблеме, отсутствие адаптированных материалов для различных возрастных групп.
Постхолецистэктомический синдром (ПХЭС) – условное обозначение различных нарушений, возникающих у части больных после холецистэктомии. Проявления заболевания связаны с изменением химического состава желчи, нарушением ее пассажа в двенадцатиперстную кишку. Выпадение функции желчного пузыря и дискинезия (спазм) сфинктера ведут к нарушениям пищеварения, нарушениям микробного пейзажа кишечника, усилению деконъюгации желчных кислот и, наконец, к развитию структурных поражений двенадцатиперстной кишки, поджелудочной железы и других органов системы пищеварения. В то же время сохраняются нарушения в обмене холестерина, присущие желчнокаменной болезни. Расстройства, вызванные техническими погрешностями во время операции, встречаются значительно реже. У 30% перенесших холецистэктомию больных или сохраняются, или через некоторое время появляются абдоминальные боли и диспепсические расстройства, требующие лечения. Адекватная терапия больных зависит от правильного понимания патогенеза клинических симптомов, развивающихся после холецистэктомии. Известно, что и после удаления желчного пузыря сохраняется печеночно-клеточная дисхолия, т.е. литогенная желчь с низким холатохолестериновым коэффициентом. Выпадение физиологической роли желчного пузыря, а именно концентрация желчи в межпищеварительный период и выброс ее в двенадцатиперстную кишку во время еды, сопровождается нарушением пассажа желчи в кишечник и расстройством пищеварения. Изменение химического состава желчи и хаотическое ее поступление в двенадцатиперстную кишку нарушают переваривание и всасывание жира и других веществ липидной природы, уменьшают бактерицидность дуоденального содержимого, что приводит к избыточному бактериальному росту в двенадцатиперстной кишке, расстройству печеночно-кишечной циркуляции и снижению общего пула желчных кислот. Под влиянием микрофлоры в двенадцатиперстной кишке желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается развитием дуоденита, рефлюкс-гастрита, энтерита и колита. Дуоденит сопровождается дуоденальной дискинезией, и в первую очередь дуоденальной гипертензией с развитием дуодено-гастральных рефлюксов и забросом содержимого в общий желчный проток и проток поджелудочной железы. В результате формируются дискинезии сфинктера печеночно-поджелудочной ампулы, желчного и панкреатического протоков (сфинктера Одди), а деконъюгированные желчные кислоты обусловливают развитие диареи. Таким образом, у больных с удаленным желчным пузырем имеющиеся клинические проявления могут быть связаны с изменением химического состава желчи, нарушенным пассажем ее в двенадцатиперстную кишку, дискинезией сфинктера Одди, а также с избыточным бактериальным ростом в кишечнике, синдромами мальдигестии и мальабсорбции, дуоденитом и другими патологическими нарушениями в системе пищеварения. Кроме того, у ряда больных могут сохраняться или развиваться вновь органические препятствия для оттока желчи, связанные с проведенной холецистэктомией. Проблема современного лечения больных, перенесших холецистэктомию и имеющих симптомы постхолецистэктомического синдрома, остается окончательно не решенной и продолжает привлекать внимание широкого круга практических врачей и научной общественности во всем мире.
Применение растительных препаратов при заболеваниях желчевыводящих путей
В настоящее время привлекает всеобщее внимание феномен высокой чувствительности организма к самым разнообразным влияниям внешней среды, сила которых очень мала. Поэтому одной из важнейших научных проблем является изучение факторов малой интенсивности, объединенных по признаку малой силы влияния на организм, что делает их безопасными и весьма привлекательными для использования в лечебных и иных целях. Зачастую физиологические ответы организма и лечебные эффекты при хронических заболеваниях оказываются в некоторых случаях выше, чем при применении факторов высокой интенсивности (фармакологические средства, инфузионная терапия и т.д.), что указывает на принципиально иные механизмы реализации действия подобных влияний. Примерами эффективного воздействия факторов малой интенсивности являются гомеопатия, фитотерапия, акупунктура, употребление минеральной воды, действие биологически активных добавок как важных лечебных методик, используемых, прежде всего, для профилактики различных заболеваний и в период восстановительного лечения.
Актуальность применения лекарственных растений в медицине неизмеримо возросла в последние десятилетия, когда человечество вновь обратилось за помощью к природе. На протяжении тысячелетий растения были единственными лечебными средствами. Для современной семьи, сознательно ориентирующейся на природу, травы становятся просто частью жизни. Они употребляются во всех видах, с использованием разных способов приготовления и в любой ситуации: для профилактики, лечения и для получения удовольствия. Растительный мир – это огромная база природного лекарственного сырья. Фитотерапия сегодня все шире и прочнее внедряется в медицинскую практику. Это связано с тем, что сегодня, с одной стороны, много терапевтических неудач при применении многих синтетических лекарственных препаратов, а с другой стороны, препараты, приготовленные из лекарственных растений, малотоксичны, имеется возможность проведения длительной курсовой терапии без существенных побочных явлений. Успешное изучение современной европейской фармакологией многовекового опыта восточной медицины по использованию целебных растений позволило внедрить в медицинскую практику ряд высокоэффективных лекарственных средств, приготовленных по древневосточным рецептам. Время только подтвердило их эффективность. В Индонезии достаточно редко встречаются полные люди. Такой феномен объясняется главным образом тем, что в рацион питания населения этой страны издавна входят уникальные растительные компоненты, способствующие поддержанию идеального веса. Эти средства, созданные на основе многовекового опыта целителей Древнего Востока, тормозят усвоение жиров, активизируют их расщепление и выведение из организма, стимулируют обмен веществ.
Холит относится к биологически активным пищевым добавкам и рекомендован в качестве вспомогательного средства для комплексного лечения и профилактики билиарного сладжа, ЖКБ, заболеваний ЖВП, в том числе и ПХЭС.
Препарат состоит из следующих ингредиентов: папайя (дынное дерево) (Caricae folium), почечный чай (Orthossiphon stamineus), корень императы (Imperata cylindrica), филлантус нирури (Phyllanti herba), плоды перца кубебы (Piper cubeba), осот полевой (Sonchus arvensis), шелковочашечник курчавый (Strobilanthes crispa).
Почечный чай (Orthossiphon stamineus). Листья растения содержат горький гликозид ортосифонин, алкалоиды, тритерпеновые сапонины, жирное масло, дубильные вещества, органические кислоты, эфирное масло, бета-ситостерин, большое количество калийных солей. Оказывает спазмолитическое действие, усиливает желчеотделение, повышает секрецию желудочного сока. У пациентов с острыми и хроническими холециститами и ЖКБ способствует уменьшению слизи и числа лейкоцитов в желчи.
Императа цилиндрическая (Imperata cylindrica). Лекарственным сырьем являются корневища растения, содержащие стероиды, тритерпеноиды, арунтоин, сплиндрин, квернеол, изоарполинол, витамин К, калий, органические кислоты (уксусную, лимонную, яблочную). Применяется при воспалительных заболеваниях гепатобилиарной системы, холецистите, холангите, а также дискинезии ЖВП и хроническом гепатите.
Осот полевой (Sonchus arvensis). В листьях осота содержатся алкалоиды, аскорбиновая кислота, каротин. Осот обладает противовоспалительным, желчегонным и мочегонным действием. Каротин улучшает состояние нервной системы, которое так часто нарушается при заболеваниях ЖВП.
Филлантус нирури (Phyllanti herbа). Способствует растворению камней в желчном пузыре, обладает сильным антимикробным, спазмолитическим, гепатозащитным действием.
Папайя (дынное дерево) (Caricae folium). В качестве лекарственного сырья используют плоды и листья растения, содержащие папаин, важнейший из шести выделенных из сока папайи ферментов, а также зимопапаин А и В, лизоцим, гликозиды, сапонины, алкалоиды. Комплекс протеолитических ферментов – папаина и липазы – препятствует образованию желчных камней, способствует облегчению переваривания животной пищи, снижению пищеварительной нагрузки на печень и поджелудочную железу. Обладает также выраженным гепатопротекторным и антиоксидантным действием.
Стробилантес курчавый (шелковочашечник курчавый) (Strobilanthes crispa). Лекарственным сырьем являются листья растения, содержащие большое количество калия, кремниевую кислоту. Настой листьев растения применяется в качестве мочегонного средства.
Плоды перца кубебы (Piper cubeba). Лекарственным сырьем являются незрелые плоды растения, содержащие 10–18% эфирного масла, сесквитерпены, лигнан кубебин. Обладают выраженным антибактериальным и противовоспалительным эффектом.
В результате проведенных клинических исследований доказано принципиально положительное действие Холита на клиническое течение заболевания у пациентов с дискинезией желчевыводящих путей и хроническим холециститом, а также ПХЭС. В исследовании, проведенном В.А. Максимовым и соавт. (2010), показано, что применение Холита оказывает стимулирующее влияние на процессы желчеобразования и желчеотделения у больных с ПХЭС; нормализует моторную функцию билиарного тракта, в частности моторику сфинктеров; оказывает положительное влияние на снижение литогенных свойств желчи и улучшение ее коллоидной стабильности.
В ходе других научных исследований выявлено достоверное действие препарата на лизис камней в желчном пузыре у пациентов, принимавших Холит. Препарат не вызывает обострений заболеваний, хорошо переносится и может использоваться в течение длительных сроков без каких-либо осложнений в амбулаторных условиях у пациентов с БС, хроническим холециститом во время обострения заболевания, в подострый период и для профилактики обострений, у пациентов с ЖКБ с целью растворения в желчном пузыре конкрементов различных размеров и различного биохимического состава и у пациентов с ПХЭС для профилактики повторного камнеобразования и ликвидации клинической симптоматики ПХЭС. Выявлено, что время растворения и уменьшения размеров конкрементов желчного пузыря не зависит от биохимического состава камней, а длительность сроков лечения пропорциональна количеству и размерам камней. Доказано, что минимальные сроки уменьшения размеров составляют от 2 до 4 месяцев приема препарата в дозе 6 капсул в сутки. Препарат оказывает противовоспалительное действие и на мочевыделительную систему и может быть использован в комплексном лечении циститов, пиелонефритов различной этиологии в сочетании с заболеваниями желчевыводящих путей, а также панкреатитов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.