Клинический случай применения пембролизумаба у пациента с метастатическим поражением лимфатических узлов, головного мозга без выявленного первичного очага
- Аннотация
- Статья
- Ссылки
- English
Метастазы злокачественной опухоли без выявленного первичного очага (ВПО) – заболевание, проявляющееся метастатическим поражением органов без установленного первичного очага. По данным различных авторов, пациенты с метастазированием без ВПО составляют от 3 до 5% онкологических больных.
Лечение такой подгруппы пациентов строится на индивидуальной основе с учетом клинико-морфологических данных и требует наличия в команде профессиональной группы морфологов и молекулярных генетиков, так как от заключительных гистологического, иммуногиcтохимического и молекулярно-генетического исследований зависят выбор тактики лечения и правильное назначение лекарственной терапии.
PDL и MSS – разные биологические маркеры для разных гистологических подтипов солидных опухолей. Для опухолей без ВПО с наличием микросателлитной нестабильности (MSI-H) или дефицитом репарации ДНК (dMMR), независимо от органопринадлежности, FDA в 2017 г. выдало разрешение на назначение пембролизумаба. В 2020 г. добавлено новое показание для пациентов с солидными опухолями с высокой мутационной нагрузкой (TMB) – десять или более мутаций на мегабазу ДНК (на основании исследования II фазы KEYNOTE-158). Однако для опухолей без ВПО с высоким уровнем PD-L1-экспрессии таких показаний на сегодняшний день нет. Определение мутационной нагрузки в настоящий момент дорогостоящий и не всем доступный метод, определение PD-L1-экспрессии является рутинным методом иммуногистохимического исследования.
В связи с этим представляем клинический случай применения иммунотерапии у пациента без ВПО с высокой PD-L1-экспрессией из собственной практики.
Пациент, мужчина 42 лет, с августа 2021 г. отметил жалобы на дискомфорт в правом подреберье, в связи с чем проведено обследование по месту жительства.
17.09.2021 проведены эзофагогастродуоденоскопия (заключение: гастрит, Helicobacter pylori-положительный) и колоноскопия (данных за органическую патологию нет).
По данным компьютерной томографии (КТ) органов грудной клетки, брюшной полости и полости малого таза, выявлено массивное поражение забрюшинных лимфоузлов диаметром около 7 см.
08.10.2021 пациент был госпитализирован в ГКБ им. С.П. Боткина, где 14.10.2021 ему была выполнена лапароскопическая биопсия образования забрюшинного пространства.
Иммуногистохимическое (ИГХ) исследование показало иммунофенотип гистиоцитарной саркомы забрюшинного пространства.
Для определения дальнейшей тактики обследования и лечения пациент был направлен в Московскую городскую онкологическую больницу № 62 (МГОБ № 62).
Учитывая клиническую картину, заподозрена меланома, в связи с чем пациенту рекомендованы пересмотр гистологических препаратов и определение мутации в гене BRAF.
При пересмотре гистопрепаратов обнаружено, что в материале морфологическая картина не противоречит росту низкодифференцированной злокачественной опухоли.
С целью уточнения гистогенеза опухоли было выполнено иммуногистохимическое исследование:
- мелан А, HMB 45, S100 – отрицательно;
- пан-цитокератин: диффузная различной степени выраженности цитоплазматическая реакция в опухолевых клетках. Отмечается некоторая апикальность реакции, вероятно связанная с деформацией материала;
- кальретинин: в единичных клетках наблюдается слабая цитоплазматическая реакция;
- PAX5: опухолевые клетки негативны.
Дополнительно произведено исследование со следующими маркерами:
- TTF1, CDX2, GATA3: опухолевые клетки негативны;
- CD20, СК7, CDх2: опухолевые клетки негативны;
- PAX8: в небольшой части крайне слабая, еле заметная ядерная реакция;
- Ki67 – 70% Androgen rec: neg (0).
ПЦР: мутации BRAF не обнаружено.
Заключение: в материале морфологическая картина не противоречит росту низкодифференцированной злокачественной опухоли, с учетом экспрессии пан-цитокератина и отсутствия экспрессии транскрипционных факторов, более вероятно наличие недифференцированного плеоморфноклеточного рака.
Опухолевые маркеры АФП, ХГЧ, СА 19-9, СА 72-4, РЭА, S100, ПСА в норме.
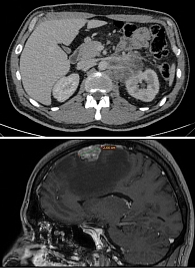
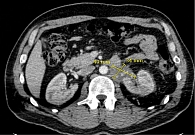
По данным КТ от ноября 2023 г., забрюшинно слева конгломерат 53 × 68 × 130 мм с инвазией левой почечной артерии и левого надпочечника (рис. 1).
01.12.2021 у пациента отмечено появление неврологической симптоматики.
02.12.2021 выполнена магнитно-резонансная (МР) томография головного мозга – МР-картина объемных образований головного мозга (в левой лобной доле 26 × 18 мм, с выраженным отеком, в левой теменной доле 5,5 × 6 мм).
Таким образом, пациенту установлен диагноз: С76.2, низкодифференцированный плеоморфноклеточный рак без выявленного первичного очага с поражением забрюшинных лимфоузлов, головного мозга cTхN0M1, IV стадия, II клиническая группа.
Учитывая гистологический тип опухоли и наличие болевого синдрома, принято решение о проведении пациенту химиотерапии по схеме «карбоплатин + паклитаксел». Первый курс проведен 03.12.2021.
06.12.2021 в НМИЦ нейрохирургии им. Н.Н. Бурденко выполнено оперативное лечение в объеме микрохирургического удаления метастаза левой лобной доли с применением нейрофизиологического мониторирования. ИГХ-исследование: метастаз низкодифференцированной карциномы (DESMIN, EMA, MELAN A HMB45 RCC CK19 CK20 CK5-6, PSA SYN TTF) – neg Vimentin, CK.
Пересмотр в МГОБ № 62: метастаз низкодифференцированного плеоморфноклеточного рака в головном мозге (материал аналогичен с первичной опухолью).
С декабря 2021 г. по январь 2022 г. проведены второй и третий курсы химиотерапии по прежней схеме.
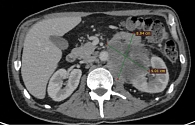
Посде трех курсов терапии у пациента, по данным КТ от января 2022 г., отмечен выраженный рост очагов (рис. 2).
Пациент переведен на вторую линию терапии (ифосфамид). Однако после первого курса терапии произошли нарастание болевого синдрома, соматическое ухудшение состояния ECOG3 за счет болевого синдрома.
Получены результаты геномного секвенирования: TMB 3,2647 m/Mb, клинически значимых мутаций в опухоли не найдено.
Одновременно с результатами секвенирования получен результат ИГХ-исследования из МГОБ № 62: опухоль MSS; мембранная экспрессия в опухолевых клетках (TS) 90%; СPS (combined positive score) 90.
Учитывая молодой возраст пациента, резистентность на фоне двух линий химиотерапии, высокую мембранную экспрессию в опухолевых клетках (CPS 90%), пациенту назначена иммунотерапия пембролизумабом.
На фоне двух введений пембролизумаба у пациента отмечено купирование болевого синдрома.
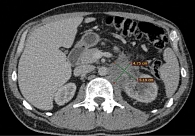
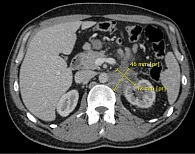
По данным КТ от мая 2022 г., обнаружена выраженная положительная динамика, которая нарастала при последующих исследованиях от июля 2022 г. и февраля 2023 г. (рис. 3–5).
Выводы
У пациента с низкодифференцированным раком без выявленного первичного очага, без драйверных мутаций и с высоким уровнем PD-L-экспрессии в третьей линии была предпринята попытка проведения иммунотерапии, при помощи которой удалось достичь частичного опухолевого ответа (Recist 1.1), сохраняющегося на протяжении 14 месяцев. Лечение переносит без нежелательных явлений, терапия продолжена. Таким образом, определение PD-L1-экспрессии может стать дополнительным диагностическим маркером для выбора терапии у пациентов с метастазами без выявленного первичного очага.
D.L. Stroyakovsky, PhD, A.N. Yurchenkov, A.S. Danilova, M.V. Volkonsky
City Oncological Hospital No. 62, Moscow
Contact person: Alexander N. Yurchenkov, dr.yurchenkov@gmail.com
Treatment of patients with metastases of a malignant tumor without an identified primary focus (HPV) occurs on an individual basis, taking into account clinical and morphological data. The correct prescription of drug therapy depends on the final histological, immunohistochemical and molecular genetic studies. The article presents a clinical case of the use of immunotherapy in a patient without HPV with high PD-L1 expression.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.