Иммунотерапия в комбинации с лучевой терапией при лечении пациентов с плоскоклеточным раком кожи
- Аннотация
- Статья
- Ссылки
- English
при местно-распространенных неоперабельных и/или метастатических формах ПКРК. В США в 2018 г. был одобрен первый препарат для лечения пациентов с местно-распространенной неоперабельной и/или метастатической формой ПКРК – цемиплимаб*. В 2020 г. был одобрен еще один анти-PD-1-препарат – пембролизумаб**, что позволило расширить возможности лекарственной терапии указанной категории больных. Несмотря на высокую частоту объективных ответов на фоне иммунотерапии анти-PD-1 в первой линии (около 50%), у ряда пациентов наблюдается стабилизация болезни либо прогрессирование процесса. Стабилизации болезни для большинства пациентов недостаточно с учетом особенностей клинических проявлений, характерных для ПКРК, что требует поиска новых алгоритмов лечения и использования иммунотерапии в комбинации с другими методами для улучшения непосредственных и отдаленных результатов.
* Не зарегистрирован в России.
** Не зарегистрирован в России по показанию ПКРК.
*** Не зарегистрирован в России и США по показанию ПКРК.
при местно-распространенных неоперабельных и/или метастатических формах ПКРК. В США в 2018 г. был одобрен первый препарат для лечения пациентов с местно-распространенной неоперабельной и/или метастатической формой ПКРК – цемиплимаб*. В 2020 г. был одобрен еще один анти-PD-1-препарат – пембролизумаб**, что позволило расширить возможности лекарственной терапии указанной категории больных. Несмотря на высокую частоту объективных ответов на фоне иммунотерапии анти-PD-1 в первой линии (около 50%), у ряда пациентов наблюдается стабилизация болезни либо прогрессирование процесса. Стабилизации болезни для большинства пациентов недостаточно с учетом особенностей клинических проявлений, характерных для ПКРК, что требует поиска новых алгоритмов лечения и использования иммунотерапии в комбинации с другими методами для улучшения непосредственных и отдаленных результатов.
* Не зарегистрирован в России.
** Не зарегистрирован в России по показанию ПКРК.
*** Не зарегистрирован в России и США по показанию ПКРК.

Введение
Плоскоклеточный рак кожи (ПКРК) – злокачественная опухоль кожи, возникающая из эпителиальных клеток (кератиноцитов) эпидермиса кожи и/или эпидермиса волосяных фолликулов. ПКРК по частоте встречаемости занимает второе место после базальноклеточного рака среди всех немеланомных опухолей кожи [1]. В Российской Федерации (как и во многих странах мира) ПКРК не учитывается отдельно от других немеланомных опухолей кожи, однако, по некоторым данным, на него приходится до 15–20% всех случаев немеланомных опухолей кожи. В связи с этим статистика приводится для всех немеланомных опухолей кожи (в целом код С44 по Международной классификации болезней 10-го пересмотра). Показатель заболеваемости зависит от региона проживания и существенно выше у людей со светлым фототипом кожи. Самые высокие показатели заболеваемости в мире наблюдаются в Австралии, где у каждого второго жителя до 70 лет развивается немеланомный рак кожи, самая низкая – в отдельных регионах Африки. В Российской Федерации в 2020 г. среди всех впервые выявленных злокачественных новообразований 10,9% составили немеланомные опухоли кожи. В 2020 г. в структуре заболеваемости на долю немеланомных опухолей кожи у мужчин пришлось 9%, у женщин – 12,5% [2].
С практической точки зрения плоскоклеточный рак рекомендуется классифицировать по риску рецидива (табл. 1 и 2). В этом случае учитывают локализацию опухоли (табл. 2), клинические и морфологические признаки (табл. 1) [3]. Группы локализаций в зависимости от риска рецидива представлены в табл. 2.
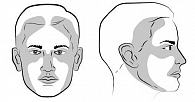
В подавляющем большинстве случаев пациентов с ПКРК удается излечить хирургическим методом. Когда опухоль располагается в зоне высокого риска (рис. 1), для лучшего контроля могут быть использованы другие хирургические подходы (например, микрохирургия по Мосу или более широкое удаление), которые иногда дополняются адъювантной лучевой терапией.
Примерно у 5% пациентов развиваются местно-распространенные и/или метастатические формы ПКРК. Такие пациенты являются плохими кандидатами для хирургического лечения или не являются ими вовсе.
У пациентов с местно-распространенным и/или метастатическим ПКРК, не поддающимся хирургическому вмешательству или лучевой терапии, применяется системная противоопухолевая терапия. Возможны следующие варианты системной терапии [4–7]:
- иммунотерапия ингибиторами контрольных точек (анти-PD-1, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), цемиплимаб, пембролизумаб);
- химиотерапия (с использованием фторпиримидинов, препаратов платины и антрациклинов);
- ингибиторы рецептора эпидермального фактора роста (EGFR) (цетуксимаб).
Развитие иммунотерапии стало прорывом в лечении местно-распространенного ПКРК. Механизмы чувствительности к иммунотерапии на сегодняшний день хорошо изучены. ПКРК входит в число опухолей с самой высокой мутационной нагрузкой (частотой соматических мутаций) [8]. Одним из первых клинических исследований по использованию иммунотерапии анти-PD-1 у больных местно-распространенным и/или метастатическим ПКРК стало исследование CARSKIN. В исследовании терапия первой линии пембролизумабом ассоциировалась с достижением объективного ответа на 15-й неделе у 55% пациентов с нерезектабельным ПКРК с позитивным PD-L1-статусом опухолевых клеток и 17% пациентов с негативным PD-L1-статусом [9].
С одобрением FDA и Европейским медицинским агентством по лекарственным средствам (EMA) анти-PD-1 цемиплимаба в 2018 г. и анти-PD-1 пембролизумаба FDA в 2020 г. иммунотерапия была признана стандартом лечения местно-распространенного и/или метастатического ПКРК, не поддающегося хирургическому вмешательству и лучевой терапии [10].
Цемиплимаб и пембролизумаб показали высокую эффективность при местно-распространенном и метастатическом ПКРК в исследованиях I/II фаз [11–13]. В расширенных когортах исследования фазы I ответ на цемиплимаб наблюдался у 13 (50%) из 26 пациентов (95% доверительный интервал (ДИ) 30–70). В когорте пациентов с метастатической формой ПКРК исследования фазы II ответ зафиксирован у 28 (47%) из 59 пациентов (95% ДИ 34–61). Медиана наблюдения составила 7,9 месяца в когорте больных метастатическим ПКРК. Среди 28 пациентов, ответивших на лечение, продолжительность ответа превысила шесть месяцев у 57%. У 82% ответ продолжал сохраняться, и они получали цемиплимаб на момент проведения данного анализа. Побочными явлениями, которые отмечались по крайней мере у 15% пациентов с метастатическим ПКРК, были диарея, усталость, тошнота, запор и сыпь. 7% пациентов прекратили лечение из-за нежелательных явлений [11]. В исследование не включались пациенты, перенесшие трансплантацию, пациенты с аутоиммунными заболеваниями, получавшие иммуносупрессивную терапию в любое время в течение предыдущих пяти лет, и пациенты с гематологическими злокачественными новообразованиями (например, хроническим лимфолейкозом). Таким образом, у пациентов с местно-распространенным и/или метастатическим ПКРК на фоне терапии цемиплимабом отмечался объективный ответ (полный или частичный) примерно в половине случаев. Профиль переносимости в целом был благоприятный. Имели место нежелательные явления, которые обычно возникают на фоне терапии ингибиторами иммунных контрольных точек.
В исследовании KEYNOTE-629 пембролизумаб также продемонстрировал клинически значимую и длительную противоопухолевую активность с управляемым профилем безопасности при местно-распространенном и/или метастатическом ПКРК [12]. В открытом нерандомизированном исследовании фазы II KEYNOTE-629, проведенном в 59 центрах, участвовали пациенты с местно-распространенным и/или метастатическим ПКРК. Они получали внутривенно пембролизумаб 200 мг каждые три недели в течение 35 циклов. Первичной конечной точкой была частота объективного ответа (ЧОО). Вторичные конечные точки включали длительность ответа, частоту контроля заболевания, выживаемость без прогрессирования, общую выживаемость, безопасность и переносимость. В настоящее время сообщается о результатах второго промежуточного анализа, включая исходные данные для местно-распространенной когорты и обновленные данные для рецидивирующей/метастатической когорты. Согласно обновленным результатам исследования, с ноября 2017 г. по сентябрь 2019 г. 159 пациентов (54 пациента с местно-распространенной формой ПКРК и 105 пациентов с рецидивирующим/метастатическим ПКРК) были включены в исследование и получили терапию пембролизумабом. Медиана времени от первого введения до анализа данных (29 июля 2020 г.) составила 14,9 месяца в когорте пациентов с местно-распространенным ПКРК (межквартильный размах 12,6–17,2 месяца) и 27,2 месяца в когорте пациентов с рецидивирующим/метастатическим ПКРК (межквартильный размах 25,6–29,2 месяца). В когорте пациентов с местно-распространенным ПКРК ЧОО достигла 50% (95% ДИ 36,1–63,9), включая 16,7% полных ответов и 33,3% частичных. В когорте пациентов с рецидивирующим/метастатическим ПКРК ЧОО составила 35,2% (95% ДИ 26,2–45,2%), включая 10,5% полных ответов и 24,8% частичных. Медиана длительности ответа не была достигнута ни в одной когорте. Нежелательные явления 3–5-й степени, связанные с лечением, зарегистрированы у 11,9% больных.
Ограничения исследования были связаны с его однорукавным характером и небольшим числом пациентов, получавших пембролизумаб в качестве терапии первой линии в когорте больных рецидивирующим/метастатическим ПКРК.
Таким образом, иммунотерапия с использованием анти-PD-1-препаратов позволяет добиться длительного контроля над заболеванием примерно у половины пациентов с неоперабельным ПКРК.
Больные, у которых отмечается первичная резистентность или прогрессирование заболевания на фоне терапии, нуждаются в новых терапевтических подходах. Применяемая в настоящее время химиотерапия в большинстве случаев при относительно высокой ЧОО сопряжена с токсичностью и низкой длительностью ответов. Согласно данным нерандомизированных исследований, системная химиотерапия способна обеспечить частичный ответ примерно в 34–44% случаев, когда средняя выживаемость без прогрессирования достигает примерно пять месяцев, общая выживаемость – около 11 месяцев [4, 14]. Для решения этой проблемы требуется внедрение в клиническую практику препаратов c иным механизмом действия или разработка комбинированных методов лечения, позволяющих преодолеть резистентность к монотерапии анти-PD-1 в тех случаях, когда это необходимо.
В качестве возможной стратегии лечения ПКРК рассматривается комбинация иммунотерапии и лучевой терапии. В ряде работ показано, что радиационное повреждение опухолевых и нормальных тканей в поле облучения может запускать активацию иммунной системы через хорошо известные сигнальные каскады повреждения, иммуногенную гибель клеток. Полученные в исследованиях данные внесли изменения в парадигму использования лучевой терапии. Доклинические и клинические исследования выявили сложное взаимодействие между лучевой терапией, облученными клетками, тканями и иммунной системой [15–17].
Синергический эффект лучевой терапии и ингибиторов контрольных точек при ПКРК продемонстрирован в однокогортном интервенционном исследовании UNSCARRed, в котором применяли авелумаб и радикальную лучевую терапию. Полученные данные не позволяют достоверно судить об эффективности терапии ввиду небольшого числа пациентов. Однако интерес представляют собственно подход и профиль безопасности комбинированной терапии. В исследовании не зарегистрировано увеличения частоты нежелательных явлений 3–4-й степени по сравнению с одномодальным подходом [18].
Клинический случай
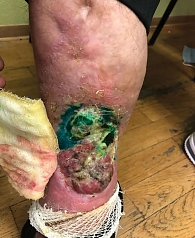
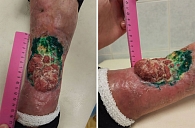
У пациента М., 71 год, диагностирован местно-распространенный ПКРК правой голени, развившийся на фоне хронического воспаления после аварии, с врастанием в большеберцовую кость. Со слов пациента, с 1975 г. он получал лечение по поводу посттравматического хронического остеомиелита правой голени. В январе 2021 г. стал отмечать появление язвенного дефекта кожи на передней поверхности правой голени. При обращении к онкологу по месту жительства выполнена биопсия опухоли. Данные патологоанатомического исследования: плоскоклеточный ороговевающий рак. Пациент обратился за консультацией в Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина. При осмотре размер опухоли 10,5 × 7 см с распадом и кровотечением из отдельных ее участков. Важно, что у пациента в анамнезе имели место острые нарушения мозгового кровообращения в 2013 и 2015 гг., острый инфаркт миокарда в 2007 и 2018 гг. Сопутствующие заболевания – приобретенный порок сердца, аортальный стеноз, митральная недостаточность 2–3-й степени. Фракция выброса левого желудочка (по Симпону), по данным эхокардиографии, при обращении 40% (2–3-я степень по CTC v. 5.0). На рисунке 2 представлена визуальная картина опухоли до лечения.
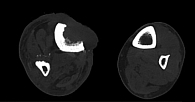
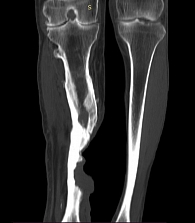
Данные компьютерной томографии (КТ) от 31 августа 2021 г.: КТ-картина в большей степени соответствует опухоли кожи правой голени с врастанием в большеберцовую кость (рис. 3 и 4). Деформация и изменение структуры костей правой голени не противоречат последствиям остеомиелита. По итогам проведения врачебной комиссии было принято решение о назначении иммунотерапии анти-PD-1-моноклональным антителом ниволумабом 480 мг внутривенно капельно один раз в 28 дней. После двух введений ниволумаба проведен контроль в динамике.
КТ правой нижней конечности от 8 декабря 2020 г.: визуализируется грубый эксцентрический дефект большеберцовой кости справа 40 × 20 × 28 мм, в образованный дефект костной ткани пролабируют мягкие ткани голени.
17 декабря 2021 г. пациент обратил внимание специалистов на опухолевидное образование в области правой голени с явлениями распада мягких тканей, эпизодами кровотечения, зловонный запах, болевой синдром (рис. 5). Выполнено четвертое введение ниволумаба.
На консилиуме врачей после анализа потенциального синергизма иммунотерапии и лучевой терапии было принято решение о назначении лучевой терапии совместно с иммунотерапией. Рекомендовано проведение паллиативной лучевой терапии на зону поражения правой голени в режиме гипофракционирования – разовая очаговая доза 8 Гр, суммарная очаговая доза 24–32 Гр (лечение один раз в неделю). Решено продолжить иммунотерапию ниволумабом.
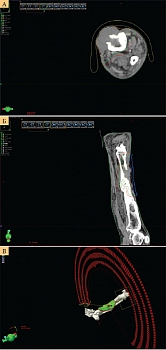
С 29 декабря 2021 г. по 19 января 2022 г. проведен курс лучевой терапии под контролем визуализации на линейном ускорителе электронов Vаrian Halcyon с применением трехмерного планирования, многолепесткового коллиматора, фотонным пучком с энергией 6 МэВ с использованием фиксирующих приспособлений и тканеэквивалентного болюса с помощью технологии VMAT. Пациент перенес лечение удовлетворительно, лучевые реакции в конце курса лучевой терапии не зарегистрированы. К концу курса лечения кровоточивость тканей опухоли практически не отмечалась, болевой синдром уменьшился.
На рисунке 6 представлен лечебный план лучевой терапии (дозовое распределение).
Иммунотерапию ниволумабом пациент переносил удовлетворительно, нежелательных явлений не зарегистрировано.
Результаты контрольного обследования (позитронно-эмиссионная томография, совмещенная с компьютерной томографией, с 18-фтордезоксиглюкозой с внутривенным контрастированием) от 17 марта 2022 г. показали увеличение накопления радиофармпрепарата в лимфатических узлах паховой области, которое, по данным дополнительного ультразвукового исследования, не расценивалось как метастатическое. Возможно, оно связано с проводимой иммунотерапией.
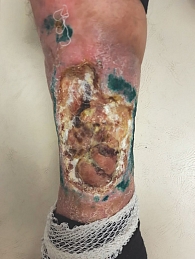
При очередном осмотре – опухоль меньшего размера, не кровоточит, зловонный запах отсутствует (рис. 7).
По состоянию на апрель 2022 г. пациент продолжал получать иммунотерапию анти-PD-1 без признаков прогрессирования заболевания.
Заключение
Несмотря на отработанный алгоритм лечения локализованных форм ПКРК, поиск оптимального режима терапии для пациентов с местно-распространенной и метастатической формами остается актуальным. Калечащие операции, как правило резко ухудшающие качество жизни, отсутствие продолжительного ответа и токсичность химиотерапии приводят к неудовлетворительным результатам лечения в целом.
Развитие иммунотерапии вывело на новый уровень лечение пациентов с местно-распространенным или метастатическим ПКРК. В половине случаев удается достигать объективного ответа (полного или частичного), который сохраняется длительное время. Лечение характеризуется удовлетворительной переносимостью (нежелательные явления 3–5-й степени регистрируются в среднем у 11% пациентов). Переносимость служит важным критерием при выборе терапии, поскольку пациенты с ПКРК в большинстве своем лица пожилого возраста с сопутствующей патологией.
В представленном клиническом случае пациент имел достаточно выраженное коморбидное состояние. Иммунотерапия не усугубила течение сопутствующей патологии. Контроль над болезнью обеспечила комбинация иммунотерапии анти-PD-1 и лучевой терапии.
Вопрос эффективности данных комбинированных подходов остается дискуссионным, но в некоторых ситуациях отмечается очевидная клиническая польза.
D.A. Kravchuk, O.P. Trofimova, PhD, Prof., K.Yu. Ivanilov, V.V. Nazarova, PhD, K.V. Orlova, PhD, L.V. Demidov, PhD, Prof.
N.I. Pirogov Russian National Research Medical University
N.N. Blokhin National Medical Research Centre of Oncology
Russian Medical Academy of Continuous Professional Education
Contact person: Darya A. Kravchuk, kravchuchek@yandex.ru
Squamous cell skin cancer (SCC) is the second most common malignant neoplasm. The incidence of SCC continues to grow. As a rule, the tumor is characterized by a benign clinical course and is cured surgically, but in some cases, the development of locally common (and/or metastatic) forms is observed. For a long period of time, there were no methods of drug therapy of patients with such forms of SCC that would lead not only to a local effect, but also to an increase in life expectancy. In most cases, SCC is characterized by a high mutational load, the presence of PD-L1 expression, which potentially suggests a possible sensitivity of the tumor to immunotherapy. This knowledge contributed to the conduct of clinical studies of anti-PD-1 immunotherapy in locally common inoperable and/or metastatic forms of SCC. In the USA, in 2018, the first drug for the treatment of patients with locally advanced inoperable and/or metastatic form of SCC, cemiplimab, was approved for the first time. In 2020 another anti-PD-1 drug, pembrolizumab, was approved, which allowed expanding the possibilities of drug therapy for this category of patients. Despite the high frequency of objective responses against the background of anti-PD-1 immunotherapy in the first line (about 50%), a number of patients have stabilization of the disease or progression of the process. Stabilization of the disease is not enough for most patients, taking into account the peculiarities of clinical manifestations characteristic of SCC, which requires the search for new approaches and the use of immunotherapy with other treatment options to improve immediate and long-term results.
The article presents a clinical case of a patient with locally advanced right shin SCC who received anti-PD-1 immunotherapy (nivolumab) in combination with radiation therapy as part of first-line therapy. On the background of such therapy, it was possible to achieve some success.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.