Комбинация таргетной и иммунотерапии в первой линии метастатического светлоклеточного рака почки. Клинический случай
- Аннотация
- Статья
- Ссылки
- English


Рак паренхимы почки (почечно-клеточный рак, ПКР) – группа злокачественных новообразований почки, развивающихся из эпителия проксимальных канальцев или собирательных трубочек [1].
В 2020 г. в России зарегистрировано 19 955 новых случаев ПКР, в 20,8% случаев диагностирован генерализованный опухолевый процесс. Летальность в течение года после постановки на учет составила 14,1%, при этом отмечается постепенное снижение показателя летальности за последние пять лет [2], что связано не только с ранней диагностикой, но и изменением подходов к лекарственному противоопухолевому лечению.
Первым препаратом для иммунотерапии ПКР в 1985 г. стал интерлейкин 2, его действие направлено на стимуляцию Т-лимфоцитов для распознавания и уничтожения опухолевых клеток [3]. Частота объективного ответа (ЧОО) на терапию интерлейкином 2 составляет от 2 до 27% [3, 4]. Но из-за высокой частоты нежелательных явлений (гипотензия; токсическое повреждение почек, сердца, желудочно-кишечного тракта, печени; синдром капиллярной утечки и т.д.) и низкой эффективности монотерапия интерферонами не рекомендуется в первой линии лечения метастатического ПКР (мПКР).
Ингибиторы тирозинкиназ (TKI) изменили прогноз мПКР, так как вызывали существенный уровень ответа и улучшали показатели выживаемости [5]. Но у большинства пациентов в конечном итоге развивались лекарственная устойчивость и прогрессирование заболевания во время терапии [6–8].
Основой для разработки новых иммунотерапевтических препаратов послужили результаты исследований, показавшие, что опухолевые клетки используют механизмы для «ускользания» от иммунологического надзора, которые блокируют рецепторы Т-клеток – так называемые контрольные точки иммунитета [9]. Наиболее изученными из них являются CTLA-4 (cytotoxic T-lymphocyte associated protein 4 – CD152) [10] и PD-1 (рrogrammed cell death pathway 1) [11].
Преимущество в лечении показали комбинированные режимы применения иммуноонкологических препаратов с ингибиторами тирозинкиназ. Комбинация ингибитора PD-L1 пембролизумаба с ингибитором тирозинкиназ акситинибом в первой линии терапии у пациентов с мПКР по сравнению со стандартной терапией сунитинибом показала свое преимущество в ходе многоцентрового рандомизированного клинического исследования III фазы KEYNOTE-426 [12]. Комбинированный режим продемонстрировал снижение риска смерти на 47%, увеличение общей выживаемости (ОВ) и снижение риска прогрессирования заболевания на 31%. На основании этого исследования комбинация пембролизумаба с акситинибом одобрена в первой линии терапии мПКР.
Клинический случай
Пациент Б., 59 лет, обратился в Областной онкологический диспансер г. Иркутска в декабре 2020 г.
Активно жалоб не предъявлял. Состояние удовлетворительное, по шкале ECOG 1 балл, по шкале Карновского > 80%. При прохождении профосмотра по месту жительства на цифровой флюорограмме выявлены множественные очаговые тени в легких, проведено дообследование, по данным мультиспиральной компьютерной томографии (МСКТ) выявлена опухоль правой почки.
Курил в течение 20 лет по полпачки в сутки. Индекс курения – 10. Наследственность онкологическими заболеваниями не отягощена. Сопутствующая патология: гипертоническая болезнь 3-й степени в течение 12 лет, контролируемая, целевой уровень артериального давления (АД) менее 130/80 мм рт. ст., риск 4 (дислипидемия, гипертрофия левого желудочка, индекс курения – 10), хроническая сердечная недостаточность 0 с нормальной фракцией выброса 66%. Ожирение 1-й степени, абдоминально-конституциональное (индекс массы тела 30,7 кг/м2).
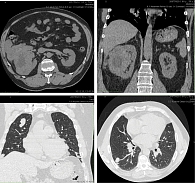
На основании данных проведенного комплексного обследования диагностирована опухоль правой почки 134 × 97 × 131 мм, интимно прилежащая к селезеночному углу толстой кишки и нижнему краю печени (по шкале RENAL 10 баллов, по шкале PADUA 8 баллов). Мезентериальные лимфатические узлы от 5 до 15 мм. В левой почке очаг 20 мм, расценен как метастаз. Множественное метастатическое поражение обоих легких от 3 до 21 мм. Очаговой патологии по данным МСКТ не выявлено. Выполнена тонкоигольная аспирационная биопсия опухоли почки под ультразвуковым наведением. Цитологическое заключение: при просмотре пунктата образования правой почки в двух стеклах из восьми найдены клетки светлоклеточного почечно-клеточного рака.
Согласно прогностической классификации International Metastatic Renal Cancer Database Consortium (IMDC) D. Heng (2010) (табл. 1), три фактора риска – плохой прогноз.
На основании жалоб, объективного осмотра, данных инструментальных и лабораторных методов исследований установлен диагноз: рак правой почки (cветлоклеточная карцинома) Т3аN0M1G3 4-й стадии, 4-я клиническая группа. Метастатическое поражение левой почки, легких.
Первым этапом лечения выполнена операция 21.01.2021: радикальная нефрэктомия справа с расширенной забрюшинной лимфаденэктомией, правосторонняя гемиколэктомия. При ревизии обнаружена опухоль в правой почке размерами до 150 мм, прорастающая насквозь брыжейку восходящей ободочной кишки, с ростом в стенку кишки, интимно прилегающая к правой доле печени. Вся поверхность почки окружена патологической венозной сетью, выраженная кровоточивость при отделении печени от опухоли. Выполнен доступ в сальниковую сумку, медиальным доступом мобилизована правая половина толстой кишки, в устье перевязаны и пересечены подвздошно-ободочно-кишечные сосуды, регионарный лимфатический коллектор забран в препарат. Пересечены правая ветвь средней ободочно-кишечной артерии, правые ободочно-кишечные сосуды. Кишка пересечена дистально на уровне средней трети поперечно-ободочной кишки, проксимально в 150 мм от илеоцекального перехода. Культи кишечной трубки ушиты аппаратным швом, дополнительно укрыты кисетными швами. Правая почка с опухолью, надпочечником, жировой капсулой, фиксированной к ней кишкой мобилизованы краниально. Перевязан и пересечен правый мочеточник. Выделены почечные сосуды, раздельно лигированы и пересечены артерия и вены. Препарат удален единым блоком.
Макропрепарат: правая почка с паранефральной клетчаткой и надпочечником покрыты фасцией Героты общими размерами 210 × 160 × 150 мм, подпаяна петля ободочной кишки с брыжейкой. При рассечении жировой капсулы обнаружена гематома объемом до 50 мл. Почка размерами 140 × 110 × 100 мм, с крупнобугристой поверхностью. На разрезе опухоль занимает всю среднюю треть с вовлечением нижнего полюса, клетчатки почечного синуса. Опухоль состоит из множественных узлов мягко-эластической консистенции, охряно-желтого цвета с кровоизлияниями и некрозами. Визуально опухоль врастает в чашечно-лоханочную систему. С наружной поверхности фасции Героты – крупные опухолевые узлы, расположенные на площади 90 × 75 мм, и отдельно от них лежащий экзофитный опухолевый узел размерами 85 × 60 × 40 мм, с геморрагическим пропитыванием. К опухолевым узлам подпаяна петля ободочной кишки с брыжейкой.
Микроскопически опухоль имеет строение светлоклеточной почечно-клеточной карциномы Grade 3 (М8310/3) с инвазией в сегментарный венозный сосуд, почечную лоханку, с множественными опухолевыми эмболами в венулах и новообразованных опухолевых сосудах, с кровоизлияниями и обширными некрозами. Опухоль прорастает капсулу почки, врастает в паранефральную клетчатку, не прорастая ее насквозь. Узлы на поверхности фасции Героты имеют строение метастатической карциномы, опухоль врастает в брыжейку ободочной кишки, стенка кишки интактна. Регионарных лимфоузлов не обнаружено. В клетчатке брыжейки три лимфоузла, роста опухоли в них не обнаружено. В крае резекции мочеточника роста опухоли не обнаружено. Надпочечник нормального гистологического строения (рис. 1).
Назначена противоопухолевая лекарственная терапия первой линии, учитывая плохой прогноз согласно критериям IMDC, по схеме: пембролизумаб 200 мг в первый день + акситиниб 10 мг ежедневно; цикл 21 день.
Сопутствующая антигипертензивная терапия: индапамид 2,5 мг один раз в сутки, бисопролол 5 мг один раз в сутки, амлодипин 10 мг один раз в день, рамиприл 10 мг один раз в день, аторвастатин 20 мг один раз в день.
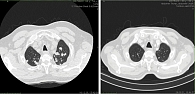
На фоне лечения достигнут частичный ответ (табл. 2). По данным МСКТ после четвертого курса (рис. 2) за счет уменьшения размеров множественных образований в паренхиме легких с максимальных 48 мм до 9 мм. В плевральных полостях содержимое не определяется. Отмечается уменьшение размеров медиастинальных и бронхопульмональных с обеих сторон лимфатических узлов с 16 × 27 до 14 × 19 мм. Почка слева расположена обычно, бобовидной формы. Паренхима не утолщена, в нижней трети субкапсулярно сохраняется образование округлой формы с четкими контурами, с уменьшением размеров до 5 мм (ранее до 16 мм в диаметре) плотностью до 25 ед. Хаунсфилда, после внутривенного усиления без признаков накопления контрастного вещества. Функция почки сохранена.
Пациент получает терапию в течение двух лет, выполнено 30 введений пембролизумаба 200 мг, ежедневно принимает акситиниб 10 мг в сутки.
За время наблюдения были отмечены нежелательные явления – учащение стула до 4–6 раз в день на 10-е сутки приема акситиниба после первого введения пембролизумаба на протяжении четырех дней. Пациенту проведена терапия: лоперамид 4 мг в сутки, нифуроксазид 400 мг в сутки.
Диарея полностью купирована, в дальнейшем для профилактики назначена терапия пробиотиками. Пациентом проводится ежедневный самоконтроль уровня АД и частоты сердечных сокращений (ЧСС), ведение дневника, за время наблюдения существенных изменений уровня АД и ЧСС, требующих коррекции дозы акситиниба, не наблюдалось. Планируется продолжение терапии до 35 циклов.
Обсуждение
Рак почки – гетерогенная группа злокачественных опухолей. Выделяются четыре основных гистологических типа ПКР, имеющих свои молекулярно-генетические особенности, определяющие потенциал злокачественности, характер метастазирования, клиническое течение заболевания и чувствительность к лекарственному лечению:
- светлоклеточный (60–85%);
- хромофильный (папиллярный) (7–14%);
- хромофобный (4–10%);
- рак собирательных протоков (1–2%).
Самым распространенным является светлоклеточный рак, который характеризуется мутацией гена VHL [13]. Основная функция гена VHL – регуляция некоторых внутриклеточных белков, включая индуцируемый гипоксией фактор (HIF) 1α и 2α [15]. Эти внутриклеточные белки в процессе транскрипции связываются с ДНК, запускают активацию проонкогенов, включая гены, участвующие в ангиогенезе [14].
Акситиниб представляет собой пероральный низкомолекулярный TKI, характеризующийся мощным аденозинтрифосфатным конкурентным ингибированием рецептора фактора роста эндотелия сосудов (VEGFR) 1-го, 2-го и 3-го типов, а также рецептора тромбоцитарного фактора роста β (PDGFR-β) [15].
Исследование III фазы, в котором сравнивались акситиниб и сорафениб в лечении распространенного светлоклеточного ПКР у пациентов, ранее не получавших лечения, не показало значимых различий [16]. Медиана выживаемости без прогрессирования (ВБП) в группе акситиниба составила 10,1 месяца (95% доверительный интервал (ДИ) 7,2–12,1) и 6,5 месяца (95% ДИ 4,7–8,3) в группе сорафениба, отношение рисков (ОР) после стратификации – 0,77 (95% ДИ 0,56–1,05). ЧОО в группе акситиниба (32%) была статистически значимо выше соответствующего показателя в группе сорафениба (15%), при этом ОР составило 2,21 (95% ДИ 1,31–3,75; p = 0,0006). Нежелательные явления на фоне терапии акситинибом (диарея, артериальная гипертензия, снижение массы тела, утомляемость, снижение аппетита, ладонно-подошвенный синдром, дисфония, астения, гипотиреоз и тошнота) являются контролируемыми и обратимыми. В исследовании монотерапии акситинибом была подтверждена его клиническая эффективность при распространенной почечно-клеточной карциноме [16].
Индуцируемый гипоксией фактор HIF-1α является одним из основных регуляторов PD-L1: гипоксия резко увеличивает экспрессию PD-L1 в клетках иммунной системы и опухолях [17]. Этот путь регуляции особенно значим для ПКР, связанного с изменением экспрессии гена, что свидетельствует о возможности сочетания анти-PD-1/анти-PD-L1-терапии с анти-VEGF-терапией [18, 19], а также с препаратами, направленными на подавление другого ингибитора контрольных точек иммунитета – CTLA-4 [19].
Пембролизумаб – высокоселективное гуманизированное моноклональное антитело, относящееся к изотипу IgG4/каппа, блокирующее взаимодействие между PD-1 и его лигандами PD-L1 и PD-L2, в результате происходят прайминг опухолевого антигена Т-лимфоцитам, активация иммунного ответа и регресс опухоли [11].
В отличие от химиотерапии оценка эффективности иммунотерапевтических препаратов, которые не обладают прямым противоопухолевым действием, но восстанавливают реактивность собственной иммунной системы организма, проводится по irRC (immune related Response Criteria, иммуноопосредованные критерии ответа) [20]:
- уменьшение размеров существующих очагов без возникновения новых;
- длительная стабилизация размеров опухоли с последующим их уменьшением;
- уменьшение размеров опухоли после первоначального их увеличения;
- уменьшение размеров некоторых очагов опухоли при появлении новых.
На иммунную среду в опухоли путем прямого воздействия на иммунные клетки или косвенного воздействия на эндотелий могут влиять проангиогенные факторы [21]. VEGF препятствует дифференцировке моноцитов в зрелые дендритные клетки, а клеток-предшественников – в CD8+- и CD4+-Т-лимфоциты [23]. VEGF повышает экспрессию PD-L1 на дендритных клетках, активирует экспрессию PD-1 и CTLA4 на клетках иммунной системы. VEGF также повышает уровень регуляторных Т-клеток, поддерживая иммуносупрессию [22]. Проангиогенные молекулы также приводят к образованию аберрантных опухолевых сосудов, которые могут способствовать нарушению инфильтрации иммунных клеток, плохой перфузии и гипоксии [14, 17, 22]. Таким образом, изменения в гене VHL облегчают онкогенный процесс благодаря иммуносупрессивному эффекту, потенциально влияя одновременно на праймирование, перенос и проникновение Т-клеток [14, 17, 22].
Антиангиогенные препараты могут восстанавливать дифференцировку дендритных клеток, снижать уровень миелоидных клеток-супрессоров и уровни регуляторных Т-клеток [14, 22]. Антиангиогенные препараты также могут приводить к нормализации сосудистой сети опухоли и уменьшению гипоксии, что оказывает глубокое положительное влияние на инфильтрацию иммунных клеток в опухоли [14, 22]. Следовательно, комбинация ингибиторов контрольных точек иммунного ответа совместно с ингибиторами тирозинкиназ может продемонстрировать синергизм и потенцировать ответ опухоли на терапию [22, 23].
В многоцентровом рандомизированном исследовании III фазы KEYNOTE-426 проведено сравнение эффективности и безопасности комбинации «пембролизумаб + акситиниб» (n = 432) с сунитинибом (n = 429) при мПКР у ранее не леченных пациентов. Конечные точки исследования – ВБП и ОВ. Из 822 пациентов, у которых оценивали статус экспрессии PD-L1 с использованием антитела 22C3 иммуногистохимического анализа, 60,5% имели комбинированный показатель позитивности – CPS ≥ 1 (рассчитанный как отношение опухолевых клеток, лимфоцитов и макрофагов с экспрессией PD-L1 к общему количеству опухолевых клеток). Медиана наблюдения составила 42,8 месяца (диапазон 35,6–50,6). Медиана ОВ составила 45,7 месяца в группе комбинации в сравнении с 40,1 месяца в группе сунитиниба при статистически значимом преимуществе (ОР 0,73; 95% ДИ 0,60–0,88; p < 0,001). В общей когорте пациентов четырехгодичная ОВ составила 57,5% при использовании комбинации «пембролизумаб + акситиниб» и 48,5% при терапии сунитинибом. Четырехгодичная ВБП – 15,7 и 11,1% соответственно (ОР 0,68). Оцененная при минимальном времени наблюдения 35,6 месяца ЧОО увеличилась. Ответы на комбинированное лечение имели 60,4% больных, на терапию сунитинибом – 39,6%. Полный ответ в группе комбинации достигнут у 10,0% больных. У пациентов с благоприятным прогнозом согласно IMDC четырехгодичная ОВ, двухгодичная ВБП и частота ответов в группе комбинации и группе сунитиниба составили 72,3 и 73,0%, 20,7 и 17,8%, 68,8 и 50,4% соответственно. Частота полных ответов в группе благоприятного прогноза была 11,6 и 6,1%. У пациентов с промежуточным и неблагоприятным прогнозом четырехгодичная ОВ, четырехгодичная ВБП и частота ответов в группе комбинации и группе сунитиниба составили 50,6 и 37,6%, 13,8 и 8,2%, 56,5 и 34,3%, а частота полных ответов – 9,2 и 2,3% соответственно. Профиль нежелательных явлений оказался ожидаемым и соответствовал ранее наблюдаемому при применении пембролизумаба и акситиниба [12]. Токсичность ≥ 3-й степени в группах практически не изменилась по сравнению с показанной при первичном анализе (67,8 против 63,8%).
Таким образом, проведенный анализ с минимальным наблюдением 35,6 месяца подтвердил полученные ранее данные, а также показал, что комбинация «пембролизумаб + акситиниб» при увеличении времени наблюдения продолжает демонстрировать эффективность и управляемый профиль токсичности [24–26].
Выводы
Противоопухолевая лекарственная терапия мПКР претерпела изменения за последние несколько лет. В первой линии терапии рекомендуется применять максимально эффективное, патогенетически обусловленное лечение, включающее ингибиторы контрольных точек иммунитета и ингибиторы тирозинкиназных рецепторов. Современный «золотой стандарт» первой линии терапии – комбинация «пембролизумаб + акситиниб» позволяет достоверно увеличить показатели ОВ и ВБП, увеличить ЧОО вплоть до полной регрессии опухолевого процесса. При этом безопасность терапии остается на высоком уровне, профиль нежелательных явлений предсказуем и управляем. Продолжительность жизни и ее качество у пациентов с исходно неблагоприятным прогнозом увеличиваются.
В настоящее время в клинических исследованиях продолжается изучение возможности повышения эффективности противоопухолевой терапии путем применения различных комбинаций иммунотерапевтических препаратов с другими методами лечения, включая химиотерапию, таргетную и лучевую терапию. Предварительные результаты являются многообещающими и свидетельствуют о преимуществе комбинированного лечения перед монотерапией.
S.S. Sidorova, D.Yu. Yukalchuk, D.M. Ponomarenko, S.P. Sidorov, I.I. Kazakova, E.S. Tyumentseva
Irkutsk Regional Oncological Dispensary
Contact person: Svetlana S. Sidorova, s_koninina@mail.ru
One of the most common malignant neoplasms of the urinary system is cancer of the kidney parenchyma – renal cell carcinoma (RCC). Every year, about 20 thousand new cases of kidney cancer are recorded in Russia, of which 20% are patients with metastatic RCC, whose main treatment method is antitumor drug therapy. The appearance of checkpoint inhibitors has changed the perception of the possibilities of therapy for metastatic RCC (mPCR). The use of combinations of immuno-oncological drugs with multikinase inhibitors allowed to increase the overall survival(s) and progression-free survival (IBD) in patients with intermediate or high risk mPCR. The article demonstrates a clinical case of successful use of a combination of pembrolizumab and axitinib in a patient with metastatic clear cell kidney cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.