Комбинированная антитромботическая терапия у больных мерцательной аритмией, подвергаемых чрескожным коронарным вмешательствам: опыт длительного проспективного наблюдения
- Аннотация
- Статья
- Ссылки
![Таблица. Расчет риска геморрагических осложнений у больного, принимающего АВК, на основании шкалы HEMORR2HAGES и Outpatient Bleeding Risk Index [24–25]](/upload/resize_cache/iblock/a03/195_350_1/plagril2.jpg)
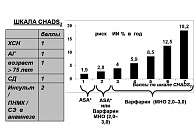
В настоящее время системой, определяющей выбор антитромботического препарата, является шкала CHADS2. Низким риском тромбоэмболических осложнений обладают пациенты, имеющие 0–1 балл по шкале CHADS2. Таким больным показана терапия аспирином. Больные, имеющие 1 балл по шкале CHADS2, в качестве альтернативы могут использовать Варфарин или аспирин. Больные с риском, превышающим 1 балл согласно данной системы оценки риска, имеют абсолютные показания к терапии Варфарином (рис. 1).
Развитие МА у больных неразрывно связано с другими сердечно-сосудистыми заболеваниями, такими как артериальная гипертония и ишемическая болезнь сердца (ИБС), пороки сердца. Количество больных МА, имеющих сопутствующую ИБС, составляет около 20–30%. Проведение чрескожных коронарных вмешательств (ЧКВ) с имплантацией стентов, как в плановом порядке, так и в связи с развитием острого коронарного синдрома (ОКС), в настоящее время является широко распространенным. После проведения ЧКВ больным в соответствии с существующими рекомендациями показана длительная двухкомпонентная антитромбоцитарная терапия аспирином и клопидогрелем [8]. Известно, что преждевременное прекращение приема тиенопиридинов сопряжено с 10-кратным увеличением риска тромбоза стента.
Около 5% всех больных, подвергаемых ЧКВ, нуждаются в терапии Варфарином в связи с наличием МА. Очевидно, что тройная антитромботическая терапия повышает риск кровотечений. Какова же тактика в таких случаях?
Во-первых, необходимо помнить, что отмена Варфарина и назначение терапии аспирином или комбинации аспирина и клопидогреля для больных МА с высоким риском тромбоэмболических осложнений не является адекватной заменой. Тромб в ушке или полости левого предсердия, являющийся причиной кардиоэмболических инсультов у больных МА, по структуре близок к венозному тромбу и ассоциирован с высокой тромбинемией. Именно этими факторами, вероятнее всего, объясняется значительно меньшая по сравнению с Варфарином эффективность монотерапии аспирином и комбинированной антитромбоцитарной терапии у больных МА. По результатам, объединившим исследования AFASAK, SPAF, EAFT, эффективность аспирина в предотвращении ИИ у больных МА не превышает 21% [9–12]. Исследование ACTIVE-W [13], в рамках которого проводилось сравнение комбинации клопидогрель ≥ аспирин и Варфарина в отношении развития сердечно-сосудистых осложнений у больных МА, было прекращено досрочно в сентябре 2005 г., из-за явного преимущества Варфарина перед комбинацией двух антиагрегантов при одинаковом риске геморрагических осложнений.
В то же время, продолжение лечения Варфарином как в монотерапии, так и в сочетании с аспирином не предотвращает тромбоза стента. Таким образом, теоретически является логичным назначение так называемой трехкомпонентной терапии, включающей в себя Варфарин, аспирин и клопидогрель, что многократно увеличивает риск кровотечений [14].
Общеизвестно, что сама по себе антикоагулянтная терапия АВК связана с повышением риска геморрагических осложнений. Частота больших кровотечений на фоне терапии Варфарином составляет около 2%, а фатальных – около 0,1% в год [12, 15–19]. Частота больших кровотечений на фоне трехкомпонентной терапии по данным ряда ретроспективных и обсервационных исследований составляет от 3,1 до 18% [14, 20–23].
Для больного, принимающего комбинированную антитромботическую терапию, чрезвычайно важно минимизировать риск геморрагических осложнений. Как же снизить риск кровотечений, зная, что прием каждого из антитромботических препаратов абсолютно необходим больному? Во-первых, насколько это возможно уменьшить длительность одновременного приема трех препаратов и, во-вторых, назначать препараты в минимальной эффективной дозе. Однако далеко не все клинические ситуации, возникающие в реальной практике при лечении несколькими антитромботическими препаратами, могут быть освещены в рекомендациях. В качестве примера подобного случая приводим историю болезни одного из длительно наблюдаемых нами пациентов.
Клиническое наблюдение
Больной Б., впервые обратился в НИИ клинической кардиологии им. А.Л. Мясникова в 1998 году в возрасте 47 лет с жалобами на неритмичное сердцебиение, одышку, слабость, повышение уровня АД до 150–160/90 мм рт. ст. Из анамнеза было известно, что в 16 лет у больного впервые было зарегистрировано повышение АД до 140/80 мм рт. ст. В то время он не обследовался и не лечился. В возрасте 23 лет при плановой съемке ЭКГ у больного были выявлены признаки очагового поражения миокарда передне-боковой локализации, расцененное врачами по месту жительства как острый инфаркт миокарда. Однако при дальнейшем обследовании была выявлена гипертрофия миокарда левого желудочка и был выставлен диагноз гипертрофической кардиомиопатии. В возрасте 40 лет на фоне повышения АД до 150–160/90 мм рт. ст. у больного впервые возник пароксизм мерцательной аритмии, в то время купировавшийся самостоятельно. В дальнейшем у больного стали регистрироваться пароксизмы мерцания-трепетания предсердий, которые с течением времени стали практически резистентными к проводимой антиаритмической терапии. При госпитализации в 1996 году в НИИ клинической кардиологии им. А.Л. Мясникова больному впервые была проведена ЭхоКГ, подтвердившая гипертрофию МЖП и задней стенки левого желудочка до 1,5–1,6 см без признаков обструкции выносящего тракта левого желудочка, а также расширение левого и правого предсердий соответственно до 5,2 х 6,5 см и 4,0 х 5,8см, размер левого желудочка и фракция выброса были в норме. По данным ЧпЭхоКГ в обоих предсердиях выявлялась высокая степень спонтанного эхоконтрастирования, признаков внутрисердечного тромбоза выявлено не было. Инсультов, системных эмболий у больного не было.
В 1998 году у пациента установилась постоянная форма мерцания-трепетания предсердий. Назначение атенолола в суточной дозе 75 мг не урежало в достаточной степени частоту сердечных сокращений, а увеличение дозы до 100 мг в сутки оказывало проаритмогенное действие – у больного стала регистрироваться желудочковая эктопическая активность высоких градаций, включая неустойчивые пробежки желудочковой тахикардии. В связи с чем была подобрана терапия Финоптином (ретардированная форма 240 мг/сут) и Капотеном 37,5 мг/сут. Учитывая наличие у больного факторов риска тромбоэмболических осложнений – артериальной гипертонии и атриомегалии, в 1998 году больному была начата терапия антагонистами витамина K. В то время пациенту был назначен Аценокумарол в суточной дозе 3 мг под контролем МНО (целевой диапазон 2,0–3,0).
В начале лечения Аценокумаролом у больного отмечалась незначительная десневая кровоточивость, расцененная как проявления малых геморрагий, не требовавших отмены или коррекции дозы препарата.
На протяжении всего периода наблюдения у больного отмечалось повышение уровня общего холестерина до 8–8,9 ммоль/л. Учитывая гипербилирубинемию (общий билирубин 40–46 мкМ/л, прямой билирубин 10–13 мкмол/л), вероятнее всего, в рамках синдрома Жильбера, а также по экономическим причинам статины больной не получал до 2003 года. В дальнейшем на фоне соблюдения диеты и назначения симвастатина в дозе 20 мг уровень общего холестерина снизился до 5,6–6,0 ммоль/л.
С 1998 года у больного по результатам УЗДАС был выявлен стеноз в устье правой подключичной артерии до 50–55% и утолщение толщины интима-медиа в области бифуркации левой ВСА. Через 5 лет отрицательной динамики выявлено не было, а через 9 лет у больного появился стеноз 20–25% в бифуркации левой ОСА и окклюзия левой ВСА при отсутствии прогрессирования стеноза в устье правой подключичной артерии.
С 2004 года больной был переведен на терапию Варфарином в суточной дозе 6,25 мг. Значения МНО были в пределах 2,0–3,0. На протяжении всего времени наблюдения контроль МНО осуществлялся 1 раз в месяц. Среднее МНО за время наблюдения с 1998 по 2007 гг. составило 2,6. Больших геморрагических осложнений не было, изредка отмечалась десневая кровоточивость, не требовавшая отмены и изменения дозы препарата.
С 2003 года больной стал отмечать одышку при обычной умеренной физической нагрузке. Типичной клиники стенокардии у больного никогда не было, нитратами не пользовался. С 2006 года отметил существенное усугубление одышки и в 2007 году в возрасте 56 лет в связи с существенным снижением толерантности к физической нагрузке, больной был повторно госпитализирован в НИИ клинической кардиологии им. А.Л. Мясникова для проведения коронароангиографии.
При обследовании в мае 2007 года у больного выявлили расширение обоих предсердий, размеры которых увеличились по сравнению с данными прошлой госпитализации, ФВ превышала 60%, размер левого желудочка не был увеличен. По данным коронароангиографии было обнаружено: левый тип кровоснабжения миокарда и неизмененный ствол левой коронарной артерии. В передней нисходящей артерии были обнаружены два стеноза: протяженный стеноз до 50–60% в проксимальном и стеноз до 60–70% в дистальном сегменте. В диагональных и септальных ветвях признаков стенозирования не обнаружено. Огибающая артерия в проксимальном сегменте была стенозирована до 50%, в среднем и дистальном сегментах не изменена. В первой артерии тупого края имелся стеноз в средней трети до 60%. Задняя нисходящая артерия малого диаметра в устье была стенозирована до 70%. Правая коронарная артерия в проксимальном сегменте не изменена, в дистальном сегменте имелся стеноз на 80–90%.
Больному было проведено чрескожное коронарное вмешательство на передней нисходящей артерии, в дистальный и проксимальный отделы были имплантированы два стента с лекарственным покрытием. Остаточных стенозов в местах установки стентов не было. Процедура прошла без осложнений.
От выбора стента (голометаллический или с лекарственным покрытием) у больного, принимающего АВК, зависит длительность лечения тиенопиридинами, по мере увеличения длительности терапии возрастает риск геморрагических осложнений. Поэтому для больных МА перед проведением ЧКВ важно оценить риск кровотечений, который определяет выбор стента и соответственно длительность трехкомпонентной антитромботической терапии. Существует несколько шкал расчета риска кровотечений. Наиболее принятыми для больных, принимающих АВК, являются шкалы HEMORR2HAGES [24] и Outpatient Bleeding Risk Index [25] (см. табл.).
Для больных, имеющих высокий риск кровотечений, необходимо минимизировать продолжительность трехкомпонентной терапии Варфарином, аспирином и клопидогрелем, для чего у данной категории пациентов нужно избегать имплантации стентов с лекарственным покрытием. Эта мера позволяет уменьшить длительность трехкомпонентной терапии до 2–4 недель [14]. Для пациента, имеющего низкий/средний риск геморрагических осложнений, возможна имплантация стентов с лекарственным покрытием. В зависимости от типа имплантируемого стента и условий имплантации длительность трехкомпонентной терапии в таком случае составляет от 3 до 6 месяцев [14].
Принимая во внимание высокий риск тромбоэмболических осложнений при потенциально низком риске кровотечений, а также наличие стенозов в передней нисходящей артерии, нашему пациенту было имплантировано два стента с лекарственным покрытием и назначена трехкомпонентная терапия –
Варфарином с целевыми значениями МНО 2,0–2,5, аспирином 100 мг и клопидогрелем 75 мг/сут.
Через 4 месяца трехкомпонентной терапии у больного впервые в жизни развилось геморроидальное кровотечение, не приведшее к нарушениям гемодинамики и снижению гемоглобина и прекратившееся самостоятельно. В течение последующего месяца геморроидальные кровотечения неоднократно рецидивировали, появилась слабость, в анализах крови отмечалось снижение гемоглобина с 13,5 г/л до 10,8 г/дл, гематокрита до 37%. Мы были вынуждены реагировать на возникшее осложнение и снизить целевое МНО до 1,8–2,0, для чего доза Варфарина была уменьшена до 5,625 мг. Доза аспирина была уменьшена до 75 мг/сут, клопидогрель продолжен в прежней дозе. По рекомендации проктолога была начата терапия местными средствами. Однако геморроидальные кровотечения продолжались, хотя объем кровопотери, со слов больного, стал меньше. Несмотря на терапию препаратами железа, сохранялся сниженный уровень гемоглобина и гематокрита. Учитывая ранние сроки после имплантации стентов с лекарственным покрытием и невозможность отмены клопидогреля, аспирин был отменен. Было принято решение об оперативном лечении геморроя. Учитывая рецидивирующее кровотечения и невозможность полной отмены антитромботической терапии, больному была выполнена операция лигирования двух геморроидальных узлов под местной анестезией. Операция прошла без осложнений. Клопидогрель не отменялся, за два дня до предполагаемой операции Варфарин был отменен, и операция была выполнена на значении МНО 1,6. После операции доза Варфарина была увеличена до прежней 5,625 мг и МНО поддерживалось на значениях 1,8–2,2, учитывая одновременную терапию клопидогрелем. В дальнейшем геморроидальные кровотечения не повторялись.
В мае 2008 года, через год после ЧКВ, клопидогрель был отменен, была возобновлена терапия аспирином в суточной дозе 75 мг и продолжен Варфарин. В дальнейшем доза Варфарина была вновь увеличена до 6,25 мг, поддерживающая целевые значения МНО 2,0–2,5.
На фоне терапии Варфарином 6,25 мг и аспирином 75 мг с мая 2008 года и до настоящего времени (более 2-х лет) кровотечения не рецидивировали.
На протяжении наблюдения в течение 12 лет до настоящего времени у больного не было тромбоэмболических осложнений.
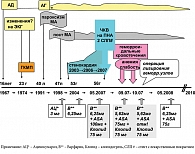
Анамнез заболевания больного и изменения в антитромботической терапии представлены на рис. 2.
Как демонстрирует данный клинический пример, безопасность является краеугольным камнем трехкомпонентной терапии. Несмотря на существующие шкалы расчета риска кровотечений, акцентирующие внимание врача на таких факторах, как пожилой возраст, хроническая почечная недостаточность, тромбоцитопатия, геморрагические осложнения в анамнезе, нельзя исключить возможность развития кровотечений у больного низкого риска. Так, наш пример демонстрирует отсутствие кровотечений на фоне девяти лет приема АВК у больного, не имеющего документированных факторов риска геморрагических осложнений и развитие рецидивирующих кровотечений, сопровождавшихся значимой анемией и потребовавших хирургического лечения через четыре месяца трехкомпонентной терапии.
В согласованном документе Европейского общества кардиологов, Европейской ассоциации нарушений ритма сердца и Европейской ассоциации по чрескожным коронарным вмешательствам, опубликованном в 2010 г. записано, что больному, принимающему АВК, необходимо избегать имплантации стентов с лекарственным покрытием во всех случаях, кроме имеющих специальные клинические или анатомические показания, такие как протяженный стеноз, малый диаметр сосуда, сахарный диабет [14]. Данная рекомендация обусловлена наличием связи между увеличением риска геморрагических осложнений и длительностью антитромботической терапии. Больной подвергается риску, связанному не только с самим кровотечением, но и с такими грозными осложнениями, как тромбоз стента и инфаркт миокарда на фоне отмены антитромботических препаратов в случае развития геморрагического осложнения.
Нельзя сказать, что больному, принимающему Варфарин, абсолютно противопоказано имплантировать стент с лекарственным покрытием. Однако в этих случаях целевой диапазон МНО должен соответствовать значениям 2,0–2,5, а клопидогрель и аспирин – назначаться в минимально эффективных дозах. Обязателен более четкий контроль и своевременная терапия, направленная на устранение потенциальных источников кровотечений.
В случае проявления малых геморрагий необходимо снизить целевые значения МНО до 1,8–2,2, рассмотреть возможность отмены аспирина. Необходимо создать мотивацию у больного на важность продолжения терапии клопидогрелем после ЧКВ. Для больных, имеющих высокий риск желудочно-кишечного кровотечения (пожилые пациенты, больные с язвенной болезнью желудка или двенадцатиперстной кишки или ЖКК в анамнезе), профилактически должны быть назначены ингибитор протонового насоса, Н2-блокатор или антацид.
Однако на практике не всегда бывает просто соблюдать, казалось бы, четкие рекомендации.
Для Варфарина характерны межиндивидуальные различия в антикоагулянтном ответе, обусловленные целым рядом внешних (диета, лекарственные взаимодействия), внутренних (соматическое состояние пациента, возраст), а также генетических факторов [26–30].
Поддерживающая доза Варфарина может широко различаться у разных больных, а также у одного и того же больного на протяжении длительного лечения. Анализ величин средних поддерживающих доз Варфарина у 115 больных, длительно наблюдающихся в НИИ клинической кардиологии им. А.Л. Мясникова, показал, что большинство больных (около 67%) принимают так называемые средние дозы Варфарина (2,5–7,5 мг/сут), а 9% больных требуется значительно меньшая доза (2,5 мг и менее) и у 24% пациентов поддерживающая доза Варфарина превышает 7,5 мг.
В последние годы установлено, что доза Варфарина генетически детерминирована. Наиболее изученными являются аллельные варианты двух основных ферментов биотрансформации АВК – CYP2C9 и VKORC1. В настоящее время изучаются влияния на поддерживающую дозу Варфарина таких полиморфизмов, как генотип CYP2C9*5 и CYP2C9*6, полиморфизм гена CYP4F2, описан ряд несинонимичных замен в гене VKORC1, ассоциированных с большими поддерживающими дозами Варфарина [27, 29, 31–34]. В августе 2007 года FDA внесла дополнения в листовку к Варфарину о том, что определение полиморфизмов CYP2C9 и VKORC1 может снизить риск кровотечений у носителей данных мутантных аллелей.
Нашему больному ретроспективно было проведено генетическое тестирование на чувствительность к Варфарину. Полиморфизмов в гене CYP2C9 выявлено не было. При исследовании гена VKORC1 был выявлен гетерозиготный полиморфизм – генотип AG.
Однако связать развитие повторных кровотечений у нашего пациента с полиморфизмом в гене VKORC1 вряд ли возможно, так как наличие полиморфизмов в основных ферментах биотрансформации АВК обуславливает нестабильность антикоагуляции и кровотечения в начале терапии, чаще всего при подборе дозы препарата. Носительство «медленных» аллельных вариантов CYP2C9*2 и CYP2C9*3 приводит к снижению скорости биотрансформации Варфарина и повышению его концентрации в плазме крови и ассоциируется с низкой поддерживающей дозой Варфарина, чрезмерной гипокоагуляцией и высоким риском кровотечений. Наибольшим риском в отношении развития геморрагических осложнений и чрезмерной антикоагуляции обладают носители гомозиготных полиморфизмов [28–30].
У нашего пациента был выявлен гетерозиготный полиморфизм в гене VKORC1 при «диком генотипе» CYP2C9, что не является документированным фактором риска кровотечений. Действительно, предшествующая 9-летняя терапия Варфарином не сопровождалась значимыми кровотечениями. И на продолжении последних двух лет после отмены клопидогреля также кровотечений отмечено не было.
В заключение необходимо отметить, что проведение чрескожных коронарных вмешательств в настоящее время становится рутинной практикой у больных ИБС. Назначение Варфарина больным мерцательной аритмией способствует не только снижению риска тромбоэмболических осложнений, но и увеличению продолжительности жизни больного. С возрастом увеличивается риск развития ИБС и необходимость проведения реваскуляризации.
Трехкомпонентная терапия позволяет избежать как тромбоэмболических осложнений, обусловленных мерцательной аритмией, так и осложнений, связанных с проведением процедуры эндоваскулярного вмешательства. Однако выбор типа имплантируемого стента должен определяться с учетом потенциального риска кровотечений. Развитие геморрагического осложнения требует отмены антитромботической терапии, что многократно повышает риск сердечно-сосудистых осложнений, в том числе и фатальных. Накопление опыта наблюдения за пациентами, принимающими трехкомпонентную терапию, и проведение дальнейших исследований в этой области позволит усовершенствовать алгоритмы лечения и сделать терапию более безопасной.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.