Возможности и перспективы лекарственной терапии плоскоклеточного рака кожи: обзор литературы и собственные наблюдения
- Аннотация
- Статья
- Ссылки
- English
Обзор данных литературы
Плоскоклеточный рак (ПКР) кожи – злокачественная опухоль кожи, происходящая из эпителиальных клеток (кератиноцитов) эпидермиса кожи и/или эпидермиса волосяных фолликулов. ПКР кожи считается вторым по распространенности злокачественным новообразованием после базально-клеточного рака (БКР) среди всех немеланомных опухолей кожи [1–5]. Несмотря на высокую заболеваемость, в большинстве случаев ПКР кожи удается излечить хирургическим путем [6]. Частота регионарного метастазирования составляет около 10–15% и зависит от локализации и размеров первичного очага. Отдаленное метастазирование встречается редко, однако чаще, чем отдаленное метастазирование при БКР кожи.
Согласно результатам когортного ретроспективного исследования с участием 985 больных ПКР кожи, при наличии одного первичного очага ПКР на коже риск метастазирования в регионарные лимфатические узлы составляет 3,7%, а риск смерти, обусловленный заболеванием, – 2,1%. При этом риск развития отдаленного метастазирования достигает 0,4% [7]. В целом на распространенные формы болезни (метастатическую и местнораспространенную неоперабельную форму) приходится от 5 до 20% [5]. Единственной терапевтической опцией в таком случае является системная лекарственная терапия, которая в ряде случаев может быть дополнена лучевой терапией [8].
Данные эффективности системной терапии по поводу местнораспространенного или метастатического ПКР кожи ограничены описаниями клинических случаев, ретроспективными исследованиями, а также исследованиями I–II фаз. Нет ни одного проспективного исследования III фазы.
В 2019 г. немецкими специалистами центра онкодерматологии была опубликована статья, описывавшая подходы к терапии распространенных форм ПКР кожи в ежедневной клинической практике [9]. В публикацию были включены сведения о 195 пациентах (141 (72%) мужчине и 54 (28%) женщинах), обратившихся за консультацией и проходивших лечение в центре онкодерматологии Тюбингенского университета (Университет Эберхарда и Карла в городе Тюбинген, Германия) с января 2001 по июнь 2018 г. У 32 пациентов (16,4%) были выявлены отдаленные метастазы: в легких (n = 15), мягких тканях (n = 9), костях (n = 4), печени (n = 1), других органах (n = 3; более одного органа с метастатическим поражением). При этом описаны различные варианты системной терапии: химиотерапия на основе препаратов платины (± анти-EGFR), таксаны и иммунотерапия анти-PD1-моноклональными антителами, что еще раз подчеркивает отсутствие единого стандарта терапии местнораспространенных и/или метастатических форм ПКР кожи на тот момент [9].
В литературе описаны серии пациентов и данные небольших исследований об эффективности химиотерапии на основе препаратов платины, а также анти-EGFR-терапии (таблица) [10–23].
В 2018 г. Управлением по контролю за качеством пищевых продуктов и лекарственных средств США одобрен первый препарат семиплимаб (анти-PD1-моноклональное антитело) для лечения пациентов с местнораспространенным и метастатическим ПКР кожи, которым не может быть выполнено радикальное хирургическое лечение или лучевая терапия по радикальной программе.
Семиплимаб (Libtayo) не зарегистрирован в России, однако является наиболее изученным в этой популяции пациентов анти-PD1-препаратом. Семиплимаб был одобрен на основании результатов двух исследований – 1423 (NCT02383212) и 1540 (NCT02760498). Критериями исключения в данных исследованиях были:
- наличие аутоиммунных заболеваний, требовавших системного использования глюкокортикостероидов в течение пяти лет до включения в исследования;
- трансплантация органа;
- предшествовавшая терапия анти-PD1/PD-L1 или другими ингибиторами контрольных точек;
- ВИЧ-инфекция, гепатит B и C;
- общее состояние по шкале ECOG ≥ 2.
Пациенты получали терапию семиплимабом в дозе 3 мг/кг путем внутривенной инфузии каждые две недели до 48 недель в исследовании 1423 и до 96 недель в исследовании 1540. Лечение проводили до прогрессирования болезни (ПБ), непереносимой токсичности или планового завершения лечения. Оценку ответа на лечение проводили каждые восемь недель. Основной целью исследований была оценка частоты объективного ответа (ЧОО) и длительности ответа (ДО) по данным независимой оценки. Для оценки использовали критерии оценки для солидных опухолей (RECIST 1.1) или критерии Всемирной организации здравоохранения (выполнялось медицинское фотографирование). В исследование 1423 было включено 26 пациентов, в исследование 1540 – 193 пациента. Из 193 участников у 115 пациентов была выявлена метастатическая форма заболевания, у 78 – местнораспространенная. Медиана возраста составила 72 года (от 38 до 96). 34% пациентов получили как минимум одну линию предшествующей системной противоопухолевой терапии. Среди пациентов с метастатической формой заболевания у 77% имелись отдаленные метастазы, у 23% – только метастазы в лимфоузлы. ЧОО в группе пациентов с метастатической формой ПКР кожи (n = 115) составила 46,9% (включая полный ответ (ПО) – 18,2% и частичный ответ (ЧО) – 28,7%). При этом ДО варьировалась от 2,1 до ≥ 21,6 месяца. У 90 (78%) пациентов ответ сохранялся шесть месяцев и более. ЧОО в группе пациентов с местнораспространенной формой заболевания (n = 78) составила 44,9% (включая 12,8% ПО и 32,1% ЧО). При этом ДО варьировался от 1,9 до ≥ 24,2 месяца, у 53 (68%) пациентов ответ сохранялся шесть месяцев и более. Для всех пациентов (n = 193), включенных в оба исследования, ЧОО достигла 46,1% (включая 16,1% ПО и 30,1% ЧО), ДО варьировалась от 1,9 до ≥ 24,2 месяца, у 75% пациентов ответ сохранялся шесть месяцев и более [16]. Отмечалась удовлетворительная переносимость терапии. Наиболее частыми нежелательными явлениями (НЯ), которые регистрировались более чем у 10% пациентов, были (все степени/3–4-я степень): усталость (34,7/2,6%), диарея (27,5/1,0%), тошнота (23,8/0%), зуд кожных покровов (21,2/0%), сыпь (16,6/0,5%), кашель (16,6/0%).
Для зарегистрированных в РФ препаратов (пембролизумаб, ниволумаб) данные об эффективности при ПКР кожи получены на основании результатов небольших нерандомизированных исследований или отдельных клинических наблюдений.
Пембролизумаб – анти-PD1-моноклональное антитело изучали в рамках исследования II фазы, первая линия терапии при неоперабельной форме ПКР кожи (CARSKIN) [19]. Период набора в исследование составил лишь 10 месяцев: с марта 2017 по январь 2018 г. В исследование было включено 39 пациентов, средний возраст – 79 лет. Среди включенных пациентов у 18% зарегистрирована локальная форма, у 62% – регионарная форма, у 20% – метастатическая. Медиана наблюдения составила 10,2 месяца (при этом 15 пациентов остаются на терапии). Первичной целью данного исследования была оценка ЧОО на 15-й неделе терапии по критериям RECIST 1.1 и переносимость терапии (24 месяца) [17]. ЧОО на 15-й неделе составила 38,5%, частота контроля над заболеванием – 51%. Нежелательные явления, связанные с терапией, отмечались у 67% пациентов, в том числе тяжелые НЯ – в 8% случаев (холестаз 3-й степени, колит 3-й степени). У 10% пациентов терапия была отменена из-за развития НЯ. Кроме того, дополнительно в центральной лаборатории (пороговое значение – 1%) была изучена экспрессия PD-L1, которая определялась у 77% пациентов, но при этом не обладала прогностической значимостью в отношении ответа на терапию (р = 0,55).
Ниволумаб – еще одно анти-PD1-моноклональное антитело, которое использовалось для лечения отдельных пациентов с неоперабельной формой ПКР кожи или в серии клинических наблюдений. Пациенты получали ниволумаб в дозе 3 мг/кг или фиксированной дозе 240 мг внутривенно каждые две недели от восьми до 78 недель. В семи клинических наблюдениях описанная выживаемость без прогрессирования (ВБП) составила 6–19,5 месяца. Полный ответ был достигнут у пациента, получавшего ниволумаб в комбинации с еженедельным введением цетуксимаба [20].
Еще одна публикация клинических наблюдений включает данные о пяти пациентах с распространенной формой ПКР кожи и базально-плоскоклеточного рака кожи, ранее получавших системную и лучевую терапию. Три пациента получали ниволумаб, два – пембролизумаб. У всех пациентов был достигнут контроль над заболеванием, в том числе два ЧО (один ЧО после терапии ниволумабом, один ЧО после терапии пембролизумабом, ВБП составила ≥ 7 месяцев, ОВ не достигнута в обоих случаях). Стабилизация болезни (СБ) зарегистрирована у трех больных (ВБП – 5,5, 6 и ≥ 4 месяцев). У больных, ответивших на лечение, отсутствовала экспрессия PD-L1 в опухоли [21].
Другая публикация включает данные о трех пациентах, ранее получавших системную терапию. У всех была выявлена экспрессия PD-L1 в опухоли. У двух пациентов удалось достичь ЧО, терапия продолжается на момент публикации уже свыше 12 месяцев. У одного пациента зафиксирована СБ длительностью три месяца, он также продолжает терапию ниволумабом [23].
Собственное клиническое наблюдение
Пациент, 61 год. ПКР кожи передней брюшной стенки в гипертрофическом рубце после многочисленных лапаротомий, выполненных по поводу ножевого проникающего ранения живота (1990 г.), формирования наружного тонкокишечного свища (2019 г.), метастазы в проекции рубца, по брюшине и межкишечно, метастазы в подмышечных лимфоузлах слева (морфологически верифицированы – метастаз умеренно дифференцированного ПКР с периневральным характером роста, фрагменты фиброзно-жировой ткани с инфильтрацией нейтрофилами и мелкими роговыми массами).
С августа 2019 г. – распад опухолевых узлов в подмышечной области слева и болевой синдром (прием трамадола).
Сопутствующая патология – хронический вирусный гепатит C (с низкой вирусной нагрузкой и без противовирусной терапии).
В октябре 2019 г. проведено два цикла химиотерапии цисплатином, без эффекта.
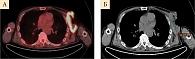
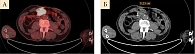
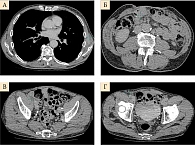
Контрольное обследование в ноябре 2019 г. (позитронно-эмиссионная томография (ПЭТ) и компьютерная томография (КТ)) показало прогрессирование заболевания с увеличением очагов в подмышечной области слева и между петель кишечника, появлением метастазов в подвздошных и паховых лимфоузлах справа (рис. 1–3). Динамический парез кишечника. Ухудшение общего состояния пациента, ECOG 2. Усиление болевого синдрома (трамадол, кеторолак).
В декабре 2019 г. предпринята попытка терапии ниволумабом в дозе 240 мг внутривенно каждые две недели (однако с декабря 2019 по март 2020 г. проведено только три введения ниволумаба, интервалы между введениями увеличены для коррекции анемии 3-й степени вследствие кровотечения из распадающейся опухоли). Терапия ниволумабом продолжается по настоящее время со значительным клиническим улучшением (объективный ответ по критериям RECIST 1.1 – частичный ответ). Видимые проявления заболевания практически полностью регрессировали, болевой синдром разрешился.
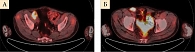
Данные контрольного обследования в марте 2020 г. (компьютерная томография органов грудной клетки и брюшной полости, малого таза с внутривенным контрастированием): опухолевые очаги не определяются (рис. 4).
Ультразвуковое исследование органов брюшной полости, рубцов передней брюшной стенки (март 2020 г.): ранее описанные опухолевые очаги не определяются. При этом клинически в левой подмышечной области сохраняется регрессирующий опухолевый инфильтрат до 3 см, без признаков распада. ECOG 0. Переносимость терапии удовлетворительная.
Заключение
Наиболее перспективным и изученным на сегодняшний день является использование анти-PD1-моноклональных антител у пациентов с неоперабельными местнораспространенными или метастатическими формами ПКР кожи. Наш собственный опыт подтверждает данные литературы и демонстрирует, что даже у пациентов, ранее получавших системную терапию, удается достичь объективного ответа на анти-PD1-терапию, который может сохраняться длительный период времени. К сожалению, несмотря на высокую непосредственную эффективность химиотерапии (ЧОО 50% и более) (см. таблицу), ремиссии, которых удается достичь, обычно непродолжительны.
K.V. Orlova, PhD, N.N. Petenko, PhD, L.V. Demidov, PhD, Prof.
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Kristina V. Orlova, k.orlova@ronc.ru
Squamous cell carcinoma (SCC) of the skin is a malignant skin tumor that originates from epithelial cells (keratinocytes) of the epidermis of the skin and/or the epidermis of hair follicles. Skin SCC is considered to be the second most common skin cancer after basal cell carcinoma among all non-melanoma skin tumors. In general, common forms of the disease (including metastatic form and locally spread inoperable form) account for from 5 to 20%. The only therapeutic option in this case is systemic drug therapy, which in some cases can be supplemented with radiation therapy. In skin SCC it is noted the expression of the programmed death ligand (PD-L1) on the surface of tumor cells (especially in high-risk tumors – in patients with recurrent SCC, metastases in the lymph nodes), which suggests possible sensitivity to drug therapy with anti-PD1 inhibitors. The article presents a review of literature data, as well as a clinical case of treatment of a patient with a metastatic form of SCC using an anti-PD1 inhibitor.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.