Комплексная оценка эффективности курсового применения гидролизата плаценты человека с целью коррекции возраст-ассоциированных изменений кожи лица
- Аннотация
- Статья
- Ссылки
- English
С возрастом снижается пролиферативная и метаболическая активность фибробластов дермы, происходит структурное и композиционное ремоделирование белков кожного внеклеточного матрикса, в первую очередь коллагена.
Старение кожи можно рассматривать в контексте теории inflammaging, предложенной в 2000 г. итальянскими иммунологами во главе с C. Franceschi, согласно которой старение организма характеризуется хроническим системным стерильным низкоинтенсивным воспалением с активацией в первую очередь врожденного звена иммунной системы.
Пептидные препараты на основе гидролизата плаценты человека (ГПЧ) на сегодняшний день используются с терапевтической целью в различных отраслях медицины. Геропротекторное, иммуномодулирующее, антивоспалительное и регенераторное действие обусловливает возможность их применения для коррекции возраст-ассоциированных изменений кожи лица у женщин.
Так, после курса пяти внутримышечных инъекций препарата ГПЧ в биологически активные точки лица нами было отмечено достоверное уменьшение глубины морщин параорбитальной и периоральной зоны, степени деформации овала лица, повышение увлажненности и бактерицидной активности кожи. В периферической крови выявлено значимое увеличение числа регуляторных Т-лимфоцитов и моноцитов с одновременным увеличением активности и интенсивности фагоцитоза последних, снижение концентрации провоспалительных цитокинов IL-6 и IL-8 с параллельным повышением уровня IL-4. При иммуногистохимическом анализе кожи в дерме обнаружено наиболее значимое увеличение объемной плотности коллагенов I и III, ламинина, FGF-2, TGF-β, VEGF, IL-1α, IL-6, IL-20 с одновременным снижением PDGF и IL-8, в эпидермисе – повышение TGF-β, EGF и уменьшение IGF. Таким образом, препарат ГПЧ активирует дермальные фибробласты, поддерживает обновление и трофику клеток эпидермиса, способствует восстановлению биомеханических и бактерицидных свойств стареющей кожи.
С возрастом снижается пролиферативная и метаболическая активность фибробластов дермы, происходит структурное и композиционное ремоделирование белков кожного внеклеточного матрикса, в первую очередь коллагена.
Старение кожи можно рассматривать в контексте теории inflammaging, предложенной в 2000 г. итальянскими иммунологами во главе с C. Franceschi, согласно которой старение организма характеризуется хроническим системным стерильным низкоинтенсивным воспалением с активацией в первую очередь врожденного звена иммунной системы.
Пептидные препараты на основе гидролизата плаценты человека (ГПЧ) на сегодняшний день используются с терапевтической целью в различных отраслях медицины. Геропротекторное, иммуномодулирующее, антивоспалительное и регенераторное действие обусловливает возможность их применения для коррекции возраст-ассоциированных изменений кожи лица у женщин.
Так, после курса пяти внутримышечных инъекций препарата ГПЧ в биологически активные точки лица нами было отмечено достоверное уменьшение глубины морщин параорбитальной и периоральной зоны, степени деформации овала лица, повышение увлажненности и бактерицидной активности кожи. В периферической крови выявлено значимое увеличение числа регуляторных Т-лимфоцитов и моноцитов с одновременным увеличением активности и интенсивности фагоцитоза последних, снижение концентрации провоспалительных цитокинов IL-6 и IL-8 с параллельным повышением уровня IL-4. При иммуногистохимическом анализе кожи в дерме обнаружено наиболее значимое увеличение объемной плотности коллагенов I и III, ламинина, FGF-2, TGF-β, VEGF, IL-1α, IL-6, IL-20 с одновременным снижением PDGF и IL-8, в эпидермисе – повышение TGF-β, EGF и уменьшение IGF. Таким образом, препарат ГПЧ активирует дермальные фибробласты, поддерживает обновление и трофику клеток эпидермиса, способствует восстановлению биомеханических и бактерицидных свойств стареющей кожи.





Введение
Изменения кожи, особенно кожи лица, связанные со старением, обнаруживаются невооруженным глазом и доставляют эстетический и социальный дискомфорт в первую очередь женщинам. Появляются морщины, кожа становится тонкой, сухой, дряблой, неравномерно пигментированной [1, 2].
С морфологической точки зрения в основе хроностарения кожи лежат процессы атрофии, сопровождающиеся истончением эпидермиса, дезорганизацией внеклеточного матрикса дермы, нарушением структуры, метаболизма, пролиферативного потенциала дермальных фибробластов (ДФ) [1, 2], их синтетической и секреторной активности, функциональной специализации, значительным снижением паракринных и прямых взаимодействий с эпидермальными стволовыми клетками и кератиноцитами [3, 4].
На сегодняшний день существует ряд теорий, объясняющих клеточно-молекулярные механизмы старения организма в целом и кожи в частности [5].
В 2000 г. группой ученых из Италии под руководством C. Franceschi была предложена теория inflammaging, в названии которой были объединены два слова – inflammation (воспаление) и aging (старение) [6]. Согласно данной теории, в основе старения лежит хроническое системное стерильное низкоинтенсивное воспаление [6–8]. В inflammaging вовлечены такие механизмы, как клеточное старение, дисфункция митохондрий, нарушение аутофагии, активация инфламмасом, дисрегуляция убиквитин-протеасомной системы, активация путей ответа на повреждение ДНК, изменение состава микробиоты макроорганизма [7]. С возрастом, даже у здоровых людей старшей возрастной группы, повышается сывороточная концентрация провоспалительных цитокинов – интерлейкинов (IL) 6, 1β, 12 и 18, фактора некроза опухоли (TNF) α [8]. Inflammaging кожи способствует накопление стареющих ДФ, секретирующих множество медиаторов воспаления, включая IL-8, IL-6, TNF-α и CCL2 [9]. При старении в коже снижается число клеток Лангерганса, их миграционная и функциональная активность, что приводит к нарушениям Т-клеточного иммунного ответа [9].
Нативное происхождение плацентарных препаратов и многокомпонентность их состава, обусловливающая разносторонние клинические эффекты, позволили использовать их в терапии, гинекологии, восстановительной, эстетической и антивозрастной медицине [10–15]. Препарат Лаеннек (Japan Bio Products Industry Co., Ltd., Япония) представляет собой гидролизат плаценты человека (ГПЧ), полученный по оригинальной технологии, который производится по GMP-стандарту с использованием многоступенчатого молекулярного фракционирования, что делает возможным его внутримышечное, в том числе фармакопунктурное, и внутривенное введение [14–16].
В России Лаеннек зарегистрирован в качестве лекарственного препарата для медицинского применения (регистрационный номер П013851/01, коды по АТХ – A05BA «Гепатопротекторное средство» и L03 «Иммуномодулирующее средство») [14].
Лаеннек содержит порядка 36 факторов роста клеток, включая инсулиноподобный фактор роста 1 (IGF-1), трансформирующий фактор роста β1 (TGF-β1), фактор роста гепатоцитов (HGF), эпидермальный ростовой фактор (EGF), макрофагальный колониестимулирующий фактор (M-CSF), фактор роста эндотелия сосудов (VEGF), тромбоцитарный фактор роста (PDGF), цитокины IL-8, IL-1α, IL-1β, IL-12, TNF-α и др., витамины В12, В1, В5, В6, С, К, Е, D, ретинол, макро- (N, Р, С, S, Na, Mg, Са, К) и микроэлементы (Zn, Co, Br, Se и др.) [16, 17]. В составе препарата идентифицированы аминокислотные последовательности ряда пептидов протеома человека, отчасти объясняющие ранозаживляющий, иммуномодулирующий, гепатопротекторный и нейропротекторный эффекты. Речь, в частности, идет о пептиде коллагена Iα2, который активирует рецепторы DDR, регулирующие адгезию, рост, миграцию и деление клеток, реконструкцию внеклеточного матрикса соединительной ткани и кожи [17].
Эффективность Лаеннека в решении эстетических проблем была подтверждена результатами клинических исследований, проведенных на базе сети клиник RHANA с участием 130 пациентов обоего пола в возрасте от 33 до 53 лет [18, 19]. После монотерапии Лаеннеком гидратация кожи возрастала в среднем на 18,9%, а у получавших Лаеннек в сочетании с профессиональным косметическим уходом и применением косметических средств на основе ГПЧ для ежедневного ухода за кожей – на 25,6%. Эластичность и показатели жирности кожи, содержание меланина у пациентов обеих групп изменились несущественно. При проведении ультразвукового исследования кожи выявлено существенное выравнивание рельефа. Улучшились параметры эхогенности кожи, свидетельствующие о стабилизации структур межклеточного матрикса и улучшении микроциркуляции. Эффект омоложения прямо коррелировал с уровнем IGF-1 в крови [18, 19].
В ходе аппаратно-инструментальных исследований эффектов препаратов Лаеннек и Курасен отмечено улучшение структуры соединительной ткани (увеличение гидратации кожи, количества волокон коллагена и эластина, уплотнение дермы, уменьшение числа и глубины морщин), устранение пятен порфириновой и меланиновой гиперпигментации, что свидетельствовало об их стимулирующем влиянии на функциональную и синтетическую активность фибробластов и меланоцитов [20].
В нескольких исследованиях оценивалась эффективность препарата Лаеннек в комплексной коррекции рубцовых поражений кожи [21–23]. Комбинированное применение фракционной лазеротерапии и фармафореза препаратом Лаеннек способствовало уменьшению сроков реабилитации, регрессу клинических симптомов, выравниванию рельефа поверхности и улучшению структуры дермы и эпидермиса в зоне рубцового поражения, уменьшению толщины дермы и увеличению акустической плотности тканей при проведении ультрасонографии [23].
Применение Лаеннека совместно с инъекционными процедурами, при проведении нитевого лифтинга, лазерного пилинга приводило к улучшению трофики тканей, компенсации интоксикации и лимфостаза, сокращению сроков реабилитации, минимизации риска возникновения воспаления и образования патологических рубцов [16].
Эффективность Лаеннека отмечена при разных заболеваниях и патологических состояниях. При этом в большинстве исследований подчеркивается противовоспалительный эффект препарата с цитопротекторной, антиоксидантной и репарационной активностью, что составляет основу антивозрастного, геропротекторного действия Лаеннека [14, 15, 24]. Важно также, что Лаеннек не оказывает гиперстимулирующего эффекта на иммунную систему. Напротив, он модулирует ее, повышая недостаточную активность и нормализуя избыточную активность различных звеньев иммунитета в пределах физиологической нормы [14].
В доступной нам литературе отсутствуют данные о применении Лаеннека с целью коррекции инволюционных изменений кожи с последующей оценкой клинической эффективности, показателей системного иммунитета, структурных компонентов и молекулярно-регуляторных факторов кожи. В связи с этим целью нашего исследования стала комплексная (клинико-инструментальная, иммунологическая, микробиологическая, иммуногистохимическая) оценка эффективности препарата ГПЧ в коррекции возраст-ассоциированных модификаций кожи лица.
Материал и методы
В исследование были включены 25 женщин с признаками возрастных изменений кожи лица. Их возраст варьировал от 39 до 59 лет. Всем участницам исследования был проведен курс из пяти фармакопунктурных внутримышечных инъекций препарата Лаеннек в проекцию биологически активных точек лица. Схема применения – 2 мл на одну процедуру, один раз в пять дней.
Клинико-инструментальная оценка состояния кожи проводилась до и через 45 дней после последней инъекции препарата ГПЧ и заключалась в измерении глубины морщин периорбитальной и периоральной зон, определении степени деформации овала лица и увлажненности кожи с помощью дермосканера SkinConsult Al Vichy.
Системный иммунитет изучали до курса лечения, на 8-е и 24-е сутки после последней инъекции препарата. В периферической крови определяли количество лейкоцитов, моноцитов, нейтрофилов, лимфоцитов. Фагоцитарную функцию нейтрофилов и моноцитов определяли с помощью метода И.С. Фрейдлин [25], подсчитывая активность фагоцитоза (%), интенсивность фагоцитоза (у.е.), фагоцитарное число (у.е.). Количество Т-лимфоцитов (CD3+), Т-хелперов (CD3+CD4+), цитотоксических Т-лимфоцитов (CD3+CD8+), регуляторных Т-клеток (CD4+CD25+CD127–), В-лимфоцитов (CD19+) подсчитывали с помощью проточного цитофлуориметра Beckman Coulter (США) с использованием моноклональных антител к CD-маркерам: CD3 Monoclonal Antibody (Clone OKT3), CD19 Monoclonal Antibody (Clone HIB19) (eBioscienceTM, США); APC Mouse Anti-Human CD4 (Clone RPA-T4), PE-CyTM5 Mouse Anti-Human CD8 (Clone HIT8α), CD25 PE (Clone 2A3), FITC Mouse Anti-Human CD127 (Clone HIL-7R-M21) (BD PharmingenTM, США). Концентрации иммуноглобулинов (Ig) A, M и G, IL-4, IL-6, IL-8, IL-10 в сыворотке крови определяли методом иммуноферментного анализа с помощью наборов реагентов компании «Вектор-Бест» (Россия) на анализаторе Personal Lab (Adaltis, Италия).
Для иммуногистохимического исследования (ИГХИ) методом punch-биопсии под местной анестезией до и через 45 дней после последней инъекции Лаеннека забирался фрагмент кожи правой заушной области диаметром 3 мм и высотой 2 мм, что позволяло изучать эпидермис и дерму. При ИГХИ в дерме определяли содержание коллагенов I и III, ламинина, гиалуронидазы, каспазы 8, фактора роста фибробластов 2 (FGF-2), EGF, VEGF, PDGF, IGF-1, TGF-β, IL-1α, IL-10, IL-20, IL-8, IL-6, IL-4, в эпидермисе – филаггрина, ламинина, гиалуронидазы, EGF, IGF-1, TGF-β, IL-1α, IL-10, используя такие первичные антитела, как collagen I antibody (COL-I), collagen III antibody (FH-7A), laminin antibody (polyclonal), HYAL1 antibody (polyclonal), caspase 8 antibody (polyclonal), FGF-2 antibody (AS24), EGF antibody (9D7F11), VEGF antibody (polyclonal), PDGF-β antibody (polyclonal), IGF-1 antibody (polyclonal), TGF-β1 antibody (7F6), IL-1α antibody (polyclonal), IL-10 antibody (polyclonal), IL-20 antibody (polyclonal), CXCL-8/IL-8 antibody (polyclonal), IL-6 antibody (polyclonal), GeneTex (США), anti-IL-4 antibody (C1) (Abcam, Великобритания). Для иммунного окрашивания применяли пероксидазный метод с полимерной системой детекции (Histofine® Simple Stain MAX PO MULTI, Япония). Конечная оценка проводилась с помощью системы фиксации микроскопических изображений из микроскопа Сarl Zeiss Axioskop 40, цифровой камеры Jenoptik ProgRes CT3, персонального компьютера на базе Intel® CoreTM i7, программного обеспечения ProgRes CapturePro 2.5.
Количественное исследование осуществляли с помощью программы «Морфология 5.1» («Видеотест», Россия). Рассчитывали относительную плотность изучаемых факторов по отношению к общей площади исследуемого кадра, выраженную в объемных процентах.
Бактерицидную активность кожи оценивали по отношению к Escherichia coli методом агаровых отпечатков Н.Н. Клемпарской с расчетом индекса бактерицидности, выраженного в процентах [26].
Статистическая обработка данных проводилась с использованием программного пакета IBM SPSS Statistics 19. Большинство выборок имело неправильное распределение, поэтому были применены непараметрические методы. Определяли медиану (Ме), а также первый и третий квартили (Q1; Q3). Рассчитывали критерии Фридмана и Уилкоксона. Критерий Фридмана являлся обобщением для критерия Уилкоксона и служил для оценки значимых различий значений показателей в одной и той же группе, но при различных условиях или в динамике.
Результаты
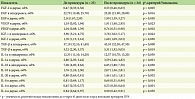
После курса инъекций препарата ГПЧ увлажненность кожи увеличилась до 57 у.е., то есть на 7 у.е. относительно исходных 50 у.е. (p < 0,010). Значимо снизилась глубина морщин кожи лица: «гусиных лапок» – с 2,3 до 1,8 у.е. (р < 0,010), кисетных морщин – с 1,6 до 1,4 у.е. (р < 0,010), морщин в области нижнего века – с 3,5 до 3,0 у.е. (р < 0,010) (табл. 1). Кроме того, уменьшилась степень деформации овала лица – с 2,5 до 2,4 у.е. (р < 0,010) (см. табл. 1).
При оценке клеточного состава периферической крови после курсовой терапии ГПЧ наиболее значимые изменения обнаружены в показателях процентного и абсолютного содержания моноцитов, которые возрастали к 8-м (р1–2 = 0,003 и р1–2 = 0,003 соответственно) и 24-м суткам (р1–3 = 0,000 и р1–3 = 0,013 соответственно) по окончании лечения (табл. 2). При этом активность, интенсивность фагоцитоза и фагоцитарное число моноцитов также статистически значимо увеличивались к 8-му дню (р1–2 = 0,011, р1–2 = 0,008 и р1–2 = 0,009 соответственно) и оставались на высоком уровне к 24-му дню (р1–3 = 0,008, р1–3 = 0,008 и р1–3 = 0,011 соответственно). Абсолютное и процентное число нейтрофилов после курсового применения Лаеннека указывало на тенденцию к их уменьшению на 24-е сутки (р1–3 > 0,050 и р1–3 = 0,042 соответственно). При этом отмечался рост активности фагоцитоза нейтрофилов (р1–3 = 0,028) при достоверном снижении интенсивности фагоцитоза (р1–3 = 0,000) с тенденцией к уменьшению фагоцитарного числа (р1–3 > 0,050) (см. табл. 2).
После применения препарата ГПЧ прослеживалась тенденция к постепенному повышению абсолютного числа Т-клеток (CD3+) в периферической крови на 8-е и 24-е сутки (р > 0,050) (табл. 3). В отношении содержания основных субпопуляций Т-лимфоцитов наибольшие изменения обнаружены в относительном и абсолютном количестве регуляторных Т-клеток (T-reg) (CD4+CD25+CD127–), возраставшем на 8-е (р > 0,050) и особенно значимо на 24-е сутки после терапии (р1–3 = 0,037 и р1–3 = 0,007 соответственно). Относительное количество Т-хелперов (CD3+CD4+), которое повысилось к 8-му дню (р1–2 = 0,017), к 24-му дню стало стремиться к исходному уровню (р1–3 > 0,050). Число цитотоксических Т-лимфоцитов (CD3+CD8+), наоборот, стало снижаться (р > 0,050) (см. табл. 3).
В ходе анализа гуморального иммунитета после терапии ГПЧ не выявлено значимых изменений в количестве В-лимфоцитов (CD19+), IgМ и IgG (р > 0,050). Уровень IgА снизился к 8-м суткам (р1–2 = 0,011) и возрос к 24-м, став даже несколько выше исходного (р1–3 > 0,050) (табл. 4).
Оценка уровня цитокинов периферической крови показала, что концентрация IL-4 повысилась через 8 дней и особенно через 24 дня (р1–2 > 0,050 и р1–3 = 0,006). Концентрация IL-8 увеличилась к 8-му дню (р1–2 > 0,050) и значимо снизилась относительно исходной к 24-му дню (р1–3 = 0,002). Содержание IL-10 достоверно уменьшилось к 8-м суткам (р1–2 = 0,047) и несколько возросло к 24-м суткам (р1–3 > 0,050). Показатели IL-6 сократились практически вдвое через 8 дней (р1–2 > 0,050) и сохранялись на довольно низком уровне и через 24 дня (р1–3 = 0,006).
Проводя анализ изменений, происходящих в коже после курса Лаеннека, мы обнаружили статистически значимое увеличение в дерме объемной плотности коллагена I на 17,4% (с 25,3 до 29,7 об%) (р = 0,002), коллагена III – на 38,6% (с 27,2 до 37,7 об%) (р = 0,001) (табл. 5). Содержание гиалуронидазы и каспазы 8 в дерме, филаггрина и гиалуронидазы в эпидермисе практически не изменилось (р > 0,050). Уровень ламинина в эпидермисе и особенно в дерме после плацентарной терапии значительно возрос. Так, в эпидермисе он увеличился с 11,4 до 14,4 об% (р > 0,050), в дерме – с 1,97 до 2,85 об% (р1–2 = 0,000) (см. табл. 5).
Цитокиновый профиль кожи после курса ГПЧ-терапии представлен в табл. 6. Объемная плотность FGF-2 в дерме значимо увеличивалась с исходных 0,47 до 0,53 об% (р = 0,005). И в эпидермисе, и в дерме наблюдалось выраженное повышение уровня TGF-β (р = 0,000 и р = 0,019 соответственно). В эпидермальном компартменте два ключевых ростовых фактора для кератиноцитов, IGF-1 и EGF, продемонстрировали разнонаправленную динамику. Объемная плотность EGF значимо возросла с 22,79 до 25,2 об% (р = 0,016), IGF-1 – уменьшалась с 3,96 до 3,78 об% (р = 0,022). Уровни ангиогенных и митогенных факторов, VEGF и PDGF, в дерме также изменились. Так, концентрация VEGF увеличилась с 1,18 до 1,91 об% (р = 0,023), PDGF – снизилась с 1,04 до 0,74 об% (р = 0,002) (см. табл. 6).
В эпидермисе содержание IL-1α после ГПЧ-терапии практически не изменилось (р > 0,050), при этом в дерме оно возросло достоверно – с 2,8 до 3,59 об% (р = 0,001). В дерме также значимо увеличилась объемная плотность IL-6 – с 0,45 до 0,53 об% (р = 0,001), IL-20 – с 0,80 до 1,44 об% (р = 0,002). Уровень дермального IL-8 достоверно снизился до 0,68 об% по сравнению с исходным 0,81 об% (р = 0,014). Изменения значений IL-4 и IL-10 после курса Лаеннека не были статистически значимы (р > 0,050) (см. табл. 6).
Оценка бактерицидной активности кожи, которая в известной степени является отражением состояния факторов врожденного иммунитета кожи, антимикробных пептидов, молочной и жирных кислот, после курса инъекций Лаеннека выявила достоверное повышение индекса бактерицидности до 94% относительно исходных 88% (р = 0,035).
Обсуждение результатов
Полученные данные свидетельствуют о том, что курс инъекций Лаеннека значимо корректировал возрастные изменения кожи лица, уменьшая выраженность морщин и усиливая гидратацию кожи, что соотносится с данными других авторов [18–20, 27–29].
Основными структурными белками кожи, определяющими ее плотность и прочность, являются коллагены, из которых в дерме взрослого человека преобладают фибриллярные коллагены I и III [30, 31]. Однако с возрастом количество коллагена, производимого ДФ, снижается, а деградация его усиливается, что является одним из факторов инволюционных изменений кожи, повышения ее дряблости и потери эластичности [31, 32].
Наши исследования показывают, что Лаеннек способствует значимому росту объемной плотности коллагенов I и III в коже. В результате восстанавливаются ее биомеханические свойства.
Старение кожи также сопровождается изменением свойств базальной мембраны эпидермиса и дермо-эпидермального соединения, что приводит к сглаживанию и уменьшению площади контакта между эпидермисом и дермой, хрупкости кожи, нарушению реакций клеток на механические факторы, дисбалансу обмена питательными веществами и кислородом между этими компартментами [30, 33]. Одним из инициаторов сборки базальной мембраны считается ламинин [33], вырабатываемый кератиноцитами и ДФ [32], выполняющий стабилизирующую роль и являющийся адгезивным субстратом для эпителиоцитов [34].
Согласно нашим данным, препарат ГПЧ способствовал повышению содержания ламинина в коже, оказывая таким образом положительное влияние на ее структуру, усиливая дермо-эпидермальное соединение, улучшая плотность контакта клеток эпидермиса, трофику базальных кератиноцитов. Кроме того, наблюдаемое нами после курса Лаеннека увеличение содержания в эпидермисе EGF, который через рецепторы (EGFR), экспрессируемые базальными кератиноцитами, регулирует пролиферацию и дифференцировку последних [35], также, вероятно, способствует обновлению клеток эпидермального компартмента.
Повышение уровня коллагенов I и III и ламинина, источником которых являются ДФ, косвенно доказывает влияние Лаеннека на эти клетки. Ранее было установлено, что Лаеннек воздействует на фибробласты человека, снижая число стареющих клеток при культивировании in vitro [29]. Регуляция работы ДФ in vivo осуществляется посредством ряда цитокинов, эндогенных полипептидных медиаторов межклеточного взаимодействия, к которым относятся интерлейкины, интерфероны, хемокины, факторы роста и дифференцировки [36]. Важнейшим свойством цитокинов считается плейотропность биологического действия. При этом цитокины в основном служат короткодистантными медиаторами, хотя некоторые могут проявлять системную активность [36].
На сегодняшний день факторы роста стали важными терапевтическими средствами, позволяющими избежать старения, так как они отвечают за дифференцировку и созревание клеток, что напрямую коррелирует с минимизацией местных эстетических изменений, возникающих с возрастом [37].
Согласно нашим данным, после курса инъекций препарата ГПЧ в дерме достоверно увеличивалась объемная плотность FGF-2, TGF-β, VEGF, IL-1α, IL-6, IL-20 с одновременным снижением PDGF и IL-8.
FGF-2 уменьшает и предотвращает образование морщин, активируя клетки кожи, стимулируя пролиферацию ДФ и кератиноцитов, играет важную роль в модуляции процессов ангиогенеза и репарации тканей, обладает антивозрастным действием [37, 38]. TGF-β является ключевым цитокином, который активирует экспрессию генов и биосинтез коллагенов в ДФ, ингибирует их деградацию, обеспечивая гомеостаз коллагена [30, 39].
Для обновления и восстановления кожи необходимо адекватное кровоснабжение. Главным механизмом регуляции процессов ангиогенеза является высвобождение факторов, влияющих на эндотелиоциты. Одним из ключевых цитокинов признан VEGF, потенциальный митоген для клеток кровеносных и лимфатических сосудов [40], также обладающий синергичным с TGF-β воздействием [41].
Выявленное нами повышение уровня IL-6 в дерме после инъекций препарата ГПЧ можно рассматривать как доказательство того, что появился еще один возможный инструмент для обновления эпидермиса и коррекции его возраст-ассоциированных изменений. Известно, что этот цитокин, выделяясь из ДФ, играет ключевую роль в пролиферации и дифференцировке кератиноцитов [42]. Кроме того, IL-6 регулирует поляризацию макрофагов в сторону клеток субтипа М2, которые продуцируют TGF-β [43], индуцирует выработку коллагена I [39, 44] и экспрессию генов TGF-β [39] в ДФ. В свою очередь TGF-β способствует продукции фибробластами IL-6 [44]. В ответ на IL-6 фибробласты, кератиноциты и макрофаги экспрессируют VEGF [43].
Помимо влияния на фибробласты TGF-β обладает иммуносупрессорной активностью, являясь одним из ключевых цитокинов Т-reg, и служит элементом обратной регуляции воспалительной реакции [45].
У обследованных нами женщин после курсового введения Лаеннека наблюдалось увеличение количества T-reg с одновременным повышением уровня IL-4 и снижением концентрации IL-6 и IL-8. При этом параллельно повышалось число моноцитов со значимым усилением активности и интенсивности фагоцитоза.
С одной стороны, повышение фагоцитарной активности моноцитов in vitro косвенно может свидетельствовать об усилении их фагоцитарных возможностей in vivo в отношении, в частности, апоптотических телец и другого эндогенного «мусора», накапливающегося при старении, за счет скавенджер-рецепторов на их мембране [46]. С другой стороны, моноциты крови, мигрируя в ткани, превращаются в макрофаги (МФ), которые под воздействием микроокружения способны дифференцироваться в различные функциональные типы: классически активированные провоспалительные (М1-МФ) и альтернативно активированные противовоспалительные (М2-МФ) [46]. При этом T-reg за счет своих цитокинов (IL-4, IL-13, IL-10) и контактных взаимодействий способны регулировать дифференцировку МФ в сторону клеток фенотипа М2 со сниженной продукцией провоспалительных цитокинов/хемокинов (IL-1, IL-6, TNF-α, IL-8) и повышенными фагоцитарными возможностями, направленными в том числе на поглощение и утилизацию апоптозных клеток [46, 47].
В рамках inflammaging подобные процессы рассматриваются как важный механизм уменьшения выраженности системного воспаления, обусловленного хронической активацией в первую очередь клеток врожденного иммунитета. Кроме того, М2-МФ способствуют пролиферации ДФ и образованию ими коллагена I [48], в частности, за счет продукции TGF-β [43], что в контексте возраст-ассоциированных изменений кожи может иметь важное значение для восстановления коллагенового каркаса дермы.
Однако М2-МФ, а также дисрегуляция и устойчивая, опосредованная TGF-β активация клеток могут играть существенную роль в инициации и поддержании фиброгенеза, включающего усиленную инфильтрацию и/или пролиферацию фибробластов, образование миофибробластов и повышение синтеза компонентов внеклеточного матрикса [48, 49]. Поэтому отмечаемое с ростом уровня TGF-β повышение уровня FGF-2 и IL-1α в дерме, обладающих антифибротическим действием [30, 41], и одновременное снижение уровня PDGF, проявляющего прямую и синергичную с TGF-β профибротическую активность [30, 39, 41], вероятно, можно расценивать как компенсаторно-регуляторный механизм, параллельно запускаемый Лаеннеком и способствующий поддержанию кожного гомеостаза.
Выводы
Исходя из сказанного выше, можно сделать следующие выводы.
- Курс инъекций Лаеннека приводит к уменьшению глубины морщин параорбитальной и периоральной области, деформации овала лица, повышает увлажненность кожи.
- При проведении ИГХИ кожи после курсового применения Лаеннека выявляется увеличение в дерме объемной плотности таких структурных компонентов, как коллагены I и III и ламинин.
- При оценке цитокинового спектра в дермальном компартменте наблюдается повышение содержания FGF-2, TGF-β, VEGF, IL-1α, IL-6, IL-20 с одновременным снижением содержания PDGF и IL-8. В эпидермисе возрастает концентрация TGF-β и EGF при уменьшении концентрации IGF-1.
- При микробиологическом исследовании кожи методом агаровых отпечатков после применения Лаеннека выявляется повышение бактерицидной активности кожи.
- При оценке клеточных факторов системного иммунитета после курса инъекций Лаеннека наиболее выраженные изменения в сторону увеличения наблюдаются в числе T-reg и моноцитов с одновременной активацией показателей фагоцитоза последних.
- При изучении гуморальных факторов периферической крови отмечается снижение концентрации провоспалительных IL-6 и IL-8 с одновременным повышением концентрации IL-4.
E.K. Kuznetsova, PhD, E.A. Mezentseva, PhD, Yu.V. Kudrevich, PhD, I.I. Dolgushin, PhD, Prof., O.R. Ziganshin, PhD, Prof., T.A. Zayats, K.V. Nikushkina, PhD
Orenburg State Medical University
South-Ural State Medical University
Chelyabinsk Regional Pathological and Anatomical Bureau
Contact person: Elena A. Mezentseva, alena_mez_75@mail.ru
Age-related changes in face skin are not only an aesthetic but also a social problem, especially for women. The key markers of skin aging are decrease in regenerative potential, impaired barrier function, and loss of elasticity.
With age, the proliferative and metabolic activity of dermal fibroblasts decreases, and structural and compositional remodeling of skin extracellular matrix proteins, primarily collagen, occurs.
Skin aging can be considered in the context of the “inflammaging” theory proposed in 2000 by Italian immunologists led by Franceschi C., according to which body aging is characterized by chronic systemic sterile low-intensity inflammation with activation, first of all, of the innate link of the immune system.
Peptide preparations based on human placenta hydrolyzate are currently used for therapeutic purposes in various branches of medicine. The gerontoprotective, immunomodulatory, anti-inflammatory and regenerative effects of placenta hydrolyzate allowed us to use it to correct age-associated facial skin changes in women.
After a course of 5 intramuscular injections of placenta hydrolyzate into biologically active points of the face, we noted a significant decrease in the depth of wrinkles in the paraorbital and perioral zones, the degree of deformation of the facial oval, an increase in skin hydration and bactericidal activity. In the peripheral blood, a significant increase in the number of regulatory T-lymphocytes and monocytes was observed with a simultaneous increase in the activity and intensity of phagocytosis of the latter; the concentration of pro-inflammatory IL-6 and IL-8 decreased with a parallel increase in the level of IL-4. In the immunohistochemical analysis of the skin in the dermis, the bulk density of collagen I and III, laminin, FGF-2, TGF-β, VEGF, IL-1α, IL-6, IL-20 increased most significantly with a simultaneous decrease in PDGF and IL-8; in the epidermis, increase in the content of TGF-β, EGF and decrease in IGF were observed. Thus, placenta hydrolyzate activates dermal fibroblasts, supports the renewal and trophism of epidermal cells, helps restore the biomechanical and bactericidal properties of aging skin.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


