Комплексная оценка влияния однонуклеотидного полиморфизма гена CLOCK rs1801260 на развитие метаболических нарушений у лиц с ожирением
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследованы 150 человек с признаками хронического десинхроноза и ожирением первой степени по критериям Всемирной организации здравоохранения (индекс массы тела (ИМТ) – 30,0–34,9 кг/м2) в возрасте от 45 до 59 лет.
Хронобиологическую составляющую и качество сна оценивали по результатам теста Хорна – Остберга, Питтсбурского индекса качества сна (PSQI) и Мюнхенского теста для оценки хронотипа, косинор-анализа гликемии. Генотипирование образцов полиморфных маркеров ключевого гена биологических часов CLOCK rs1801260 осуществляли с использованием метода полимеразной цепной реакции в режиме реального времени с помощью системы iCycler Real Time Systemс программным обеспечением iQ5 Manager компании Bio-Rad Laboratories Inc. (Hercules, Калифорния, США). Проведены также антропометрическое исследование, измерение артериального давления, оценка профиля гликемии натощак и через два часа после еды глюкозоксидазным методом на приборе BIOSEN C_line (Германия). С помощью метода высокоэффективной жидкостной хроматографии на анализаторе D-10 Bio-Rad (США) определяли уровень гликированного гемоглобина. Показатели липидного профиля измеряли с помощью автоматического биохимического анализатора SAPPHIRE 400.
Результаты. 85% обследованных предъявляли жалобы на низкое качество сна и частые пробуждения. Ночной сон составлял 6:20 ± 0:14 при доверительном интервале от 6:25 до 6:32. Амплитудно-фазовые показатели гликемии также свидетельствовали о наличии десинхроноза. У лиц с ожирением первой степени без нарушений углеводного обмена с генотипом ТС CLOCK выявлен более высокий ИМТ – 32,5 кг/м2, что на 1,8% больше, чем у носителей генотипа СС, и на 4,0% превышает ИМТ носителей генотипа ТТ (р = 0,001). У носителей гетерозиготного генотипа TС CLOCK окружность талии (ОТ) в среднем составляла 102 см, в отличие от носителей гомозигот ТТ (ОТ – 99 см (р = 0,001)) и СС (ОТ – 96 см (р = 0,001)). Согласно анализу результатов PSQI, неудовлетворительная оценка качества сна преобладала у лиц, гетерозиготных по генотипу TC. Корреляция между СLOCK и увеличением ОТ (r = 0,712; р = 0,001), СLOCK и вечерним хронотипом (r = 0,754; р = 0,001) свидетельствовала о высоком риске развития метаболических нарушений у носителей генотипа ТС.
Заключение. В нашем исследовании однонуклеотидный полиморфизм гена CLOCK rs1801260 ассоциирован с развитием метаболически нездорового фенотипа ожирения у носителей генотипа ТС: более высокий ИМТ – 32,5 кг/м2, корреляция с увеличением уровня липопротеинов низкой плотности и более высокой гликемией натощак. В этой же группе пациенты отмечали снижение качества сна и отсутствие ощущения бодрости в течение дня (суммарное количество баллов по PSQI более шести).
Материал и методы. Обследованы 150 человек с признаками хронического десинхроноза и ожирением первой степени по критериям Всемирной организации здравоохранения (индекс массы тела (ИМТ) – 30,0–34,9 кг/м2) в возрасте от 45 до 59 лет.
Хронобиологическую составляющую и качество сна оценивали по результатам теста Хорна – Остберга, Питтсбурского индекса качества сна (PSQI) и Мюнхенского теста для оценки хронотипа, косинор-анализа гликемии. Генотипирование образцов полиморфных маркеров ключевого гена биологических часов CLOCK rs1801260 осуществляли с использованием метода полимеразной цепной реакции в режиме реального времени с помощью системы iCycler Real Time Systemс программным обеспечением iQ5 Manager компании Bio-Rad Laboratories Inc. (Hercules, Калифорния, США). Проведены также антропометрическое исследование, измерение артериального давления, оценка профиля гликемии натощак и через два часа после еды глюкозоксидазным методом на приборе BIOSEN C_line (Германия). С помощью метода высокоэффективной жидкостной хроматографии на анализаторе D-10 Bio-Rad (США) определяли уровень гликированного гемоглобина. Показатели липидного профиля измеряли с помощью автоматического биохимического анализатора SAPPHIRE 400.
Результаты. 85% обследованных предъявляли жалобы на низкое качество сна и частые пробуждения. Ночной сон составлял 6:20 ± 0:14 при доверительном интервале от 6:25 до 6:32. Амплитудно-фазовые показатели гликемии также свидетельствовали о наличии десинхроноза. У лиц с ожирением первой степени без нарушений углеводного обмена с генотипом ТС CLOCK выявлен более высокий ИМТ – 32,5 кг/м2, что на 1,8% больше, чем у носителей генотипа СС, и на 4,0% превышает ИМТ носителей генотипа ТТ (р = 0,001). У носителей гетерозиготного генотипа TС CLOCK окружность талии (ОТ) в среднем составляла 102 см, в отличие от носителей гомозигот ТТ (ОТ – 99 см (р = 0,001)) и СС (ОТ – 96 см (р = 0,001)). Согласно анализу результатов PSQI, неудовлетворительная оценка качества сна преобладала у лиц, гетерозиготных по генотипу TC. Корреляция между СLOCK и увеличением ОТ (r = 0,712; р = 0,001), СLOCK и вечерним хронотипом (r = 0,754; р = 0,001) свидетельствовала о высоком риске развития метаболических нарушений у носителей генотипа ТС.
Заключение. В нашем исследовании однонуклеотидный полиморфизм гена CLOCK rs1801260 ассоциирован с развитием метаболически нездорового фенотипа ожирения у носителей генотипа ТС: более высокий ИМТ – 32,5 кг/м2, корреляция с увеличением уровня липопротеинов низкой плотности и более высокой гликемией натощак. В этой же группе пациенты отмечали снижение качества сна и отсутствие ощущения бодрости в течение дня (суммарное количество баллов по PSQI более шести).
![Таблица 1. Исходная клиническая характеристика исследуемой группы, М ± SD [95% ДИ]](/upload/resize_cache/iblock/278/195_350_1/Nelaeva1.jpg)
![Таблица 2. Характеристика сна в исследуемой группе по результатам анкетирования, М ± SD [95% ДИ]](/upload/resize_cache/iblock/18a/195_350_1/Nelaeva2.jpg)
![Таблица 4. Хронобиологические параметры гликемии в исследуемой группе, Ме [Q1; Q3]](/upload/resize_cache/iblock/0f5/195_350_1/Nelaeva4.jpg)
Введение
В настоящее время ожирение рассматривается как полигенное заболевание со сложным сочетанием генетических, метаболических, конституциональных, онтогенетических и психосоциальных факторов. При этом генетический полиморфизм и пищевое поведение в большей степени, чем само ожирение, определяют развитие нарушений углеводного обмена и сердечно-сосудистых заболеваний [1, 2].
На сегодняшний день выделяют метаболически здоровый фенотип ожирения, прогностически важными критериями которого являются отсутствие или наличие менее двух из перечисленных показателей, а именно уровень триглицеридов (ТГ) – 1,7 ммоль/л и более, уровень липопротеинов высокой плотности (ЛПВП) – менее 1,29 ммоль/л для женщин и менее 1,03 ммоль/л для мужчин или использование статинов, систолическое артериальное давление (САД) – 130 мм рт. ст. и более, диастолическое артериальное давление (ДАД) – 85 мм рт. ст. и более или гипотензивная терапия, глюкоза в плазме натощак – 5,6 ммоль/л и более или сахароснижающая терапия [3–7].
Особый интерес при изучении метаболических нарушений представляет сочетанное влияние нескольких близко расположенных однонуклеотидных полиморфизмов (ОНП) генов биологических часов. У здоровых лиц гены и белки, обеспечивающие циркадианную регуляцию, участвуют в регуляции сна, пищевого поведения, секреции гормонов, артериального давления и температуры тела. Это позволяет поддерживать циркадианный гомеостаз и адаптироваться к изменению светового режима [8, 9]. Взаимодействие систем обратной связи транскрипции и трансляции белков, в частности генетических комплексов CLOCK/BMAL1 и PER/CRY, является основой молекулярных часов, регулирующих различные физиологические процессы посредством генерации приблизительно 24-часовых циркадных ритмов экспрессии генов. Белок, кодируемый центральным циркадным геном CLOCK (Circadian Locomoter Output Cycles Protein Kaput), кодирует фактор транскрипции семейства базовых спиралей (bHLH) и обладает ДНК-связывающей гистонацетилтрансферазной активностью. Белок CLOCK образует гетеродимер с белком BMAL1 (ARNTL), который связывает на E-box гены Per1, Per2, Per3 и криптохромы Cry1, Cry2, активируя транскрипцию этих генов. Внутриклеточная регуляция синтеза белков, в частности CLOCK/BMAL1 и PER/CRY, подчинена закону петли обратной связи «транскрипция – трансляция» с задержкой во времени (TTFL) и зависит от активности центрального осциллятора циркадианных ритмов – супрахиазматического ядра. Помимо этого существует генератор, способный захватывать пищу (FEO), который определяет так называемую предупредительную активность приема пищи (FAA) и косвенно зависит от нейрогуморальной регуляции уровня лептина, грелина и орексина. Предполагают, что FEO является относительно независимым от супрахиазматического ядра регулятором пищевого поведения и периферических часовых генов кишечника [10, 11].
Дисбаланс в цикле «сон – бодрствование» может привести к нарушению обмена веществ и усилению накопления жировой ткани, а также повлиять на чувствительность тканей к инсулину и обмен глюкозы.
Сокращение продолжительности сна (менее шести часов) признано независимым фактором риска развития нарушений углеводного обмена и сахарного диабета 2 типа [12, 13]. В многочисленных исследованиях установлено, что дефицит сна способствует формированию ожирения вследствие уменьшения циркадной амплитуды лептина, повышения уровня грелина, усиления чувства голода и снижения общей физической активности [14]. Риск нарушений обмена веществ повышается и при избытке сна (более девяти часов), что, возможно, связано с его качеством [15].
Длительность, эффективность и качество сна могут зависеть от генетических особенностей. Исследование конкретных полиморфизмов позволит воспроизвести эти ассоциации.
Интерес могут представлять генетические вариации (замена тимина (T) на цитозин (C) в 3’-некодирующей области) основного хронорегулятора биологических часов – гена CLOCK rs1801260, так как полиморфизмы в данном локусе ассоциированы с изменением пищевого поведения, увеличением окружности талии (ОТ) [16, 17].
При всем разнообразии рассмотренных нами исследований детерминирующая роль часовых генов в развитии метаболически нездорового ожирения остается неясной и требует дальнейшего изучения.
Цель исследования
Целью настоящего исследования стала комплексная оценка влияния однонуклеотидного полиморфизма гена CLOCK rs1801260 на развитие метаболических нарушений у лиц с ожирением.
Материал и методы
Исследование суточного профиля человека (хронотипа) и десинхроноза (CRSWD) предполагало ведение дневника сна и питания, измерение амплитудных и фазовых характеристик биоритмов любым инструментальным способом, использование специальных опросников [18–20]. Оценка хронобиологической составляющей и качества сна проводилась с помощью теста Хорна – Остберга, Питтсбурского индекса качества сна (PSQI) и Мюнхенского теста для оценки хронотипа. Для изучения циркадианных ритмов гликемии и температуры тела участники исследования были обучены технике измерений. Циркадианные ритмы гликемии оценивались с помощью косинор-анализа с использованием показателей статистического срединного ритма (MESOR), амплитуды (максимальной величины отклонения показателя в обе стороны от MESOR) и акрофазы (времени максимального значения показателей в периоде).
Генетические исследования проведены с использованием полимеразной цепной реакции в режиме реального времени на термоцикле для амплификации нуклеиновых кислот в реальном времени с помощью системы iCycler Real Time Systemс программным обеспечением iQ5 Manager компании Bio-Rad Laboratories Inc. (Hercules, Калифорния, США). Полиморфные варианты генов идентифицированы с помощью набора SNP-Screen Kit (Syntol, Москва, Россия). Кроме того, осуществлялось генотипирование образцов полиморфных маркеров ключевых часовых генов rs1801260.
Исследование проведено согласно требованиям Хельсинкской декларации Всемирной медицинской ассоциации и одобрено локальным этическим комитетом ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России (протокол № 117 от 21.11.2023).
Все пациенты подписали информированное согласие на участие в исследовании.
Для выявления типа нарушения углеводного обмена проведен скрининг с антропометрическими измерениями по стандартной программе с использованием ростомера и электронных весов (SECA, Германия).
Профиль гликемии натощак и через два часа после еды оценивали глюкозоксидазным методом на приборе BIOSEN C_line (Германия). Уровень гликированного гемоглобина определяли с помощью высокоэффективной жидкостной хроматографии на анализаторе D-10 Bio-Rad (США).
Показатели липидного обмена (общий холестерин (ХС), триглицериды, липопротеины высокой плотности, липопротеины низкой плотности (ЛПНП)) изучали на автоматическом биохимическом анализаторе SAPPHIRE 400 ферментативным методом. Концентрацию ЛПНП рассчитывали по формуле Фридвальда: общий ХС – ЛПВП – (ТГ : 2,2).
Согласно рекомендациям Всероссийского научного общества кардиологов 2010 г., измерение артериального давления и частоты сердечных сокращений осуществлялось на плечевой артерии в положении сидя в состоянии покоя с использованием полуавтоматического тонометра (AND UA-604, Россия).
Статистическая обработка данных проводилась с помощью пакета прикладных программ SPSS (версия 17.0) с использованием библиотеки статистических функций.
Описательная статистика представлена в виде Ме [Q1; Q3] в случае не гауссова распределения и М ± SD с 95%-ным доверительным интервалом (ДИ) для значений, подчиняющихся законам нормального распределения. Гипотеза о нормальности распределения проверялась с помощью критерия Колмогорова – Смирнова с поправкой Лиллиефорса.
При сравнении количественных данных двух независимых выборок в случае распределения, отличного от нормального, был применен U-критерий Манна – Уитни, в случае нормального распределения – t-критерий Стьюдента.
Корреляционный анализ проведен с помощью рангового коэффициента корреляции Спирмена.
Результаты
Обследовано 150 пациентов в возрасте от 45 до 59 лет.
Критерии включения:
- окружность талии у женщин более 80 см, у мужчин более 94 см, ожирение первой степени по критериям Всемирной организации здравоохранения (индекс массы тела (ИМТ) – 30,0–34,9 кг/м2);
- наличие артериальной гипертензии не выше первой степени или ее отсутствие;
- отсутствие нарушений углеводного обмена (глюкоза цельной капиллярной крови натощак менее 5,6 ммоль/л и через два часа после углеводной нагрузки менее 7,8 ммоль/л).
В таблице 1 представлены антропометрические данные однородной группы, предварительная оценка которой не выявила значимых гендерных различий по основным показателям, поэтому в последующем фактор пола не учитывался. Рост женщин составлял 165 см, мужчин – 168 см.
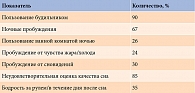
Хронобиологическая составляющая оценивалась по результатам стандартного анкетирования. Особое внимание уделяли продолжительности и качеству ночного сна. Основные параметры, указывающие на наличие десинхроноза, представлены в табл. 2. Более позднее время отхода ко сну и раннее время пробуждения свидетельствовали о недостаточности ночного сна. При наличии времени, проведенного в постели до момента засыпания, этот показатель был еще меньше фактически учитываемого.
В таблице 3 приведены данные за последний месяц о качестве сна, оцениваемом по PSQI. У большинства обследуемых отмечены неудовлетворительность сном и снижение ощущения бодрости в течение дня. Известно, что время воздействия естественного и искусственного освещения, поведение во сне и время активного бодрствования оказывают существенное влияние на метаболическое здоровье.
Обеспечение гомеостаза и регуляция обмена углеводов в организме здорового человека обусловлены высокой стабильностью и низкой вариабельностью уровня глюкозы в крови в течение суток. В нашем исследовании уровень глюкозы в крови натощак у пациентов составил 4,94 ± 0,37 [ДИ 4,86; 5,02] ммоль/л, гликированного гемоглобина – 5,75 ± 0,31 [ДИ 5,69; 5,82]%. Амплитудно-фазовые показатели гликемии представлены в табл. 4. Среднесуточный уровень глюкозы не выходил за рамки референсных значений, однако акрофаза гликемии приходилась на позднее вечернее время – 23:52 [23:37; 0:05].
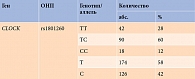
Для понимания циркадной регуляции метаболических нарушений проведено генотипирование rs1801260 гена CLOCK. Как упоминалось ранее, этот полиморфизм может влиять на активность гена CLOCK и приводить к изменению физиологических процессов, а также повышению метаболического риска. В таблице 5 отражены частоты генотипов и аллелей ОНП гена CLOCK rs1801260.
Полученные результаты свидетельствуют о том, что большая часть исследуемых представлена генотипом ТС CLOCK rs1801260 – 90 (60%). На генотип ТТ приходилось 42 (28%) случая, генотип СС – 18 (12%).
При анализе ассоциаций генетических вариаций CLOCK с индексом массы тела у лиц с ожирением первой степени без нарушения углеводного обмена с генотипом ТС СLOCK выявлен более высокий ИМТ – 32,5 кг/м2, что оказалось на 1,8% больше, чем у носителей генотипа СС, и на 4,0% больше, чем у носителей генотипа ТТ (р = 0,001). У носителей гетерозиготного генотипа TС CLOCK окружность талии в среднем составляла 102 см, у носителей гомозигот ТТ – 99 см (р = 0,001), у носителей гомозигот СС – 96 см (р = 0,001).
Выявлены также корреляции генотипа ТС гена СLOCK rs1801260 с ключевыми факторами метаболического риска. Так, зафиксировано увеличение ОТ – 102,3 ± 1,1 см (r = 0,712; р = 0,001), уровня ЛПНП – 2,77 ммоль/л (r = 0,624; р = 0,001), САД – 129,4 ± 0,31 мм рт. ст. (r = 0,509; р = 0,037). В то же время определялась тенденция к повышению гликемии натощак – 5,04 ± 0,27 ммоль/л (r = 0,609; р = 0,037), несмотря на сохранение ее показателя в референсном диапазоне.
У лиц, гетерозиготных по генотипу TC СLOCK, также преобладала неудовлетворительная оценка качества сна (короткая продолжительность, регулярное пользование будильником, ночные пробуждения в связи с чувством жара/холода, регулярные пробуждения от сновидений и снижение ощущения бодрости в течение дня) (в сумме более шести балов по PSQI). В то же время большая часть обследованных с генотипами TT и CC характеризовали свой сон как удовлетворительный (суммарное количество баллов по PSQI менее пяти).
Обнаружена также устойчивая ассоциация генотипа ТС СLOCK с вечерним хронотипом (r = 0,754; р = 0,001), что при перераспределении объема и калорийности пищи на вторую половину дня может стать предиктором ожирения.
Обсуждение
Изучение основных факторов, определяющих энергетический обмен, неизменно приводит исследователей к оценке роли такого хронобиологического феномена, как эндогенные циркадианные ритмы. Синхронизация циркадианных ритмов обеспечивается не только центральным контуром регуляции – супрахиазматическим ядром гипоталамуса (СХЯ), но и периферическими осцилляторами, зависимыми от пищевого поведения и физической активности. Сложные отношения центральных и периферических механизмов регуляции психофизиологических феноменов питания обусловлены, во-первых, системой СХЯ и циркадианных ритмов метаболических тканей, во-вторых, влиянием циркадианных ритмов пищевого поведения и синхронизации метаболических процессов, связанных с патогенезом ожирения и нарушений углеводного обмена. В одном из последних обзоров литературы, посвященном долгосрочной терапии ожирения, большое внимание уделено не только медикаментозной коррекции, но и поиску инновационных методов ведения пациентов с избыточной массой тела, в частности нормализации формулы сна [1].
Нарушения сна и метаболические нарушения напрямую связаны друг с другом. Так, дефицит сна повышает риск развития инсулинорезистентности и ожирения, а сахарный диабет 2 типа ухудшает качество сна и меняет формулу цикла «сон – бодрствование», уменьшает общую продолжительность сна, а за счет снижения резистентности к инсулину в утренние часы увеличивает постпрандиальную гликемию в обеденное время [21].
Однонуклеотидный полиморфизм гена CLOCK rs1801260 часто ассоциирован с высоким риском развития метаболического синдрома, нарушениями сна и психоэмоциональным состоянием. В нашем исследовании генотип ТС CLOCK rs1801260 у лиц с ожирением коррелировал с более высоким ИМТ (32,5 кг/м2), увеличением ОТ (102,3 ± 1,1 см), уровня ЛПНП (2,77 ммоль/л) и гликемии натощак (5,04 ± 0,27 ммоль/л) (р = 0,001).
Наблюдаемые взаимосвязи дают основание считать генотип ТС гена CLOCK rs1801260 фактором метаболического риска. Данный вывод согласуется с результатами проведенных ранее исследований. Так, полиморфизм гена CLOCK был связан с высоким употреблением углеводов в вечернее время и более высокими показателями ИМТ, выраженным потреблением калорий в течение дня и более низким уровнем физических нагрузок [16, 17].
В 2023 г. M. Franzago и соавт. при оценке связи между полиморфизмом гена CLOCK rs1801260, потреблением макроэлементов, факторами, связанными с аппетитом, циркадианным ритмом, продолжительностью сна, а также временем приема пищи у участников с избыточным весом и ожирением установили, что носители аллеля С предпочитали более поздний прием пищи, что по сравнению с носителями аллеля T значительно увеличивало их общее потребление энергии [9].
В 13 независимых исследованиях, напротив, продемонстрирована отрицательная связь ОНП гена CLOCK rs1801260 и риска развития метаболических нарушений [22]. Очевидное противоречие, выявленное при анализе публикаций, посвященных влиянию ОНП гена CLOCK rs1801260, можно объяснить неоднозначной трактовкой поведенческих и молекулярно-генетических факторов развития ожирения и метаболических нарушений, в частности нарушений углеводного обмена. Невозможно определить, что же является первичным в формировании метаболического здоровья и ожирения – нутригеномика или хронобиологические детерминанты пищевого поведения. На наш взгляд, именно воздействие на пищевое поведение может способствовать терапии десинхроноза и ожирения, так как формирование новых пищевых привычек напрямую влияет на активность осциллятора предупредительной активности приема пищи и нейрогуморальную регуляцию метаболических процессов. Кроме того, регуляция пищевого поведения будет способствовать нормализации продолжительности ночного сна.
В нашем исследовании пациенты с генотипом ТС гена CLOCK rs1801260 оценивали свой сон как неудовлетворительный, отмечая снижение ощущения бодрости в течение дня (в сумме более шести баллов по PSQI). В 2023 г. M. Ma и соавт. опубликовали регрессионный анализ, согласно которому продолжительность сна была независимым фактором риска нарушения углеводного обмена и ухудшения секреции инсулина [13]. Возможно, это связано с изменением пищевого поведения в течение суток в виде потребления большего количества калорий, снижением общей физической активности на фоне дефицита сна.
Ожирение как заболевание, определяемое характером питания с недостаточным расходом энергии, зависит и от полиморфизма генов, регулирующих пищевое поведение [23].
В последнее время возросло число публикаций о потенциальной связи между различными хронотипами и рационом питания. Согласно результатам нашего исследования, генотип ТС СLOCK ассоциирован с вечерним хронотипом (r = 0,754; р = 0,001). В работе M. Bodur и соавт. (2021 г.) у лиц с вечерним хронотипом выявлено снижение качества сна (p = 0,040) и ощущения бодрости в течение дня, а также более высокое потребление жиров (p = 0,021) и углеводов (p = 0,033), увеличение общей суточной калорийности пищи (p = 0,013) [24].
E. Molina-Montes и соавт. (2022 г.) при оценке хронотипа и значимости влияния однонуклеотидного полиморфизма гена CLOCK rs1801260 отметили высокую риск-ориентированную роль в формировании метаболических нарушений позднего вечернего хронотипа [25]. Поздний вечерний хронотип был ассоциирован с ожирением и уменьшением продолжительности ночного сна.
Заключение
Метаболическая роль полиморфизма гена CLOCK в локусе rs1801260, описанная в данном исследовании, обозначает вектор дальнейших исследований по оценке влияния наследуемых факторов риска развития и прогрессирования метаболически нездорового ожирения. Изучение хронобиологических параметров и генетических вариаций генов биологических часов у пациентов с ожирением может привести к значительным прорывам в понимании механизмов регуляции биологических процессов, а также к разработке новых способов профилактики, диагностики и коррекции метаболических нарушений. Это будет способствовать улучшению качества и продолжительности жизни таких больных.
Ju.V. Nelaeva, PhD, A.G. Naimushina, MD, PhD, A.A. Nelaeva, MD, PhD, Prof., A.A. Vostrikova, N.S. Novopashina, A.A. Verholanceva, S.A. Vedernikova
Tyumen State Medical University
Multidisciplinary Consultative and Diagnostic Center, Tyumen
Contact person: Julija V. Nelaeva, khasanova76@mail.ru
Aim – to conduct a comprehensive assessment of the impact of single nucleotide polymorphism of the CLOCK rs1801260 gene on the development of metabolic disorders in obese individuals.
Material and methods. We examined 150 people with signs of chronic desynchronosis and obesity of the first degree according to the criteria of the World Health Organization (body mass index (BMI) – 30.0–34.9 kg/m2) aged 45 to 59 years.
The chronobiological component and sleep quality were assessed based on the results of the Horn – Ostberg test, the Pittsburgh Sleep Quality Index (PSQI), the Munich Chronotype Test and cosinor-analysis of glycemia. Genotyping of samples of polymorphic markers of the key biological clock gene CLOCK rs1801260 using real-time polymerase chain reaction iCycler Real Time Systemс with iQ5 Manager software from Bio-Rad Laboratories Inc. (Hercules, CA, USA). An anthropometric study, blood pressure measurement, study of the glycemic profile on an empty stomach and 2 hours after a meal were carried out using the glucose oxidase method on a BIOSEN C_line device (Germany), and glycated hemoglobin was determined using the high-performance liquid chromatography method on a D-10 Bio-Rad analyzer (USA). Lipid profile indicators were measured on an automatic biochemical analyzer SAPPHIRE 400.
Research. 85% of the patients examined complained of poor sleep quality and frequent awakenings. Night sleep was only 6:20 ± 0:14 with a confidence interval of 6:25–6:32. Amplitude-phase indicators of glycemia also indicated the presence of desynchronosis. In persons with degree I obesity without carbohydrate metabolism disorders with the TC CLOCK genotype, a higher BMI of 32.5 kg/m2 was revealed, which is 1.8% more than in carriers of the CC genotype, and 4% exceeds the BMI of carriers of the TT genotype (p = 0.001). In carriers of the heterozygous genotype TC CLOCK, the average waist circumference (WC) was 102 cm, in contrast to homozygotes TT (WC – 99 cm (p = 0.001)) and CC (WC – 96 cm (p = 0.001)). Based on the results of the analysis of the PSQI, it was found that unsatisfactory assessment of sleep quality predominated in individuals heterozygous for the TC genotype. The correlation between CLOCK and an increase in WC (r = 0.712, p = 0.001), CLOCK and evening chronotype (r = 0.754, p = 0.001) indicated an unfavorable course of obesity in carriers of the TC genotype and a high risk of developing metabolic disorders.
Conclusion. In our study, an assessment of the impact of single nucleotide polymorphism of the CLOCK gene rs1801260 showed a high risk of developing a metabolically unhealthy obesity phenotype in carriers of the TC genotype: higher BMI (32.5 kg/m2), correlation with an increase in low-density lipoprotein levels cholesterol and a higher level of fasting glycemia. In the same group, patients noted a decrease in sleep quality and lack of vigor during the day (PSQI > 6).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.