Роль жировой ткани в поддержании гомеостаза углеводного обмена
- Аннотация
- Статья
- Ссылки
- English
Результаты проведенного исследования свидетельствуют, что высокие уровни свободных жирных кислот и лептина в крови являются ранними маркерами нарушения углеводного обмена. Немаловажная роль в этом отводится пищевым привычкам, времени отхода ко сну, хроническому стрессу.
Результаты проведенного исследования свидетельствуют, что высокие уровни свободных жирных кислот и лептина в крови являются ранними маркерами нарушения углеводного обмена. Немаловажная роль в этом отводится пищевым привычкам, времени отхода ко сну, хроническому стрессу.



Введение
Сахарный диабет (СД) и другие нарушения углеводного обмена признаны неинфекционной эпидемией XXI в. Ее преодоление остается актуальной задачей системы здравоохранения всех стран мира.
Нарушение углеводного обмена является не первопричиной, а следствием повреждения организма на клеточном уровне. Патогенетический процесс развивается под влиянием как генетических, так и эпигенетических факторов. К одному из самых распространенных следует отнести нарушение гомеостаза жировой ткани.
Жировая ткань играет ведущую роль в терморегуляции, участвует в синтезе энергии и гормонов, обмене жирорастворимых витаминов, поддержании гомеостаза свертывающей системы крови и построении клеточных мембран. Кроме того, в настоящее время жировая ткань признана самостоятельным метаболическим органом.
Традиционно жировую ткань подразделяют на белую (WAT – white adipose tissue) и бурую (BAT – brown adipose tissue). Данные виды ткани различаются по функциям, анатомической локализации и морфологической структуре.
WAT преимущественно отвечает за запас энергии в виде триглицеридов, BAT – за рассеивание энергии в виде тепла при холод- или диет-индуцированном термогенезе. Количество BAT обратно пропорционально индексу массы тела (ИМТ). Поэтому количество или активность термогенной функции BAT могут способствовать или препятствовать снижению веса [1]. Кроме того, BAT ассоциируется с низким содержанием жировой ткани и низким риском развития СД 2 типа. Метаболические эффекты связаны с повышенным захватом глюкозы и липидов, необходимых для процесса окисления [2]. Не так давно был открыт третий тип жировой ткани – бежевая жировая ткань (beige/brite (brown in white)). Установлено, что при ее стимуляции увеличивается уровень термогенных маркеров. Кроме того, бежевая жировая ткань оказывает положительное влияние на углеводный, липидный и энергетический обмен.
Белая жировая ткань преимущественно располагается в подкожно-жировом слое, сальнике, между органами, бурая и бежевая – в области почек, шее, вдоль верхней части спины, на плечах.
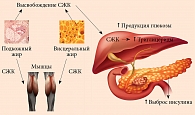
На сегодняшний день одним из триггеров нарушения углеводного обмена признана именно висцеральная жировая ткань. При избытке висцеральной жировой ткани изменяется работа одного из важных регуляторов энергетического обмена – лептина. В норме содержание лептина в общей циркуляции крови подчиняется суточному ритму (увеличение в ночные часы), а секреция носит импульсный характер. Нарушение гомеостаза лептина приводит к метаболическим нарушениям. При ожирении гиперлептинемия и лептинорезистентность обусловливают возникновение относительного дефицита лептина и, следовательно, снижение его физиологических эффектов [3]. У лиц с избыточной массой тела прогрессирование гиполептинемии аналогично нарушению секреции инсулина. Так, снижение физиологических эффектов лептина ассоциируется с уменьшением антилипотоксического эффекта, элиминации глюкозы, увеличением продукции глюкозы печенью, то есть с прогрессированием инсулинорезистентности. Таким образом порочный круг замыкается. В дальнейшем из-за снижения стимулированного инсулином синтеза лептина секреция последнего уменьшается и развивается абсолютная гиполептинемия.
Необходимо отметить, что белая, бурая и бежевая жировые ткани оказывают различное влияние на уровень лептина. Так, при развитии висцерального ожирения уровень лептина возрастает, одновременно повышается и лептинорезистентность. Бурая и бежевая жировые ткани такого воздействия не оказывают.
Если лептин считается одним из главных регуляторов энергетического обмена, то свободные жирные кислоты (СЖК) – одним из главных энергетических субстратов. Свободные жирные кислоты образуются в процессе липолиза триглицеридов (ТГ), накопленных в клетках жировой ткани (посредством аденилатциклазной системы), и их гидролиза (под влиянием липопротеиновой липазы). В физиологических условиях уровень СЖК в крови может повышаться и снижаться очень быстро, удовлетворяя потребность организма в этой форме энергии. Их содержание, как правило, снижается после всасывания углеводов и выброса в ответ на это инсулина и повышается по мере снижения уровня глюкозы в крови. Глюкагон, адреналин, гормон роста и адренокортикотропный гормон также увеличивают уровень СЖК. Главными физиологическими регуляторами содержания СЖК признаны инсулин и адреналин [4].
Хронически высокий уровень СЖК может быть обусловлен нарушением пищевого поведения (избыточным потреблением углеводов) и/или хроническим стрессом, а также низкой физической активностью. Указанные факторы приводят к нарастанию окислительного стресса и неадекватному реагированию организма на действие инсулина. При избытке адипозных тканей их липолиз увеличивается. В норме высвобождение СЖК из адипоцитов строго регулируется, что позволяет обеспечить другие ткани необходимым количеством энергии. Однако при ожирении в кровоток поступает патологически высокое количество сигнальных молекул, особенно фактора некроза опухоли α (ФНО-α), что приводит к нарушению метаболического гомеостаза [5]. Таким образом, изменения, приводящие к нарушению действия инсулина и инсулинорезистентности, сначала происходят именно в адипоцитах задолго до нарушения толерантности к глюкозе. В ряде зарубежных источников отмечено, что повышение СЖК в плазме крови свидетельствует о начале развития метаболического синдрома.
В распределении жирных кислот участвуют преимущественно два гормона: гормон роста и лептин. Первый контролирует мобилизацию жирных кислот из жировой ткани, второй – β-окисление жирных кислот в митохондриях. Таким образом, еще одной важной функцией лептина является удержание ТГ в адипоцитах. Поэтому нормальный уровень лептина обеспечивает защиту органов от избытка жировой ткани. Хронический стресс, переедание, избыток сахара, гиподинамия приводят к нарушению работы лептиновой системы. Развитие резистентности к лептину обусловливает увеличение количества СЖК. Чрезмерное поступление СЖК через воротную вену ассоциируется с развитием печеночной инсулинорезистентности. Под действием СЖК в жировой ткани образуются более крупные адипоциты, резистентные к действию инсулина, инициируется местное воспаление, увеличивается секреция провоспалительных цитокинов, негативно воздействующих на организм. В частности, интерлейкин 6 и ФНО-альфа утяжеляют инсулинорезистентность, ангиотензин II способствует повышению артериального давления и развитию атеросклероза.
Избыток СЖК сопровождается накоплением ТГ в паренхимальных клетках разных видов тканей, а именно в скелетных и кардиальных миоцитах, а также в гепатоцитах, что приводит к их повреждению и хронической дисфункции [6, 7]. В условиях инсулинорезистентности печень начинает активно синтезировать СЖК, ТГ, ускоряется липолиз, но уже в жировой ткани. Печень теряет способность метаболизировать СЖК путем β-окисления, активируется перекисное окисление липидов, в большом количестве продуцируются активные формы кислорода, возникает окислительный стресс. Все это в совокупности приводит к фосфорилированию субстрата инсулинового рецептора и появлению резистентности к инсулину. Таким образом возникает еще один порочный круг.
Согласно результатам последних исследований, нарушение пути передачи инсулинового сигнала преимущественно связано с патологическим метаболизмом СЖК в клетках скелетных мышц, не справляющихся с их утилизацией [4] (рисунок).
Повышенный уровень СЖК приводит к дислипидемии и атерогенезу, что обусловлено снижением уровня липопротеинов высокой плотности, образованием атерогенных частиц липопротеинов низкой плотности и повышением уровня ТГ в плазме крови. Кроме того, в условиях инсулинорезистентности при высоком уровне СЖК в митохондриях макрососудистых эндотелиальных клеток индуцируется синтез активных форм кислорода, что приводит к развитию воспалительного процесса в стенках сосудов [8].
Как было отмечено ранее, одним из факторов, предрасполагающих к нарушению углеводного обмена, является неправильное пищевое поведение. Поэтому для профилактики метаболических заболеваний большое значение придается характеру и режиму питания – соотношению белков, жиров и углеводов, времени приема пищи с учетом хронобиологии. На сегодняшний день наиболее рациональной признана средиземноморская диета – соотношение белков, жиров и углеводов составляет 10:30:60% соответственно. Избыток фруктозы вызывает развитие резистентности к лептину и повышение уровня триглицеридов. При высоком уровне триглицеридов нарушается проникновение лептина через гематоэнцефалический барьер, следовательно, сигнал о насыщении поступает несвоевременно. Такое состояние сопровождается чувством голода и желанием насытиться углеводами как быстродействующими источниками энергии.
Установлено, что лептин играет хрономодулирующую роль в суточных вариациях глюкозы в крови и частоты приема пищи. Поэтому для оптимального контроля уровня глюкозы не рекомендуется нарушать режим питания в течение дня (не более трех раз), пропускать завтрак. Нарушение режима приема пищи связано с усилением инсулинорезистентности и повышением постпрандиальной гликемии в обеденные часы (за счет снижения постпрандиальной инсулинемии и увеличения концентрации глюкагона) [9–12]. Важно также контролировать распределение калорийности принимаемой пищи. Известно, что прием более калорийной пищи в обед и ужин способствует развитию абдоминального ожирения, жирового гепатоза и повышению гликемии в ночные часы [13–15].
Немаловажная роль в развитии нарушений углеводного обмена отводится времени отхода ко сну. Таковое влияет на гликемию натощак и инсулинорезистентность. K.L. Knutson и соавт. установили, что чем позднее время отхода ко сну, тем выраженнее инсулинорезистентность. Это справедливо как в отношении пациентов с СД 2 типа, так и лиц без СД [9, 16, 17].
Целью нашего исследования стало определение роли жировой ткани, хронического стресса, пищевых привычек, времени отхода ко сну в формировании нарушений углеводного обмена.
Материал и методы
Исследование проводилось на базе ГАУЗ ТО «Консультативно-диагностический центр „Эндос“» (Тюмень) с 2015 по 2016 г. В нем приняли участие 40 пациентов с впервые выявленными ранними нарушениями углеводного обмена (РНУО), которые диагностировались по результатам перорального глюкозотолерантного теста (группа РНУО), 40 больных СД 2 типа с длительностью заболевания менее пяти лет (по данным государственного регистра больных СД) (группа СД) и 40 лиц без нарушений углеводного обмена (группа контроля).
Критерии включения в исследование:
- возраст от 40 до 70 лет;
- ожирение первой степени;
- отягощенный семейный анамнез в отношении СД;
- для женщин – рождение детей более 4 кг и/или гестационный СД;
- случаи повышения гликемии по результатам анализа крови;
- подписанное информированное согласие на участие в исследовании.
У всех пациентов определяли антропометрические показатели (окружность талии (ОТ), окружность бедер (ОБ) в см, рост в см и массу тела в кг для расчета ИМТ). Необходимо отметить, что неуниверсальности определения ИМТ с помощью измерения массы тела и роста была посвящена не одна публикация. В них указывалось, что массу тела преимущественно определяют жировая и мышечная ткани, влияние других тканей на таковую незначительно. Наиболее точно оценить наличие абдоминального ожирения позволяет такой простой антропометрический показатель, как отношение окружности талии к окружности бедер. У мужчин при накоплении жировой ткани в абдоминальной области данный коэффициент будет превышать 1,0, у женщин – 0,85.
Помимо антропометрических показателей оценивали биохимические маркеры нарушения углеводного обмена. В венозной крови определяли уровень глюкозы плазмы натощак (ГПН), гликированного гемоглобина (HbA1с), лептина, инсулина. Для оценки уровня глюкозы в крови применяли ферментативный метод с использованием гексокиназы (BIOSEN C_line, Германия), HbA1с – метод высокоэффективной жидкостной хроматографии (BIO-RADD-10, США), лептина – метод иммуноферментного анализа. Для исследования иммунореактивного инсулина (ИРИ) – радиоиммунный метод (BIOSEN C_line, Германия). Значения индекса инсулинорезистентности (НОМA-IR) рассчитывали по формуле: ИРИ × ГПН : 22,5.
Кроме того, каждый участник исследования вел дневник питания, в котором отражалась информация о времени приема пищи, количестве и наименовании продуктов, их калорийности.
Для сравнения результатов трех выборок использовали непараметрический дисперсионный анализ Краскела – Уоллиса, корреляционный анализ Спирмена, а также множественный линейный регрессионный анализ. Критическое значение значимости приняли равным 0,05.
Математическая обработка данных проводилась с использованием компьютерной программы SPSS 22.0, Statistica 6.0.
Результаты и их обсуждение
Исследуемые группы не различались по полу (женщины – 75%, мужчины – 25%) и возрасту (от 40 до 69 лет). Согласно классификации Всемирной организации здравоохранения (ВОЗ) 1997 г., все пациенты страдали ожирением первой степени. Так, ИМТ у лиц без нарушений углеводного обмена в среднем составил 31,35 ± 5,85 кг/м2, у лиц с РНУО – 32,70 ± 5,12 кг/м2, у больных СД 2 типа – 33,21 ± 6,12 кг/м2. Однако на основании классификации ВОЗ 2017 г. значения ИМТ, полученные в трех группах, соответствовали ожирению второй степени (30,1–35,0 кг/м2) (с наличием СД и/или сердечно-сосудистых катастроф).
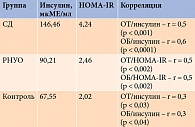
Средние значения лептина, ОТ, ОБ и соотношения ОТ/ОБ представлены в табл. 1.
Средний уровень ГПН в группах контроля, РНУО и СД достигал 4,96 ± 0,46, 5,34 ± 0,48 и 6,89 ± 1,34 ммоль/л, HbA1с – 5,57 ± 0,45, 6,07 ± 0,53, 6,27 ± 1,34% соответственно, что согласуется с диагностическими критериями нарушений углеводного обмена.
Во всех трех группах была отмечена положительная корреляционная зависимость между ИМТ и ОТ, ИМТ и ОБ. При этом чем более выраженными были нарушения углеводного обмена, тем сильнее была эта связь. В группах контроля и СД установлена прямая зависимость ИМТ от возраста, в группе РНУО – соотношения ОТ/ОБ от возраста (табл. 2). Полученные результаты подтверждают, что с возрастом количество и качество жировой ткани претерпевают изменение, масса жировой ткани начинает преобладать над массой мышечной ткани.
Положительная корреляционная зависимость также установлена между уровнем лептина и значениями ИМТ: в группе контроля – r = 0,4 (р < 0,02), в группе РНУО – r = 0,4 (р < 0,007), в группе СД – r = 0,7 (р < 0,0001) соответственно. Это характерно при избыточной массе жировой ткани, приводящей к повышению содержания инсулина и лептина, развитию резистентности к ним и неадекватной ограничительной реакции со стороны гипоталамических центров регуляции жирового обмена [18].
Ожирение играет важную роль в прогрессировании инсулинорезистентности не только у пациентов с СД 2 типа, но и у лиц с предиабетом и без нарушений углеводного обмена. Это также подтверждают полученные нами результаты (табл. 3).
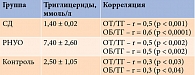
Уровень ТГ в группах контроля, РНУО, СД в среднем составил 2,5 ± 1,05, 7,4 ± 2,6 и 1,4 ± 0,02 ммоль/л соответственно. В группе СД он оказался ниже, что, скорее всего, обусловлено коррекцией дислипидемии на фоне проводившейся терапии.
При анализе данных была установлена связь между инсулинорезистентностью и избыточной продукцией СЖК (табл. 4). Полученные результаты свидетельствуют о наличии избытка СЖК при висцеральном ожирении еще до манифестации СД 2 типа.
Анализ данных дневников питания отражает общую тенденцию – обеднение рациона клетчаткой, белками и жирами. В нем преобладали простые углеводы, фруктоза. Чем серьезнее были нарушения углеводного обмена, тем более выраженным был дисбаланс белков, жиров и углеводов в группах (табл. 5).
Во всех группах суточный калораж пищи в среднем составлял 2200, однако большая часть калорий потреблялась во второй половине дня.
Кроме того, прослеживалась тенденция к более позднему отходу ко сну. Распространенное время засыпания – 23.30.
Заключение
Жировая ткань обладает высокой метаболической активностью. На баланс жировой ткани влияют такие энергетические единицы, как лептин и СЖК. В свою очередь гомеостаз лептина и СЖК зависит от типа и характера распределения жировой ткани.
Результаты проведенного исследования доказывают, что избыток СЖК и лептина в крови можно считать ранним маркером нарушения углеводного обмена. Помимо ожирения на развитие такового влияют нарушение пищевого поведения (избыток углеводов в рационе, дефицит белков и жиров, нарушение распределения калорийности пищи в течение суток, нарушение хронобиологических ритмов приема пищи), время отхода ко сну, хронический стресс.
А.E. Uzhakova, A.A. Nelaeva, DM, Prof., Y.V. Hasanova, PhD
Consultative and diagnostic center ‘Endos’
Tyumen State Medical University
Contact person: Anna Evgenievna Uzhakova, agamzina@yandex.ru
Today, before doctors around the world, remains an urgent task to overcome the epidemic of diabetes and other disorders of carbohydrate metabolism. One of the most common factors predisposing to the formation of carbohydrate metabolism disorders can be attributed to the violation of homeostasis of adipose tissue in the body. Adipose tissue has a high metabolic activity. The balance of adipose tissue is influenced by leptin and free fatty acids (FFA). In the course of our work it was found that the excess of FFA and leptin in the blood can be attributed to the early marker of carbohydrate metabolism disorders. Among the factors that affect the development of carbohydrate metabolism disorders, in addition to obesity, food habits, bedtime, chronic stress can be noted.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.