Консервативная терапия методом катетеризации субтенонового пространства внутриглазных осложнений локального лечения ретинобластомы
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Консервативная терапия методом катетеризации субтенонового пространства (КСП) была выполнена 53 пациентам (54 глаза) с внутриглазными сосудистыми осложнениями локального лечения ретинобластомы. В 9 (26%) случаях развитию осложнений предшествовала химиотерапия. В 40 (74%) случаях внутриглазные осложнения возникли после лучевых методов лечения: у 26 (48%) – после брахитерапии, у 14 (26%) – после стереотакcической радиохирургии. В 16 (30%) случаях показанием к выполнению КСП были внутриглазные геморрагические осложнения различной степени выраженности, а в 38 (70%) – экссудативно-воспалительные осложнения (нейро- и ретинопатия). В течение 9–11 дней четыре-пять раз в день в катетер вводили противовоспалительный (дексаметазон) и гемостатический (этамзилат) препараты.
Результаты. После проведенной консервативной терапии методом КСП положительная динамика отмечалась в 41 (76%) случае. В 13 (24%) случаях положительная динамика не зафиксирована. В девяти глазах в отсутствие динамики была выполнена субтотальная витрэктомия, во всех случаях интраоперационно активной опухолевой ткани не выявлено. В одном из девяти случаев после выполнения витрэктомии через 12 месяцев развились тотальный гемофтальм, рубеоз радужки и субатрофия глазного яблока, что потребовало проведения энуклеации глазного яблока. Всего удалось сохранить 50 (93%) глаз, 4 (7%) глаза были энуклеированы.
Заключение. Консервативная терапия методом КСП показала высокую эффективность (76%), позволив восстановить прозрачность оптических сред и контроль за состоянием опухоли и глазного дна, не прибегая к интраокулярной хирургии и удалению глаза.
Материал и методы. Консервативная терапия методом катетеризации субтенонового пространства (КСП) была выполнена 53 пациентам (54 глаза) с внутриглазными сосудистыми осложнениями локального лечения ретинобластомы. В 9 (26%) случаях развитию осложнений предшествовала химиотерапия. В 40 (74%) случаях внутриглазные осложнения возникли после лучевых методов лечения: у 26 (48%) – после брахитерапии, у 14 (26%) – после стереотакcической радиохирургии. В 16 (30%) случаях показанием к выполнению КСП были внутриглазные геморрагические осложнения различной степени выраженности, а в 38 (70%) – экссудативно-воспалительные осложнения (нейро- и ретинопатия). В течение 9–11 дней четыре-пять раз в день в катетер вводили противовоспалительный (дексаметазон) и гемостатический (этамзилат) препараты.
Результаты. После проведенной консервативной терапии методом КСП положительная динамика отмечалась в 41 (76%) случае. В 13 (24%) случаях положительная динамика не зафиксирована. В девяти глазах в отсутствие динамики была выполнена субтотальная витрэктомия, во всех случаях интраоперационно активной опухолевой ткани не выявлено. В одном из девяти случаев после выполнения витрэктомии через 12 месяцев развились тотальный гемофтальм, рубеоз радужки и субатрофия глазного яблока, что потребовало проведения энуклеации глазного яблока. Всего удалось сохранить 50 (93%) глаз, 4 (7%) глаза были энуклеированы.
Заключение. Консервативная терапия методом КСП показала высокую эффективность (76%), позволив восстановить прозрачность оптических сред и контроль за состоянием опухоли и глазного дна, не прибегая к интраокулярной хирургии и удалению глаза.
Введение
Ретинобластома (РБ) – злокачественная опухоль сетчатки у детей. Благодаря раннему выявлению и своевременному лечению выживаемость пациентов с РБ превышает 95% [1]. Современное лечение РБ предусматривает системную и локальную химиотерапию (ХТ), использование локальных офтальмологических методов – брахитерапии (БТ), криодеструкции, транспупиллярной термотерапии, а в отдельных случаях – современных методик дистанционной лучевой терапии, таких как стереотаксическая радиохирургия (СРХ) [2–5]. Несмотря на органосохраняющую направленность лечения РБ, выполняется также энуклеация глаза при РБ группы E или на более ранних стадиях из-за резистентности опухоли к проводимому лечению либо в случае возникновения осложнений после лечения [1, 6].
Локальные методы лечения РБ могут сопровождаться внутриглазными осложнениями различной степени выраженности и чаще всего проявляются в виде ретинопатии и кровоизлияний в стекловидное тело, которые при выраженности процесса затрудняют визуализацию глазного дна и контроль за состоянием опухолевых очагов в динамике, требуя выполнения энуклеации [1, 6, 7].
Развитие ретинопатии и внутриглазных кровоизлияний связано с повреждением сосудов и самой сетчатки: повреждаются эндотелиальные клетки ретинальных сосудов, впоследствии нарушается их митотическая активность, а также развивается периваскулярное воспаление. Данные изменения приводят к появлению микроаневризм, микрогеморрагий, окклюзий и тромбозов сосудов микроциркуляторного русла. Аддитивный эффект подобных изменений объясняет позднее развитие ретинопатии [8].
Стандартным подходом при наличии витреальных кровоизлияний у пациентов с неопухолевой патологией является микроинвазивная витрэктомия, однако у пациентов со злокачественной опухолью (РБ) интраокулярная хирургия сопряжена с потенциальным риском диссеминации опухоли [9–11].
Таким образом, поиск консервативных методик лечения сосудистых внутриглазных осложнений РБ остается актуальным. На сегодняшний день нет четких рекомендаций по тактике ведения пациентов с внутриглазными осложнениями лечения РБ локальными методами. Как правило, лечение ограничивается инстилляцией глазных капель, что является недостаточно эффективным для купирования осложнений. Наиболее эффективное лечение может быть в максимально ранние сроки, так как при длительно существующей отрицательной динамике не исключены вторичные изменения глазного яблока: фиброзирование стекловидного тела, субтотальная отслойка сетчатки, субатрофия глазного яблока. Из-за нарушенной прозрачности витреальной полости и/или вторичной отслойки сетчатки активные опухолевые очаги могут остаться недиагностированными, но при своевременном выявлении лечение может быть эффективным.
Цель – представить результаты консервативной терапии методом катетеризации субтенонового пространства (КСП) внутриглазных осложнений локального лечения РБ.
Материал и методы
Консервативная терапия методом КСП выполнена 53 пациентам (28 мальчиков и 25 девочек; 54 глаза) с внутриглазными сосудистыми осложнениями локального лечения РБ. К внутриглазным сосудистым осложнениям были отнесены осложнения ретинопатии и осложнения геморрагического характера в виде кровоизлияния в витреальную полость. Медиана возраста пациентов составила 28 (9–87) месяцев. Бинокулярная форма РБ наблюдалась у 31 (58%) пациента, монокулярная – у 22 (42%). Единственные глаза были у 11 (21%) детей. Всего выполнено 73 курса консервативной терапии методом КСП (от одного до пяти). Один курс выполнен в 41 (76%) случае, два курса – в 10 (18%), три – в 1 (2%), четыре – в 1 (2%), пять курсов – в 1 (2%) случае.
В 9 (26%) случаях развитию осложнений предшествовала ХТ. Срок их возникновения варьировал от одного до 11 месяцев (в среднем 4,7 месяца). В 40 (74%) случаях внутриглазные осложнения развились после применения лучевых методов лечения (после ХТ): в 26 (48%) – после БТ развились осложнения в срок от 1,5 до 16 месяцев (в среднем через 3,5 месяца), в 14 (26%) – после СРХ в срок от одного до 16 месяцев (в среднем через 5,7 месяца).
У всех пациентов необходимость проведения консервативной терапии методом КСП с последующим введением лекарственного препарата (ЛП) в катетер была обусловлена интраокулярными осложнениями геморрагического и/или экссудативно-воспалительного характера.
В 16 (30%) случаях показанием к выполнению КСП стали внутриглазные геморрагические осложнения различной степени выраженности: тотальный гемофтальм (n = 12), частичный гемофтальм (n = 3), массивное преретинальное кровоизлияние (n = 1). В 38 (70%) случаях отмечались экссудативно-воспалительные осложнения: непролиферативная ретинопатия (n = 16), непролиферативная ретинопатия в сочетании с нейропатией (n = 17), непролиферативная ретинопатия с экссудативной отслойкой сетчатки (n = 5).
Всем пациентам устанавливали катетер в субтеноновое пространство и в течение 9–11 дней четыре-пять раз в день вводили в него противовоспалительный (дексаметазон) и гемостатический (этамзилат) препараты.
КСП выполнялась в условиях стерильной операционной под общей анестезией по достижении медикаментозного мидриаза. Выполняли разрез конъюнктивы параллельно реберному краю нижнего века длиной 6–7 мм в нижненаружном отделе глаза, после чего с помощью шпателя формировали субтеноновый тоннель к заднему полюсу глазного яблока. Через нижнюю губу конъюнктивального разреза с помощью инъекционной иглы (18 G) выполняли сквозной прокол нижнего века через его наружный отдел. В просвет иглы вводили проводник, иглу удаляли и по проводнику вводили катетер в сформированный субтеноновый тоннель до заднего отдела глазного яблока с последующим удалением проводника. Далее для контроля точного положения края катетера в его полость на всю длину вводили световод, после чего с помощью ретинальной камеры RetCam3 или офтальмоскопии осматривали глазное дно с целью контроля и коррекции положения конца катетера. Появление свечения от световода на глазном дне в области макулы или диска зрительного нерва указывало на то, что катетер расположен максимально близко к склере в заднем отделе глазного яблока. Затем световод вынимали и накладывали шов на конъюнктиву (патент РФ на изобретение № 2785031 от 02.12.2022). Катетер фиксировали с помощью пластыря к коже нижнего века и виска.
Результаты
В 41 (76%) случае зафиксирована положительная динамика в виде резорбции кровоизлияния и экссудации, уменьшения отека диска зрительного нерва и снижения отека сетчатки. В 65% случаев положительная динамика была достигнута после одного курса консервативной терапии (n = 35). В 9% случаев (n = 5) потребовался второй курс для достижения положительной динамики. У одного пациента положительной динамики удалось достичь после проведения четырех курсов консервативной терапии.
В 13 (24%) случаях положительной динамики не наблюдалось при выполнении от одного до пяти курсов консервативной терапии. В 7 (13%) случаях после одного курса отмечалась слабоположительная динамика резорбции кровоизлияния, что потребовало выполнения повторных курсов (два курса в четырех случаях, три – в одном, пять – в одном случае). Решение о проведении дополнительных курсов консервативной терапии принималось индивидуально на основании офтальмоскопической картины глазного дна, а также дополнительных методов инструментального исследования (ультразвуковое исследование глазного яблока и орбит, магнитно-резонансная томография). В девяти глазах после лечения в отсутствие данных о наличии активной опухолевой ткани было принято решение о выполнении субтотальной витрэктомии. Вместе с тем родители пациентов были предупреждены о том, что в случае интраоперационного выявления активной опухоли будет незамедлительно выполнена энуклеация. Во всех девяти глазах интраоперационно данных об активном опухолевом процессе не было получено, что также подтверждалось результатами гистологического исследования. Однако следует отметить, что в одном из девяти случаев после витрэктомии через 12 месяцев развились тотальный гемофтальм, рубеоз радужки и субатрофия глазного яблока, что потребовало выполнения энуклеации глазного яблока.
Консервативная терапия методом КСП позволила купировать достоверно больший процент экссудативно-воспалительных осложнений по сравнению с геморрагическими (p = 0,04, рассчитанное с помощью точного критерия Фишера).
В четырех из 13 случаев, когда отсутствовала положительная динамика, выполнена энуклеация, что составило 7% от всех пролеченных глаз. В двух случаях проведена энуклеация из-за субатрофии глазного яблока, которая развилась через 12 и 13 месяцев. В одном из них субатрофия сочеталась с тотальной экссудативной отслойкой сетчатки, в другом – с рубеозом радужки. В одном случае из-за отсутствия положительной динамики выполнено три курса консервативной терапии по предложенной методике, после чего пациент не приезжал на контрольные осмотры, и энуклеация была выполнена в другом учреждении. Результат гистологического исследования не был предоставлен для оценки наличия активной опухоли, причина энуклеации осталась неизвестной. В одном случае энуклеация проведена после одного курса консервативной терапии по причине наличия активной опухолевой ткани у диска зрительного нерва.
Прогрессирование опухоли через два месяца после консервативной терапии по предложенной технологии имело место у одного пациента, глаз был энуклеирован. При этом экстраокулярной диссеминации и случаев метастазирования не отмечалось ни в одном случае. Все пациенты, пролеченные по разработанной технологии, живы.
Ни в одном случае не зарегистрировано осложнений ни в момент установки катетера, ни при введении ЛП в течение всего курса лечения. Отсутствовали осложнения и в последующем периоде наблюдения, который составил от трех до 185 месяцев (медиана – 38 месяцев).
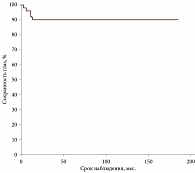
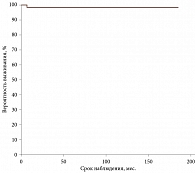
Трех- и пятилетняя сохранность глаз, рассчитанная методом Каплана – Мейера, у пациентов, которым проводилась КСП, составила 90% (рис. 1); трех- и пятилетняя безрецидивная выживаемость, рассчитанная тем же методом, составила 98% (рис. 2).
Обсуждение
В офтальмологической практике существуют различные способы доставки ЛП. Тем не менее поиск оптимального метода доставки, обеспечивающего длительную терапевтическую концентрацию ЛП в структурах заднего отрезка глаза, остается актуальным.
Согласно данным отечественных и зарубежных исследований, при лечении витреоретинальной патологии и болезней зрительного нерва наиболее эффективна локальная доставка ЛП путем интравитреальных и/или субтеноновых инъекций [12–14].
Введение медикаментов в полость стекловидного тела, минуя гематоофтальмический барьер, считается наиболее эффективным, поскольку при этом создается высокая концентрация препарата в тканях заднего отрезка глазного яблока. Впрочем, для поддержания необходимой концентрации ЛП необходимы неоднократные введения, а частое выполнение интравитреальных инъекций увеличивает риск развития осложнений, таких как транзиторное повышение внутриглазного давления, преходящее нарушение остроты зрения разной степени выраженности, помутнения и кровоизлияния в стекловидное тело, разрывы сетчатки и эндофтальмит [15].
Помимо интравитреальных (интраокулярных) существуют периокулярные инъекции: парабульбарные, ретробульбарные и субтеноновые. Преимуществом парабульбарных инъекций является простота и скорость выполнения, однако они эффективнее при заболеваниях переднего отрезка глаза. Преимущество ретробульбарных инъекций заключается в доставке ЛП в задний отдел глазного яблока и орбиты. Однако терапевтическая концентрация в пораженных тканях создается на короткое время, так как основная часть препарата попадает в богатые сосудами ткани орбиты и быстро выводится в системный кровоток [16]. Для достижения положительного эффекта терапии необходимы ежедневные инъекции, а иногда и неоднократные, которые могут приводить к образованию внутриорбитальной гематомы, травматическим повреждениям зрительного нерва и перфорации склеры глазного яблока. Выполнение любых периокулярных инъекций пациентам детского возраста сопряжено с нежелательными последствиями. В связи с этим периокулярные инъекции безопаснее выполнять под наркозом.
Профессором Д.С. Кролем в 1990 г. была разработана ретробульбарная инфузионная терапия, которая заключалась в установлении силиконовой трубки в ретробульбарном пространстве с последующим введением в него ЛП несколько раз в день. Это позволяло избежать ежедневных инъекций в ретробульбарное пространство и повысить концентрацию ЛП [17]. Данный метод хорошо себя зарекомендовал и послужил основой для последующих разработок введения ЛП в периокулярное пространство.
А.П. Нестеров в 1991 г. разработал новый метод введения ЛП в задний отдел орбиты путем субтеноновой имплантации коллагеновой инфузионной системы: в теноново пространство в нижненаружном квадранте глаза вводится трубка с подшитой плоской коллагеновой губкой на конце, через наружный угол глазной щели выводится другой край трубки, в который вводятся ЛП [18].
И.В. Лобанова в своей работе (1997) сравнивала эффективность лечения атрофии зрительного нерва различного генеза у 204 детей при трех различных способах введения ЛП: ретробульбарных инъекциях, ирригационной терапии тенонова пространства и КСП. Самый высокий положительный эффект – 71,8% – был достигнут при ирригационной терапии тенонова пространства, 67,4% – при ирригации в ретробульбарное пространство, 41,5% – при ретробульбарных инъекциях [19].
Позже, в 1998 г., Е.И. Сидоренко модифицировал метод постановки ирригационной системы в теноново пространство. Главным отличием было выведение катетера через ткани над верхним конъюнктивальным сводом без выхода трубочки в конъюнктивальную полость [20].
Т.В. Павлова в 2000 г. провела экспериментальную работу и определила эффективность введения ЛП в ретробульбарное и теноново пространство. Показано, что при введении в ретробульбарное пространство происходит быстрое снижение концентрации ЛП по сравнению с субтеноновым введением [21]. Кроме того, была проведена сравнительная оценка эффективности однократного введения препарата путем ретробульбарной инъекции и дробного введения с помощью автоматического инсулинового дозатора с определением остаточной концентрации введенного вещества в оболочках глаза через час. Показано, что концентрация препарата при методе дробного введения в девять раз выше, чем при одномоментном введении всей дозы препарата [22].
Преимуществом субтенонового введения перед ретробульбарным является то, что введенный ЛП оказывается между двумя бессосудистыми оболочками, что позволяет поддерживать высокую концентрацию препарата в непосредственном контакте со склерой в области заднего полюса и зрительного нерва. Препарат в этом случае попадает в полость глаза путем транссклеральной диффузии. В то же время при ретробульбарном введении часть ЛП выводится орбитальными сосудами [23].
Большая часть публикаций посвящена применению субтеноновых инъекций [19, 22]. Описаний КСП немного [21, 23–25]. Публикаций же, посвященных КСП при осложнениях лечения ретинобластомы, нет.
На сегодняшний день имеется одна отечественная работа о лечении радиоиндуцированных осложнений терапии РБ путем ретробульбарных инфузий, в которой отмечалась высокая эффективность (61%) в виде полного или значительного рассасывания кровоизлияний и уменьшения экссудативно-воспалительных процессов [26].
Особенностью нашего исследования было то, что установка катетера в субтеноново пространство выполнялась под контролем его положения и с последующей коррекцией в случае необходимости. Если конец введенного катетера не прилегал к склере и не доходил до заднего отдела глазного яблока, его положение корректировали. Установка катетера максимально близко к склере у заднего отдела глазного яблока позволяет добиться максимальной инфузии ЛП в зону наибольшей проницаемости склеры.
Подобный подход с точным определением положения катетера позволил добиться полной или частичной резорбции кровоизлияний и/или купирования нейроретинопатии в 76% случаев в отсутствие осложнений и прогрессирования опухоли в средние сроки наблюдения (38 месяцев). В результате удалось не только сохранить глаз в 93% случаев, но также восстановить прозрачность оптических сред и контроль за состоянием опухоли и глазного дна.
Заключение
Результаты исследования купирования внутриглазных осложнений локального лечения РБ методом КСП показали его высокую эффективность (76%). Были восстановлены прозрачность оптических сред и контроль за состоянием опухоли и глазного дна, удалось избежать интраокулярной хирургии и удаления глаза.
A.M. Chochaeva, D.P. Volodin, PhD, U.A. Yataev, A.A. Yarovoy, PhD, V.A. Yarovaya, PhD
Interdisciplinary Scientific and Technical Complex ‘Eye Microsurgery’ named after Academician S.N. Fedorov
Contact person: Denis P. Volodin, volodin.den2016@yandex.ru
Purpose is to present the results of conservative therapy using subtenon catheterization in patients with intraocular complications of focal retinoblastoma treatment.
Material and тethods. Conservative therapy by the method of catheterization of the subtenonal space (SSC) was performed in 53 patients (54 eyes) with intraocular vascular complications of local treatment of retinoblastoma. In 9 (26%) cases, the development of complications was preceded by chemotherapy. In 40 (74%) cases, intraocular complications occurred after radiation treatment: in 26 (48%) after brachytherapy, in 14 (26%) after stereotactic radiosurgery. Intraocular hemorrhagic complications of varying severity were indicated in 16 (30%) cases, and exudative inflammatory complications (neuro- and retinopathy) in 38 (70%) cases. For 9–11 days, anti-inflammatory (dexamethasone) and hemostatic (etamsylate) drugs were injected into the catheter four to five times a day.
Results. After conservative therapy by the method SSC, positive dynamics was observed in 41 (76%) cases. No positive dynamics was recorded in 13 (24%) cases. Subtotal vitrectomy was performed in nine eyes in the absence of dynamics, and no intraoperatively active tumor tissue was detected in all cases. In one of the nine cases, total hemophthalmos, iris rubiosis and eyeball subatrophy developed after vitrectomy 12 months later, which required enucleation of the eyeball. A total of 50 (93%) eyes were preserved, 4 (7%) eyes were enucleated.
Conclusion. Conservative therapy by the method SSC demonstrated high efficacy (76%), allowing to restore the transparency of optical media, tumor and fundus control without intraocular surgery or enucleation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


