Лечение фолликулярной лимфомы
- Аннотация
- Статья
- Ссылки
- English
![Рис. 4. Цитогенетическое исследование (А – реаранжировка гена bcl2 (18q21) обнаружена в 80% клеток (nuc ish (3'bcl2, 5'bcl2)x2 (3'bcl2sep5'bcl2x1)[42/50]). Б – реаранжировка гена IGH (14q32) обнаружена в 84% клеток (nuc ish;(IgHC, IgHV)x2 (IgHCsepIgHVx1)[](/upload/resize_cache/iblock/27c/195_350_1/Batuhtina4.jpg)
Введение
Фолликулярная лимфома (ФЛ) является наиболее распространенной индолентной неходжкинской лимфомой (НХЛ) в западных странах с ежегодной заболеваемостью 3,4–5 случаев на 100 тыс. населения в Европе и США. Средний возраст постановки диагноза составляет 65 лет, но чаще заболевание регистрируется среди лиц молодого возраста. ФЛ относится к гетерогенным заболеваниям с разным прогнозом, на который влияют клинические, лабораторные показатели и параметры заболевания в каждом конкретном случае. Спонтанные регрессии могут возникать примерно у 5–10% пациентов. Пациенты могут изначально находиться под наблюдением, при этом большинству из них потребуется терапия в среднем через три-четыре года после постановки диагноза. Приблизительно у 20% пациентов ранний рецидив наблюдается в течение двух лет после начала терапии первой линии. Таким образом, ФЛ в большинстве случаев имеет затяжное течение с множественными ремиссиями и рецидивами [1]. ФЛ характеризуется диффузной лимфо-аденопатией, поражением костного мозга и спленомегалией. Экстранодальное поражение встречается реже. Цитопения считается относительно распространенной, но конституциональные симптомы лихорадки, ночной потливости и потери веса встречаются редко в отсутствие трансформации в диффузную В-крупноклеточную лимфому [2].
Клинический случай
Пациент М., 42 лет, в январе 2018 г. направлен в Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского (КККОД) с жалобами на увеличение лимфоузлов в левой надключичной, подмышечной и паховой областях. При осмотре отмечались отечность мошонки, полового члена, нижних конечностей, в паховых областях диффузно увеличенные лимфоузлы плотные, в надключичных областях справа и слева лимфоузлы до 1 см в диаметре, в подмышечных областях лимфоузлы до 3 см конгломератами. В КККОД выполнено обследование. Рентгенография грудной клетки от 30 января 2018 г. показала наличие жидкости в плевральной полости слева до 5-го ребра. Плевральная полость дренирована, справа жидкость не определяется. Ультразвуковое исследование органов брюшной полости от 22 января 2018 г. выявило асцит, очаговое образование в печени 1,1 см. Состояние пациента средней степени тяжести обусловлено двусторонним плевритом и асцитом. В анализах крови – лейкоцитоз 10,44 × 109/л (норма 4–9 ×109/л), повышение уровня креатинина до 119 мкмоль/л (норма 61–106 мкмоль/л), снижение уровня общего белка крови до 52,5 г/л (норма 64–83 г/л).
1 февраля 2018 г. выполнена инцизионная биопсия лимфоузла надключичной области слева. В отношении удаленных лимфатических узлов проведены рутинное гистологическое исследование, иммуногистохимическое исследование с панелью антител: CD3, CD20, CD21, CD23, CD5, Cyclin D1, bcl2, bcl6, Ki67, MUM1, CD10. В отношении материала, полученного при отсроченной эксцизионной биопсии, дополнительно осуществлены цитогенетические (FISH) исследования с оценкой реаранжировки генов c-MYC (8q24), BCL2 (18q21), BCL6 (3q27), IGH (14q32).
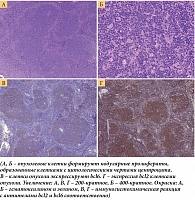
При гистологическом исследовании биоптата лимфоузла, полученного при эксцизии в 2018 г., отмечались следующие изменения. Рисунок гистологического строения лимфоузла стерт за счет нодулярной пролиферации опухолевых клеток с цитологическими характеристиками центроцита с примесью единичных центробластов. Нодулярные структуры без отчетливой зоны мантии, вариабельной формы и размеров, с различной плотностью расположения. При иммуногистохимическом исследовании – ко-экспрессия клетками, образующими фолликулярные структуры: мембранно CD20, ядерно bcl6, цитоплазматически интенсивно bcl2. Экспрессия интерфолликулярными Т-лимфоцитами CD3 и CD5. В основе опухолевых нодулей определяется организованная сеть фолликулярных дендритных клеток. Гистиоцитами и эндотелиоцитами экспрессируется Cyclin D1. Индекс пролиферации опухолевых клеток по экспрессии ядерного белка Ki67 – 10–15%. На основании проведенного исследования установлен диагноз фолликулярной лимфомы (цитологический тип 1) с фолликулярным типом роста (рис. 1).
Установлен диагноз: фолликулярная лимфома четвертой стадии (цитологический тип 1) с фолликулярным типом роста, поражением надключичных, подмышечных, паховых лимфоузлов, асцит, двусторонний плеврит, промежуточный риск по FLIPI.
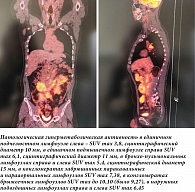
C 19 февраля по 22 июня 2018 г. в КККОД проведено шесть курсов R-CHOP в первой линии терапии. Далее пациент получил два курса ритуксимаба 700 мг один раз в 21 день в монорежиме. После лечения выполнено контрольное обследование. По данным ПЭТ-КТ (позитронно-эмиссионная томография – компьютерная томография) от 19 ноября 2018 г. выявлена метаболическая активность радиофармпрепарата в участках уплотнения корня брыжейки и брыжейки поперечно-ободочной кишки, в подмышечных и паховых лимфоузлах с обеих сторон.
С учетом частичного ответа была начата поддерживающая терапия ритуксимабом один раз в два месяца. Через шесть месяцев выполнено контрольное обследование. По данным ПЭТ-КТ с введением фтордезоксиглюкозы (ФДГ) от 5 февраля 2020 г., генерализованное поражение шейно-надключичных, забрюшинных, подвздошных лимфоузлов, тотальный гидроторакс справа.
ПЭТ-КТ-картина расценена как прогрессирование заболевания. С 28 февраля по 12 июня 2020 г. пациенту в рамках терапии второй линии проведено шесть курсов по схеме R-CHOP, с 2 июля 2020 г. – два курса ритуксимаба в монорежиме. После лечения проведен контрольный осмотр. ПЭТ-КТ с ФДГ от 27 августа 2020 г. показала положительную динамику – уменьшение размеров и метаболической активности поражения лимфоузлов, частичный ответ. В сентябре 2020 г. пациент получил консультацию с помощью средств телемедицины ФГБУ «НМИЦ гематологии». Рекомендовано проведение двух курсов R-DHAP с целью консолидации. С 12 октября по 6 ноября 2020 г. проведено два курса по схеме R-DHAP. В декабре 2020 г. выполнено контрольное обследование. Данные ПЭТ-КТ с ФДГ от 8 декабря 2020 г.: по сравнению с исследованием от 27 августа 2020 г. динамика положительная – регресс пораженных лимфоузлов, полный ответ. С декабря 2020 г. пациенту повторно проведены телемедицинские консультации ФГБУ «НМИЦ гематологии» для решения вопроса о тактике лечения. Во время консультаций осуществлен пересмотр гистосканов, морфологический диагноз подтвержден. С учетом морфологической картины опухоли (при пересмотре материала в ФГБУ «НМИЦ гематологии» картина фолликулярной лимфомы 1–2-го цитологического типа с фолликулоподобным ростом), положительной динамики после двух курсов R-DHAP и гипоплазии костного мозга рекомендована поддерживающая терапия. C 1 апреля 2021 г. в КККОД проведено четыре курса поддерживающей терапии. В октябре 2021 г. пациенту выполнено контрольное обследование. ПЭТ-КТ с ФДГ от 11 октября 2021 г. по сравнению с исследованием от 28 июня 2021 г. показала отрицательную динамику (рис. 2).
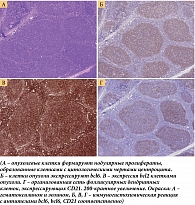
Учитывая возможность трансформации фолликулярной лимфомы, 9 ноября 2021 г. в КККОД выполнили биопсию лимфоузла верхней трети шеи слева с целью подтверждения рецидива заболевания. При исследовании лимфатического узла, удаленного в 2021 г., иммуноморфологическая картина в целом соответствовала наблюдавшейся в 2018 г. Рисунок гистологического строения лимфатического узла небольших размеров изменен за счет нодулярной пролиферации клеток с преимущественно центроцитарными цитологическими характеристиками и наличием единичных центробластов. Опухолевые клетки экспрессируют CD20, bcl6, bcl2, CD10 и не экспрессируют Cyclin D1, MUM1, CD3. Ki67 – до 20%. В основе опухолевых фолликулов определяется оформленная сеть фолликулярных дендритных клеток, экспрессирующих CD21, CD23 (рис. 3). На основании результатов исследования уставлен диагноз фолликулярной лимфомы, цитологический тип 1–2.
При цитогенетическом исследовании реаранжировка гена IGH (14q32) обнаружена в 84% опухолевых клеток, гена BCL2 (18q21) – в 80% опухолевых клеток (рис. 4). Реаранжировки генов c-MYC (8q24) и BCL6 (2q27) не выявлены.
Рецидив заболевания подтвержден. Согласно международным клиническим рекомендациям NCCN 2020 [3], пациенту начали терапию по схеме «обинутузумаб + бендамустин».
Обсуждение
Фолликулярная лимфома относится к индолентным лимфомам, однако течение заболевания и прогноз у пациентов могут значительно отличаться. Клиническая агрессивность опухоли увеличивается с количеством центробластов, согласно цитологическому типу фолликулярной лимфомы от 1 до 3. Важными факторами, негативно влияющими на исход заболевания, признаны возраст старше 60 лет, третья или четвертая стадии, число вовлеченных лимфатических зон (более четырех), повышенный уровень лактатдегидрогеназы и уровень гемоглобина ниже 120 г/дл, объединенные в шкалу FLIPI. Кроме того, к факторам неблагоприятного прогноза относятся наличие определенных генетических поломок (делеция ТР53) и высокая опухолевая нагрузка по критериям GELF (любой конгломерат лимфоузла более 7 см, три или более очага диаметром свыше 3 см, наличие В-симптомов, спленомегалия, симптомы сдавления, плевральный или перитонеальный выпот, лимфоцитоз и нейтропения). В рассматриваемом случае у пациента определена фолликулярная лимфома низкого грейда (цитологического типа) – 1, ТР53-делеция не обнаружена. В то же время у пациента выявлены два из пяти факторов риска по шкале FLIPI, что позволяло отнести его к группе промежуточного риска с прогнозом двухлетней общей выживаемости (ОВ) 92% и двухлетней безрецидивной выживаемости 70%. Терапия была начата безотлагательно. Пациент достаточно быстро спрогрессировал на терапии первой линии по схеме R-CHOP. Несмотря на эффективность лечения на основе комбинации ритуксимаба и химиотерапии в случае индолентных НХЛ, в том числе ФЛ, значительная часть пациентов становятся устойчивыми к лечению или возникает рецидив заболевания. Для улучшения беспрогрессивной выживаемости и соответственно прогноза пациентов непрерывно идет поиск наиболее эффективных вариантов терапии первой линии.
В 2017 г. были опубликованы результаты прямого сравнительного слепого рандомизированного исследования обинутузумаба и ритуксимаба в комбинации с химиотерапией в первой линии терапии ФЛ с последующей моноиммунотерапией в поддержке с участием 1202 пациентов (GALLIUM). Обинутузумаб – первое гликоинженерное гуманизированное анти-СД20-моноклональное антитело 2-го типа. Показано, что комбинация обинутузумаба и химиотерапии с последующей поддержкой позволяет на 34% снизить риск рецидива, прогрессирования или смерти по сравнению со схемами иммунохимиотерапии и поддержкой на основе ритуксимаба. К сожалению, на момент постановки диагноза данному пациенту в 2018 г. схемы лечения ФЛ в первой линии терапии с обинутузумабом не входили в российские клинические рекомендации. Эта опция появилась в отечественных рекомендациях в 2020 г. Однако в большинстве случаев заболевание прогрессирует. В связи с этим требуется эффективная последующая терапия. Применение обинутузумаба в комбинации с химиотерапией у пациентов, рефрактерных к ритуксимабу, позволяет достигать ответа в 93–98% случаев. На данный момент, согласно международным рекомендациям NCCN 2020 [3], одной из предпочтительных схем лечения второй и последующих линий терапии является схема «обинутузумаб + бендамустин». В открытом рандомизированном исследовании III фазы GADOLIN сравнивали эффективность и безопасность индукции комбинации обинутузумаба и бендамустина с последующей поддерживающей терапией обинутузумабом и только индукцией бендамустином. Показано, что при медиане наблюдения 31,8 месяца медиана выживаемости без прогрессирования (ВБП) в группе обинутузумаба и бендамустина была выше, чем в группе бендамустина, – 25,8 и 14,1 месяца соответственно. В группе обинутузумаба и бендамустина риск прогрессирования или смерти снизился на 43%, отмечалась также польза от лечения в отношении ОВ, риск смерти снизился на 33% [4].
В последующих линиях изучали несколько новых препаратов. Некоторые из них продемонстрировали обнадеживающие результаты в монорежиме или комбинации. Леналидомид – иммуномодулирующий агент. В исследовании III фазы AUGMENT пациенты были разделены на две группы. Пациенты первой группы получали леналидомид в комбинации с ритуксимабом, пациенты второй – плацебо в комбинации с ритуксимабом. Леналидомид способствовал значительному повышению ВБП – 39,4 против 25,3 месяца [5]. В исследовании II фазы GALEN отмечалась эффективность комбинации обинутузумаба и леналидомида при рецидивирующей ФЛ: через два года бессобытийная выживаемость составила 62,3%, ВБП – 64,7%, ОВ – 86,9%. В отличие от ритуксимаба обинутузумаб усиливает антителозависимую клеточную цитотоксичность, фагоцитоз и прямое уничтожение В-клеток [6]. Персонализированный подход к лечению пациентов с ФЛ основан на биологии заболевания, характеристиках пациента и других факторах. В настоящее время появляются данные исследований I/II фазы нового класса моноклональных антител, применяемых при НХЛ, – биспецифических моноклональных антител, которые одновременно связывают CD20-рецепторы В-клеток и CD3-рецепторы Т-клеток, вызывая опосредованное Т-клетками уничтожение опухолевых В-лимфоцитов. В частности, новое биспецифическое моноклональное антитело мосунетузумаб в монотерапии показало стойкий полный ответ у больных с рефрактерными и рецидивирующими НХЛ, включая фолликулярнную лимфому [7]. Таким образом, перспективы в лечении ФЛ на данный момент представляются весьма обнадеживающими.
R.A. Zukov, PhD, Prof., Yu.V. Batukhtina, PhD, V.A. Khorzhevsky, PhD
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Siberian Scientific and Clinical Center of the FMBA of Russia
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
The article presents a clinical case of treatment of indolent non-Hodgkin's lymphoma (follicular lymphoma) stage IV at a young age with a relapsing course of the disease with a partial response and no tumor transformation. The prospects for the treatment
of follicular lymphoma at the moment are very interesting and quite encouraging.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


