Широкое иссечение первичной меланомы кожи как залог лучшей выживаемости пациентов
- Аннотация
- Статья
- Ссылки
- English
Целью исследования являлся анализ влияния широкого иссечения опухоли и пластических методов закрытия операционного дефекта тканей у пациентов с первичной МК после удаления опухоли в сравнении с пациентами, у которых пластика не применялась.
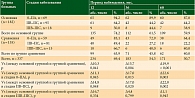
Материал и методы. В исследовании использованы данные 337 пациентов с первичной МК 0–IIIC стадий, рандомизированных на две группы: основную (с применением широкого иссечения опухоли с последующим пластическим закрытием послеоперационного дефекта тканей) и группу сравнения (со стандартным отступом от края опухоли и линейным ушиванием дефекта тканей). Проведено сравнение двух групп по показателям пятилетней выживаемости без прогрессирования (ВБП) и скорректированной общей выживаемости (ОВ).
Результаты и их обсуждение. Установлено, что применение широкого иссечения с последующим пластическим замещением дефекта тканей у пациентов с локализованными формами МК улучшает результаты пятилетней ВБП от 22,0 до 22,6% (p < 0,05), а в стадии 0–IIA и пятилетней скорректированной ОВ до 13,1% (p < 0,05).
Выводы. Выполнение широкого иссечения первичной МК с последующим пластическим замещением дефекта тканей уменьшает натяжение краев раны и грубое рубцевание, ускоряет послеоперационное заживление, может являться независимым прогностическим фактором, улучшающим ВБП и ОВ пациентов с первичной локализованной формой МК, а также методом выбора среди прочих.
Целью исследования являлся анализ влияния широкого иссечения опухоли и пластических методов закрытия операционного дефекта тканей у пациентов с первичной МК после удаления опухоли в сравнении с пациентами, у которых пластика не применялась.
Материал и методы. В исследовании использованы данные 337 пациентов с первичной МК 0–IIIC стадий, рандомизированных на две группы: основную (с применением широкого иссечения опухоли с последующим пластическим закрытием послеоперационного дефекта тканей) и группу сравнения (со стандартным отступом от края опухоли и линейным ушиванием дефекта тканей). Проведено сравнение двух групп по показателям пятилетней выживаемости без прогрессирования (ВБП) и скорректированной общей выживаемости (ОВ).
Результаты и их обсуждение. Установлено, что применение широкого иссечения с последующим пластическим замещением дефекта тканей у пациентов с локализованными формами МК улучшает результаты пятилетней ВБП от 22,0 до 22,6% (p < 0,05), а в стадии 0–IIA и пятилетней скорректированной ОВ до 13,1% (p < 0,05).
Выводы. Выполнение широкого иссечения первичной МК с последующим пластическим замещением дефекта тканей уменьшает натяжение краев раны и грубое рубцевание, ускоряет послеоперационное заживление, может являться независимым прогностическим фактором, улучшающим ВБП и ОВ пациентов с первичной локализованной формой МК, а также методом выбора среди прочих.

Введение
Стандартным методом лечения первичной меланомы кожи (МК) является хирургическая резекция [1]. До конца прошлого века считалось важным широкое иссечение первичной МК до 5 см от края опухоли, а минимизация отступления вела к увеличению рецидивов и снижению выживаемости [2]. Если отступы незначительны, то к пластике прибегать нет необходимости [3–5]. Другие авторы ратуют за повышение радикальности за счет расширения объема иссечения в сторону оттока лимфы из-за метастазов «в пути» [5]. Объем хирургического вмешательства не может являться единственным самостоятельным фактором, от которого зависит прогрессирование заболевания [6]. Многие хирурги голосуют за персональный подход при выборе способа хирургии и пластики дефекта, допускающий удаление обширных участков кожи, что увеличивает радикальность вмешательства, минимизирует осложнения, связанные с натяжением краев раны и, как следствие, c формированием грубых рубцов, улучшает качество жизни больных и ускоряет реабилитацию пациентов [5, 7].
Любое хирургическое вмешательство неизбежно является по своей сути повреждением тканей, которое сопровождается естественной воспалительной реакцией организма и лимфангиогенезом как этапом заживления послеоперационной раны. Неразрешенное воспаление, длительный лимфангиогенез способствуют возникновению недоразвитых, патологических сосудов и ухудшению иммунологического состояния, что также приводит к неудовлетворительным результатам. Лимфатические сосуды играют главную роль в санации тканевой жидкости, удалении воспалительных цитокинов и регуляции врожденного и приобретенного иммунитета [8]. Наличие в лимфоидном инфильтрате большого количества воспалительных клеток, стимулирующих неоангиогенез, является прогностически неблагоприятным фактором, может индуцировать опухолевый рост и способствует повышению инвазивности и агрессивности течения опухолевого процесса [9]. К этому могут приводить такие процессы, как рубцевание [10] и лимфатическая недостаточность как результат рубцевания лимфатических сосудов после операции [11]. В результате происходит недостаточность как острого, так и хронического иммунного ответа [12].
В патогенезе образования рубцов важное значение имеет механическая сила на растяжение [13]. Дермальные фибробласты человека – это механочувствительные клетки, которые являются неотъемлемой частью образования гипертрофических рубцов [14]. При усилении жесткости тугая и неэластичная кожа создает напряжение для дермальных фибробластов, что способствует их чрезмерной активации и приводит к увеличению генерации коллагена и фибронектина [15]. В результате усиливается жесткость кожи [16], появляется устойчивая петля положительной обратной связи, что может индуцировать дальнейший ангиогенез [17], который способствует пролиферации клеток, тем самым создавая большую потребность в кислороде. На ранней стадии формирования рубца задействованные факторы воспаления также вносят вклад в ангиогенез [18], в то время как новообразованные микрососуды проявляют эндотелиальную дисфункцию [19], приводящую к стойкому воспалению. Все аспекты сливаются в порочный круг образования рубца, и решающим фактором является патологический ангиогенез [20]. Продолжительное воспаление ведет к повышенной плотности лимфатических сосудов, расширению и гиперплазии лимфатической сосудистой сети [21], увеличению лимфооттока [22] и метастазированию в регионарные лимфатические узлы, что коррелирует с худшей выживаемостью [23]. Кроме того, чрезмерное рубцевание может иметь неприятные физические последствия (зуд, скованность, контрактуры рубцов, болезненность и боль), а также эстетические, психологические и социальные [24].
Таким образом, первоочередной задачей всегда должно быть предотвращение аномального образования рубцов с помощью широкого спектра мер, которые снижают воспаление и обеспечивают быстрое закрытие раны, уменьшение риска инфекционных осложнений, и хирургических приемов, предотвращающих натяжение краев раны. Одним из таких способов является применение пластических приемов в хирургическом лечении первичной МК, влияние которых на выживаемость пациентов еще предстоит выяснить.
Материал и методы
Проанализировано влияние пластического замещения дефекта послеоперационной раны в сравнении с классическим «простым» линейным ушиванием у пациентов с первичной МК на выживаемость без прогрессирования (ВБП) и скорректированную общую выживаемость (ОВ) для пациентов с МК, исключая IV стадию. На рисунке 1 представлен дизайн исследования.
Основным критерием включения в исследование считалось наличие письменного информированного согласия на участие, одобренного локальным этическим комитетом Алтайского государственного медицинского университета Минздрава России (выписка из протокола № 8 от 10.07.2017).
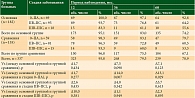
В исследовании использованы данные 337 пациентов, рандомизированных методом слепого отбора на две группы: основную – 182 (54,0%) пациента (операция широкого удаления опухоли заканчивалась пластикой дефекта тканей) и группу сравнения – 155 (46,0%) (линейное ушивание дефекта после стандартного иссечения опухоли).
В анализ включены 118 (35,0%) мужчин, из них 64 (35,2%) в основной группе и 54 (34,8%) в группе сравнения; 219 (65,0%) женщин, из них 118 (64,8%) в основной группе и 101 (64,5%) в группе сравнения.
Пациентов в возрасте 18–35 лет было 7,7% (26 больных): одинаково по 7,7% в обеих группах; в возрасте 36–
55 лет – 32,0% (108 больных): 33,0% в основной группе и 31,0% в группе сравнения; в возрасте 56–75 лет –
50,1% (169 пациентов): 50,5 и 49,7%; старше 75 лет – 10,1% (34 больных): 8,8 и 11,6% соответственно.
Пациентов с дефицитом массы тела (шкала оценки индекса массы тела А. Кетле, 1869 г.) в когорте было три человека (0,5% в основной и 1,3% в группе сравнения); пациентов с нормальной массой тела – 22,8% (77 человек): 22,5 и 23,2%; пациентов с предожирением и ожирением 1-й степени больше всего – 60,2% (203 человека): 59,9 и 60,6%; пациентов с ожирением 2–3-й степени – 16% (54 больных): 17 и 14,8% соответственно. Среди общей когорты больных у 13,6% (46) не зарегистрировано сопутствующей патологии (14,8% в основной группе и 12,3% в группе сравнения), изолированные заболевания сердечно-сосудистой системы зарегистрированы у 59,6% (201) (у 58,2 и 61,3% соответственно); сочетание двух или нескольких заболеваний – у 16,3% пациентов (у 17,0 и 15,5%); иные патологии – у 10,4% (35) (у 9,9 и 11,0% соответственно).
Пациентов с 0 стадией было 22 (6,5%): 6,6% в основной группе и 6,5% в группе сравнения; с I стадией – 67 (19,9%): 19,8 и 20,0% (с IA стадией – по 11,0% в обеих группах, с IB стадией – 8,8 и 9,0%); со II стадией – 215 (63,8%): 63,7 и 63,9% (с IIA стадией – 11,5 и 11,6%, со IIB стадией – 20,3 и 20,6%; со IIC стадией – 31,9 и 31,6%); пациентов с III стадией – 9,8% (9,9 и 9,7%): с IIIB стадией – 3,8 и 3,2%; с IIIC стадией – 6,0 и 6,2% соответственно. Пациентов с IIIA стадией не было зарегистрировано ввиду отсутствия выполнения биопсии сторожевого лимфоузла.
МК туловища зарегистрирована у 168 (49,9%) пациентов: у 47,2% пациентов основной и 52,9% группы сравнения; МК конечностей – у 130 (38,6%) (42,3 и 34,2% соответственно); опухоли головы и шеи – у 30 (8,9%): у 8,2 и 9,6%; акральные локализации выявлены в 9 (2,7%) случаях: у 2,2 и 3,2% соответственно.
При патологоанатомическом исследовании было диагностировано четыре гистологических типа МК: поверхностно-распространенная, по типу злокачественного лентиго, узловая форма и акрально-лентигинозная. Всего 76 (22,6%) случаев поверхностно-распространенной формы меланомы (24,7% – в основной группе и 20,0% – в группе сравнения), меланома в виде злокачественного лентиго в 9 (2,7%) случаях (по 2,7% в обеих группах), узловая форма меланомы кожи в подавляющем большинстве случаев – 74,2% (250 пациентов) (72,5 и 76,1%), акрально-лентигинозных – два случая (0,6%) – все они были в группе сравнения (1,3%).
Пациентов с толщиной опухоли ≤ 2 мм – 108 (32,0%): 31,3 и 32,9%; толщиной более 2 мм – 227 (67,4%): 68,7 и 65,8%. С неизвестной толщиной было два пациента в группе сравнения (1,3%), что составило 0,6%.
Среди всех пациентов у 188 (55,8%) опухоль была с изъязвлением: у 55,5% пациентов основной и 56,1% группы сравнения; а у 149 (44,2%) изъязвления в опухоли не было: у 44,5 и 43,9% соответственно.
Отсутствие лимфоидной инфильтрации в опухоли было у 32 (9,5%) пациентов: у 9,3 и 9,7%; слабо выраженная лимфоидная инфильтрация выявлена у 149 (39,5%): 42,3 и 35,5%. Не было данных у 21 (6,2%) пациента: 4,4 и 8,3%. Мутация BRAF определялась у 55 (16,3%), Кi-67 – у 48 (14,2%). В общей когорте выполнялись оперативные вмешательства с удалением первичной опухоли (92,6%), одновременным удалением первичной опухоли и регионарной лимфаденэктомией (ЛАЭ) при подтвержденном регионарном метастазировании (7,4%). В основной группе вмешательства первого типа выполнены в 93,4% (170) случаев, в группе сравнения – в 91,6% (142); удаление первичного очага с регионарной ЛАЭ в основной группе – в 6,6% (12) случаев, в группе сравнения – в 8,4% (13).
При иссечении первичной опухоли (337) руководствовались критериями хирургического отступа от края опухоли индивидуально в каждом конкретном случае (в зависимости от локализации опухоли, ее толщины по данным ультразвукового исследования и визуальным, в том числе по дерматоскопическим, признакам наличия или отсутствия изъязвления). При толщине опухоли до 2 мм и отсутствии изъязвления хирургический отступ был около 1 см от края опухоли, и в 46 (13,6%) случаях послеоперационный дефект удалось закрыть без применения пластических методов. Причем на конечностях и туловище при использовании линии Лангера образовывался эллипсовидный дефект кожи, при котором перпендикулярно силовым линиям хирургический отступ составлял до 1 см, а вдоль линии – до 3–4 см. При опухолях более 2 мм и при наличии избытка кожи в окружающих тканях также производился эллипсовидный разрез вдоль линии Лангера, но с отступом до 2 см в поперечнике и до 6–8 см по длиннику дефект закрывался без применения пластики (таких вмешательств было 101 (30,0%)). Направление разреза соответствовало пути лимфооттока от опухоли (для формирования адекватного без натяжения рубца). Случаи, когда при иссечении опухоли отступ был несколько больше стандартного и образовывался дефицит тканей для обычного ушивания без натяжения, потребовали пластических приемов. Таким образом, в 161 (47,8%) случае дефект был укрыт кожно-подкожно лоскутом с перемещением, а в 21 (6,2%) прибегли к свободной кожной пластике. В 12 случаях с пластикой после иссечения первичной опухоли произведена регионарная ЛАЭ (в восьми случаях удаления первичного очага с пластикой произведена операция Дюкена, из них в двух случаях было сочетание с аутодермопластикой; в четырех произведена подмышечная ЛАЭ). При операциях без пластики (155) обычных иссечений было 147 (43,6%), из них с регионарной ЛАЭ 10 (3,0%) (семь с подмышечной ЛАЭ, одна с операцией Крайля и две с операцией Дюкена), пять (1,5%) экзартикуляций пальцев стопы, из которых две в сочетании с операцией Дюкена, три (0,9%) выполнены на ушных раковинах: две с сегментарными резекциями ушной раковины и одна с ампутацией и операцией Крайля.
Группы были статистически сопоставимы по полу, возрасту, индексу массы тела, наличию сопутствующей патологии, стадии заболевания, локализации первичной опухоли, ее гистологической структуре, толщине, изъязвлению, лимфоидной инфильтрации, а также структуре оперативных вмешательств и адъювантному лечению (p ˃ 0,05).
Группы сравнения были разделены на подгруппы, соответствующие стадиям: 0–IIA, IIB–IIC и IIIB–IIIC. Оценивалась ВБП, на которую влияла негативная динамика (НД) течения заболевания: момент возникновения местного рецидива, транзиторных, регионарных или отдаленных метастазов. Оценивалась скорректированная ОВ, которая была обусловлена смертью больного от МК.
Результаты и их обсуждение
Выживаемость без прогрессирования
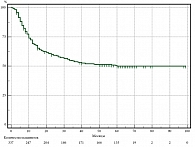
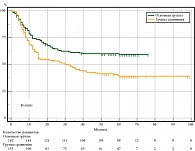
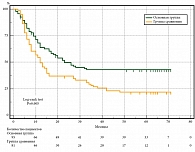
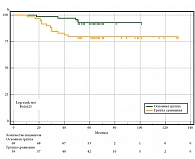
Из всех пациентов, включенных в исследование, в первый год наблюдения НД была отмечена у 30,6%. В период трехлетнего наблюдения НД выявлена у 45,7%. В период пятилетнего наблюдения – у 49,3% пациентов. ВБП в эти периоды составила 69,4, 54,3 и 50,7% соответственно. У пациентов из основной и сравниваемой групп в период наблюдения после операции до 12, 36 и 60 месяцев ВБП была больше на 10,3% (74,2 и 63,9% соответственно, р = 0,041), на 15,7% (61,5 и 45,8%, р = 0,004) и на 19,9% (59,9 и 40,0% соответственно, р ˂ 0,001) соответственно. Медиана выживаемости в основной группе не достигнута, а в группе сравнения составила 30 (13,9–46,1) месяцев наблюдения (табл. 1, рис. 2, 3).
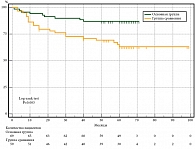
При подгрупповом анализе по стадиям у пациентов с 0–IIA стадией в основной группе в период наблюдения после операции до 12, 36 и 60 месяцев ВБП была больше, чем у пациентов в группе сравнения, на 11,1% (94,2 и 83,1% соответственно, р = 0,045), на 17,0% (89,9 и 72,9%, р = 0,013) и на 22,6% (87,0 и 64,4% соответственно, р = 0,003). Медиана выживаемости не достигнута в обеих группах сравнения (табл. 1, рис. 4).
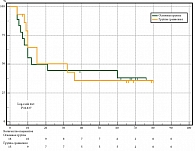
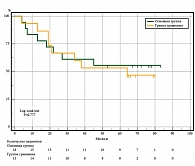
У пациентов с МК в основной по сравнению с контрольной группой с IIB–IIC стадией в период наблюдения до 12, 36 и 60 месяцев ВБП была больше на 14,8% (64,2 и 49,4% соответственно, р = 0,048), на 17,0% (44,2 и 27,2%, р = 0,020) и на 22,0% (44,2 и 22,2% соответственно, р = 0,002). Медиана выживаемости в основной группе достигнута на 23 месяцах (14,8–31,2), в группе сравнения – на 12 месяцах (8,5–15,5) (рис. 5).
У пациентов с IIIb–IIIc стадией МК в основной группе в сравнении со второй группой ВБП в период наблюдения до 12 месяцев была меньше на 16,7% (50,0 и 66,7% соответственно, р ˃ 0,050). В период до 36 месяцев была больше на 4,4% (44,4 и 40,0% соответственно, р ˃ 0,050). В период наблюдения до 60 месяцев была меньше на 1,1% (38,9 и 40,0% соответственно, р ˃ 0,050). Медиана выживаемости в основной группе достигнута на 12 месяцах (0–34), в группе сравнения – на 15 месяцах (5,9–58,5) (рис. 6).
Общая выживаемость
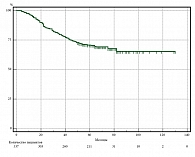
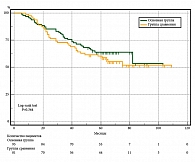
Среди всей когорты больных в период до 12 месяцев ОВ составила 95,8%, в период до 36 месяцев – 79,5%, до 60 месяцев – 70,9%, а медиана выживаемости не достигнута (табл. 2, рис. 7). У больных из основной группы с пластикой по сравнению с пациентами из группы без пластики ОВ в период наблюдения после операции до 12 месяцев была ниже на 1,7% (95,1 и 96,8%, р ˃ 0,050), в период до 36 и 60 месяцев была выше на 7,5% (83,0 и 75,5%, р ˃ 0,050) и на 7,1% (74,2 и 67,1%, р ˃ 0,050). Медиана выживаемости не достигнута (рис. 8).
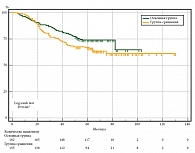
При подгрупповом анализе по стадиям у пациентов с МК с 0–IIA стадией в основной группе по сравнению с пациентами без пластического замещения дефекта показатели ОВ в период наблюдения после операции до 12, 36 и 60 месяцев были выше на 1,7% (100,0 и 98,3% соответственно, р ˃ 0,050), на 14,0% (97,1 и 83,1%, р = 0,007) и на 13,1% (92,8 и 79,7% соответственно, р = 0,029). Медиана выживаемости в группах не достигнута (рис. 9).
У пациентов с IIB–IIC стадией МК из основной группы в сравнении с контрольной – без пластики в период наблюдения до 12 месяцев ОВ была ниже на 2,6% (93,7 и 96,3% соответственно, р ˃ 0,050). В период до 36 и 60 месяцев была выше на 4,0% (76,8 и 72,8%, р ˃ 0,050) и на 3,7% (64,2 и 60,5% соответственно, р ˃ 0,050). Медиана выживаемости в группах не достигнута (рис. 10).
У пациентов с IIIB–IIIC стадией МК из основной группы в сравнении с группой сравнения (без пластики) ОВ в период наблюдения до 12 месяцев была меньше на 10,0% (83,3 и 93,3% соответственно, р ˃ 0,050). В период до 36 и 60 месяцев была больше на 1,1% (61,1 и 60,0%, р ˃ 0,050) и на 2,3% (55,6 и 53,3%, р ˃ 0,050) соответственно. Медиана выживаемости в группах не достигнута (рис. 11).
Заключение
Таким образом, у пациентов основной группы с пластикой, при которой удалялось большее опухолевое окружение, явно исключалось натяжение краев раны в области оперативного вмешательства, что предотвращало образование грубых послеоперационных рубцов, по нашему мнению, улучшало кровоснабжение в зоне резекции, уменьшало местную ишемию тканей и процент возникновения локорегионарных рецидивов. Полученные данные соотносятся с литературными [8–10], а соответственно ВБП была выше, чем в группе сравнения (без пластики), в период наблюдения до 12, 36 и 60 месяцев на 10,3% (р = 0,041), 15,7% (р = 0,004) и 19,9% (р ˂ 0,001) соответственно, с тенденцией к улучшению этого показателя в долгосрочной перспективе без влияния на ОВ в общем по группам.
При подгрупповом анализе по стадиям ВБП была больше у пациентов с выполненной пластикой по сравнению с пациентами без пластики на всем протяжении наблюдения до пятилетнего рубежа. У пациентов с 0–IIA стадией в период до 12, 36 и 60 месяцев разница между группами составила 11,1% (р = 0,045), 17,0% (р = 0,013) и 22,6% (р = 0,003) соответственно. Причем в этой подгруппе обнаруживается статистически достоверная разница и в ОВ через 18 месяцев после операции, которая сохраняется до конца периода наблюдения: до 36 и 60 месяцев на 14,0% (р = 0,007) и 13,1% (р = 0,029) соответственно в пользу пациентов с пластикой. У пациентов с IIB–IIC стадией МК из основной группы по сравнению с пациентами из группы сравнения в период до 12, 36 и 60 месяцев ВБП была больше на 14,8% (р = 0,048), 17,0% (р = 0,020) и 22,0% (р = 0,002) соответственно. Медиана выживаемости в основной группе достигнута в 23 месяца (14,8–31,2), в группе сравнения – в 12 месяцев (8,5–15,5) без влияния на скорректированную ОВ в обеих группах.
Выводы
- Использование широкого иссечения и пластических методов закрытия дефекта тканей у пациентов с первичной МК увеличивает объем удаления паратуморозного окружения, уменьшает натяжение краев раны и грубое рубцевание, ускоряет послеоперационное заживление.
- У пациентов с локализованными формами МК 0–IIС стадий при первичном иссечении опухоли использование широкого иссечения и пластических методов закрытия дефекта тканей улучшает показатели пятилетней ВБП от 22 до 22,6% (p ˂ 0,050), а при 0–IIA стадиях – на 13,1% (p ˂ 0,050) по сравнению с пациентами без использования пластических методик закрытия дефектов тканей.
- Широкое удаление с пластическим замещением дефекта тканей при иссечении первичной локализованной МК может являться операцией выбора.
S.A. Yargunin, PhD, I.V. Reshetov, PhD, Ya.N. Shoikhet, PhD, S.N. Pyatakov, PhD
Krasnodar Clinical Oncological Dispensary No. 1
I.M. Sechenov First Moscow State Medical University
Altai State Medical University
Sochi City Hospital No. 4
Contact person: Sergey A. Yargunin, syargya@yandex.ru
Melanoma is one of the most deadly human skin tumors, and surgery remains the first and main method in its combined treatment. Despite the seemingly radical nature of surgical interventions in patients with primary skin melanoma, the frequency of locoregional recurrence and metastasis remains high.
Material and methods. The study used data from 337 patients with stage 0–IIIC primary skin melanoma, randomized into 2 groups: the main group (using wide excision of the tumor followed by plastic closure of the postoperative tissue defect) and the comparison group (with standard indentation from the edge of the tumor and linear suturing of the tissue defect).
Results. It was found that the use of wide excision followed by plastic replacement of a tissue defect in patients with localized forms of skin melanoma shows the best results of a 5-year progression-free survival from 22.0 to 22.6% (p ˂ 0.05), and in stages 0–IIA and in 5-year adjusted overall survival to 13.1% (p ˂ 0.05).
Conclusions. Performing a wide excision of primary skin melanoma followed by plastic replacement of a tissue defect reduces the tension of the wound edges and rough scarring, accelerates postoperative healing, may be an independent prognostic factor that improves progression-free survival and overall survival of patients with primary localized form of skin melanoma, and also be the method of choice among others.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.