Современная фармакотерапия при гранулематозе с полиангиитом
- Аннотация
- Статья
- Ссылки
- English
У многих пациентов своевременная анти-В-лимфоцитарная терапия высокоэффективна и позволяет достичь стойкой ремиссии. Не менее перспективной представляется анти-С5а-терапия.
В статье представлен клинический случай гранулематоза с полиангиитом у молодого больного с развитием деструкции легких, быстрой положительной клинической и лабораторной динамикой на фоне адекватной патогенетической терапии.
У многих пациентов своевременная анти-В-лимфоцитарная терапия высокоэффективна и позволяет достичь стойкой ремиссии. Не менее перспективной представляется анти-С5а-терапия.
В статье представлен клинический случай гранулематоза с полиангиитом у молодого больного с развитием деструкции легких, быстрой положительной клинической и лабораторной динамикой на фоне адекватной патогенетической терапии.
Введение
Гранулематоз с полиангиитом (ГПА), ранее известный как гранулематоз Вегенера, представляет собой некротизирующий васкулит сосудов малого и среднего калибра, ассоциированный с антинейтрофильными цитоплазматическими антителами (АНЦА). Номенклатура АНЦА-ассоциированных системных васкулитов включает гранулематоз с полиангиитом, микроскопический полиангиит и эозинофильный гранулематоз с полиангиитом (синдром Черджа – Стросса) [1].
Первое наблюдение было сделано немецким студентом Х. Клингером в 1931 г. Пять лет спустя немецкий патологоанатом Ф. Вегенер описал три случая особого поражения мелких и средних сосудов с гранулематозным воспалением и определил это заболевание как отдельную форму васкулита [2]. Современная номенклатура системных васкулитов представлена на конференции в г. Чапел-Хилл (США) в 2012 г., где также впервые официально был введен термин «гранулематоз с полиангиитом» [3].
Как было отмечено ранее, существенную роль в патогенезе гранулематоза с полиангиитом играют АНЦА. Выделяют классические, или цитоплазматические, АНЦА к протеиназе 3 и перинуклеарные АНЦА к миелопероксидазе, эластазе и другим ферментам. Атакуя нейтрофилы, АНЦА приводят к их дегрануляции и разрушению с развитием воспалительных реакций. Наиболее важную роль в патогенезе, предположительно, играют В-клетки, поскольку они продуцируют АНЦА, вызывают дисбаланс в подтипах Т-клеток и/или цитокин-хемокиновых сетях. Относительно недавно была установлена роль альтернативного пути комплемента, что способствовало инициации исследований антагониста человеческого рецептора C5a (авакопана), продемонстрировавших обнадеживающие результаты [4].
ГПА отмечается среди всех расовых групп, однако чаще им страдают представители европеоидной расы. В Европе распространенность ГПА составляет 5–10 случаев на 100 тыс. населения. При этом в Северной Европе частота встречаемости патологии выше. Так, ежегодная первичная заболеваемость составляет 0,5 случая на 100 тыс. населения. Большая распространенность ГПА по сравнению с иными системными васкулитами в странах Северной Европы и России, вероятно, связана с лучшей информированностью врачей о данной нозологии и диагностическими возможностями [5, 6].
Патология с одинаковой частотой встречается у лиц обоего пола, может наблюдаться в разных возрастных группах.
Клинические особенности
ГПА характеризуется некротизирующим гранулематозным поражением дыхательных путей, васкулитом и гломерулонефритом. Поскольку в подавляющем большинстве случаев при ГПА в патологический процесс вовлекаются верхние дыхательные пути, поражение лор-органов может быть первым клиническим проявлением [7]. Поражение полости носа и околоносовых пазух отмечается более чем в 80% случаев, органов слуха – примерно в 35% [6, 8].
Вовлечение в патологический процесс легких наблюдается у 60–80% больных в виде маломанифестных и манифестных клинических форм, а также угрожающего жизни кровотечения. Клинические проявления включают кашель, кровохарканье, инспираторную одышку и боль в груди [9]. К рентгенологическим признакам ГПА следует отнести округлые очаги и образования, довольно часто с явлениями полостного распада, существенно реже с изменениями в легких в виде консолидации и/или матового стекла [5, 9–13].
Нарушения со стороны почек наблюдаются у 80% больных, причем при всех вариантах АНЦА-ассоциированных васкулитов имеет место сходная клинико-морфологическая картина. ГПА может манифестировать с гломерулонефрита. Последний может присоединиться в ходе развертывания клинической картины ГПА.
Для ГПА типично формирование периорбитальной гранулемы, которая в ряде случаев может вызывать необратимую утрату зрения [9, 11].
Вследствие локализации патологического процесса в области орбит, лор-органов нередко возникают невриты V и VII пар черепно-мозговых нервов, а также мононевриты иных локализаций.
Поражение кожи представлено в виде язвенно-геморрагической экзантемы.
При ГПА системное воспаление также повышает риск поражения пищеварительной и сердечно-сосудистой систем [9, 11].
Диагностика
Диагноз ГПА устанавливается с помощью клинической оценки, серологических тестов на АНЦА с цитоплазматическим типом иммунофлуоресцентного свечения и гистологического исследования [9]. При биопсии слизистых оболочек в зоне поражения выявляются признаки васкулита и гигантоклеточные некротизирующие гранулемы, почек – пролиферативный гломерулонефрит с полулуниями, а также фибриноидный некроз капилляров клубочка и артериол [9].
Выживаемость
При поражении почек десятилетняя выживаемость больных составляет 40%, в его отсутствие – до 70% [8, 9].
Ведение больных
С учетом полисистемности поражения, агрессивного течения и серьезности прогноза для своевременной диагностики и эффективного лечения ГПА необходим мультидисциплинарный подход, включая участие не только ревматологов, но и оториноларингологов, челюстно-лицевых хирургов, стоматологов, нефрологов, а также офтальмологов [7, 9, 11].
В настоящее время стандартное лечение тяжелого ГПА для достижения ремиссии включает непродолжительную индукционную терапию глюкокортикоидами в сочетании с анти-В-клеточными препаратами (ритуксимабом), реже с циклофосфамидом.
Так, в ряде исследований было продемонстрировано, что индукционные режимы с уменьшенными дозами глюкокортикоидов не уступают ранее использовавшимся более высокодозным схемам.
В качестве поддерживающей терапии в серии исследований установлено превосходство ритуксимаба над азатиоприном или метотрексатом [4].
Необходимы также мероприятия по снижению риска развития коморбидных заболеваний и осложнений [9–11]. Известно, что легочные полости склонны к инфицированию, а инфекционные осложнения – важнейшая причина летальности. Именно поэтому ограничивается использование неселективных иммуносупрессоров (циклофосфамида, метотрексата, азатиоприна и др.) [5, 13]. Нередки и другие проявления мощной иммуносупрессии, в частности саркома Капоши [14, 15].
Современные генно-инженерные средства отличаются более высокой безопасностью и эффективностью. В частности, в post hoc-анализе, проведенном X. Puéchal и соавт., из 194 пациентов с ГПА ремиссия через шесть (± два) месяцев была достигнута у 73,1% принимавших ритуксимаб и 40,1% получавших циклофосфамид (относительный риск 1,82 при 95%-ном доверительном интервале 1,22–2,73, разница рисков 33,0% при 95%-ном доверительном интервале 12,2–53,8%) [16]. Аналогичные результаты были достигнуты в подгруппах пациентов с впервые диагностированным ГПА и длительным его течением.
Использование анти-С5а-агента авакопана может стать новым бесстероидным терапевтическим подходом.
C. Alihosseini и соавт. проанализировали результаты 52-недельного клинического испытания ADVOCATE и 12-недельного клинического испытания CLEAR с целью оценки безопасности и эффективности нового анти-С5а-агента авакопана [17]. В исследовании ADVOCATE частота достижения ремиссии составила 65,7 и 54,9% в группах авакопана и плацебо соответственно. В исследовании CLEAR значения Бирмингемского индекса активности васкулита улучшились на 50% и более у 86,4% принимавших авакопан и 70,0% получавших преднизолон.
Селективные ингибиторы C5a можно рассматривать в качестве средств для монотерапии васкулитов [18]. В настоящее время препарат авакопан в Российской Федерации не зарегистрирован.
Клинический случай
Проведено наблюдение за пациентом Л. 37 лет с ГПА, у которого отмечались полиорганное поражение и прогрессирующая деструкция типичных для ГПА локусов. Согласно результатам мультиспиральной компьютерной томографии (МСКТ), адекватная патогенетическая терапия ритуксимабом способствовала быстрой положительной динамике, что согласуется с данными литературы [19].
В 2019 г. пациент Л. отметил выделения из носа, периодически – корочки в носу. Оториноларингологом выполнена МСКТ, по результатам которой выявлена картина острого синусита. Назначены антибактериальные препараты без контроля эффективности.
Через несколько месяцев повышение температуры до 39 °С с эпизодами по несколько дней. Больной связывал это с переохлаждением. Самостоятельно принимал жаропонижающие препараты. За шесть месяцев похудел на 30 кг.
В конце 2019 г. появились кашель с мокротой, одышка при незначительной физической нагрузке, повышение температуры сохранялось.
В январе 2020 г. пациент Л. был госпитализирован в пульмонологическое отделение с подозрением на пневмонию, по поводу которой получал антибактериальную терапию. В общем анализе крови отмечалась легкая анемия (уровень эритроцитов – 4,0 × 1012/л, гемоглобина – 106 г/л), небольшой лейкоцитоз (12,4 × 109/л) с палочкоядерным сдвигом (10%), увеличение скорости оседания эритроцитов до 62 мм/ч. В общем анализе мочи минимальные протеинурия, лейкоцитурия, эритроцитурия. Фтизиатр исключил туберкулезную этиологию процесса, а оториноларинголог выявил двусторонний гайморит и этмоидит справа в сочетании с повышением титра АНЦА-антител и установил диагноз ГПА. Пациент Л. был переведен в ревматологическое отделение Иркутской городской клинической больницы № 1, где в дальнейшем проходил стационарное лечение.
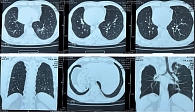
В отделении больному была выполнена МСКТ придаточных пазух носа. Обнаружены признаки искривления носовой перегородки влево, сфеноидита, фронтита, ринита и разрушения медиальных стенок обеих верхнечелюстных пазух. Согласно результатам МСКТ органов грудной клетки, выявлены затемнение обоих легких с очагами деструкции и медиастинальная лимфаденопатия.
На консилиуме установлен диагноз: гранулематоз с полиангиитом, высокая активность, ринит, полисинусит, деструкция медиальных стенок верхнечелюстных пазух, правосторонний тубоотит, очаговая инфильтрация легких с полостями деструкции, медиастинальная лимфаденопатия, миокардит, лихорадка, похудение, анемия легкой степени, нефрит с мочевым синдромом (скорость клубочковой фильтрации, рассчитанной по формуле по CKD-EPI, – 123 мл/мин/1,73 м2, хроническая болезнь почек С1), АНЦА-антитела (антитела к протеиназе 3), антинуклеарные антитела.
С целью индукции ремиссии проведена пульс-терапия метилпреднизолоном в дозе 250 мг и циклофосфамидом в дозе 1000 мг. Далее назначен метилпреднизолон в дозе 48 мг/сут per os. Разработана схема снижения дозы глюкокортикоидов. Рекомендованы препараты кальция и витамина D, а также профилактический прием сульфаметоксазола/триметоприма. На фоне низкой активности болезни рекомендована вакцинация от пневмококковой инфекции и гриппа. Составлен план дальнейшего ведения пациента, и рекомендовано амбулаторное наблюдение ревматолога по месту жительства.
Предполагалось, что во время следующей госпитализации будет инициирована анти-В-клеточная терапия. Однако с повторной госпитализацией возникли трудности в связи с продолжительным периодом противоэпидемических мероприятий по поводу COVID-19, что соответствовало ситуации в других медицинских учреждениях [20].
В период пандемии связь с пациентом была утрачена.
На фоне позитивной динамики после индукционной терапии пациент Л. нерегулярно принимал препараты, у профильного специалиста не наблюдался.
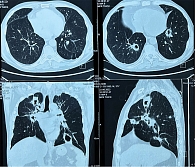
В июне 2022 г. больной был госпитализирован в хирургическое отделение с диагнозом «легочное кровотечение». Проведена эмболизация легочной артерии, и больной был переведен в ревматологическое отделение с жалобами на головную боль, боль в тазобедренных суставах. Согласно результатам МСКТ органов грудной клетки, имели место множественные неправильной и округлой формы полостные очаги диаметром 11–30 мм в обоих легких, с четкими контурами, толстой стенкой, перифокально с паренхиматозными тяжами (рис. 1).
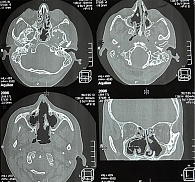
При проведении МСКТ придаточных пазух носа обнаружены плотные скопления в левой верхнечелюстной и решетчатой пазухах, дефекты медиальных стенок верхнечелюстных пазух, дефект хрящевой части носовой перегородки, деструкция средних, а также частично верхних и нижних носовых раковин, остеонекроз верхней челюсти справа (рис. 2). Рентгенография таза в прямой проекции позволила верифицировать двусторонний остеонекроз головок бедренных костей.
На консилиуме ревматологов с учетом тяжести состояния больного и высокой активности процесса принято решение о назначении ритуксимаба в дозе 1000 мг дважды с интервалом четыре недели, далее – каждые шесть месяцев. Из-за сохранения риска заражения коронавирусной инфекцией больному введен комбинированный препарат антител к коронавирусу (тиксагевимаб + цилгавимаб). Определена поддерживающая доза преднизолона – 7,5 мг/сут.
Через три месяца после первого курса ритуксимаба у пациента Л. наблюдалась выраженная клиническая (значительное уменьшение головной боли) и лабораторная положительная динамика. Уровень гемоглобина увеличился с 97 до 143 г/л, скорость оседания эритроцитов уменьшилась с 39 до 14 мм/ч, уровень С-реактивного белка – с 164,7 до 4,0 мг/л.
Согласно данным МСКТ пазух носа и органов грудной клетки, отмечена стабилизация процесса. МСКТ органов грудной клетки: картина участков пневмофиброза легких в проекции ранее существовавших полостей деструкции, ателектаз S3 левого легкого (рис. 3).
На данный момент времени пациенту установлен диагноз: гранулематоз с полиангиитом, умеренная активность, инфильтрация легких с множественными полостями деструкции с исходом в очаговый фиброз, эндоваскулярная эмболизация сосудов легких микроэмболами (от 13 июня 2022 г.), хронический правосторонний гнойный мезотимпанит, хронический атрофический ринит, деструкция медиальных стенок верхнечелюстных пазух, остеонекроз верхней челюсти справа, медиастинальная лимфаденопатия, миокардит, лихорадка, похудение, нефрит с мочевым синдромом (хроническая болезнь почек С1), АНЦА (антитела к протеиназе 3), остеонекроз головок бедренной кости с обеих сторон, вторичный остеоартрит тазобедренных суставов третьей стадии, функциональная недостаточность третьего функционального класса.
В представленном клиническом наблюдении на фоне терапии ритуксимабом было достигнуто выраженное улучшение клинико-лабораторной и рентгенологической картины ГПА при изначально неблагоприятном течении, полисистемном поражении, развитии массивной деструкции легких. Ряд исследователей сообщают о высокой частоте ремиссии (до 80%) при ГПА у пациентов с полостями распада, в том числе в случаях, рефрактерных к стандартной терапии [11, 12].
Хорошая переносимость терапии и отсутствие инфекционных осложнений позволили рекомендовать продолжить лечение у данного больного и стремиться к достижению низкой активности болезни или ремиссии.
Заключение
ГПА является наиболее распространенным АНЦА-ассоциированным васкулитом. Для него характерно поражение легких, почек, лор-органов, а также лихорадка, похудение и др.
Тактика лечения ГПА долгие годы включала использование высоких доз глюкокортикоидов, а также базисных противовоспалительных средств (циклофосфамида, метотрексата, азатиоприна и др.). В настоящее время применяются умеренные дозы глюкокортикоидов, а также анти-В-клеточная терапия (ритуксимаб).
M.V. Karnakova, PhD, A.N. Kalyagin, MD, PhD, Prof., O.V. Antipova, K.B. Vitvitskaya, E.E. Radnaeva
Irkutsk State Medical University
Irkutsk Municipal Clinical Hospital No. 1
Contact person: Aleksey N. Kalyagin, akalagin@mail.ru
Granulomatosis with polyangiitis is a disease from the group of ANCA-associated systemic vasculitis, the diagnosis of which has recently improved. This nosology is characterized by a severe progressive course, affecting most often the upper respiratory organs, lungs and kidneys, and dramatically reduces the quality and life expectancy of patients.In many patients, timely anti-B-lymphocyte therapy is highly effective and achieves stable remission. No less promising and anti-C5a therapy. The article presents a clinical case of granulomatosis with polyangiitis in a young patient with a polysystemic lesion, the development of lung destruction and rapid positive clinical and laboratory dynamics against the background of adequate pathogenetic therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


