Лечение ревматоидного артрита в период пандемии COVID-19
- Аннотация
- Статья
- Ссылки
- English
В статье представлены результаты дифференцированного изучения фармакологических методов лечения ревматоидного артрита, ассоциированных с неблагоприятным прогнозом COVID-19. Подчеркивается, что в эпоху COVID-19 при выборе тактики лечения пациентов с ревматоидным артритом необходимо серьезно оценивать соотношение риска и пользы противоревматических препаратов, в том числе ритуксимаба, учитывая его ассоциацию с тяжелыми исходами инфекции.
В статье представлены результаты дифференцированного изучения фармакологических методов лечения ревматоидного артрита, ассоциированных с неблагоприятным прогнозом COVID-19. Подчеркивается, что в эпоху COVID-19 при выборе тактики лечения пациентов с ревматоидным артритом необходимо серьезно оценивать соотношение риска и пользы противоревматических препаратов, в том числе ритуксимаба, учитывая его ассоциацию с тяжелыми исходами инфекции.

Введение
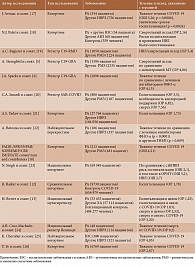
Доказано, что пациенты с иммуновоспалительными ревматическими заболеваниями (ИВРЗ), в том числе с ревматоидным артритом (РА), составляют группу высокого риска в отношении инфицирования SARS-CoV-2, тяжелого течения, включая развитие COVID-19-ассоциированного гипервоспалительного синдрома, обусловливающего необходимость госпитализации, в том числе в отделение реанимации и интенсивной терапии (ОРИТ), и смертельного исхода инфекции. Первичный анализ базы данных Глобального ревматологического альянса (COVID-19 Global Rheumatology Alliance – C19-GRA) показал, что в рамках мультивариантной модели ведущими факторами риска госпитализации больных ИВРЗ по поводу COVID-19 были возраст старше 65 лет (относительный риск (OР) 2,56 при 95%-ном доверительном интервале (ДИ) 1,62–4,04), артериальная гипертензия (АГ) или другие сердечно-сосудистые заболевания (ССЗ) (OР 1,86 (95% ДИ 1,23–2,81)), болезни легких (OР 2,48 (95% ДИ 1,55–3,98)), сахарный диабет (OР 2,61 (95% ДИ 1,39–4,88)), хроническая почечная недостаточность (ОР 3,02 (95% ДИ 1,21–7,54)) [1]. Однако наряду с указанными выше классическими факторами риска неблагоприятного прогноза тяжелое течение и смерть от COVID-19 у пациентов с РА связаны с активностью воспаления, а также применением иммуносупрессивной терапии, в первую очередь глюкокортикоидов (ГК), ритуксимаба и, вероятно, ингибиторов янус-киназ (JAK) (табл. 1) [1–15].
Согласно данным некоторых исследований, на старте пандемии риск госпитализации или неблагоприятного исхода у пациентов с РА на 75% превышал таковой у лиц без ревматического анамнеза [16]. Результаты наблюдательных исследований подтвердили необходимость дифференцированного изучения фармакологических методов лечения РА, ассоциированных с неблагоприятным прогнозом COVID-19.
Ритуксимаб
По мнению большинства исследователей, ритуксимаб (РТМ), широко применяемый для лечения РА, ассоциирован с неблагоприятным исходом COVID-19 (табл. 2) [5, 6, 10, 12, 13, 17–26].
В когортном исследовании, проведенном во Франции в начале пандемии J. Avouac и cоавт. [17], было обнаружено, что у получавших РТМ вероятность тяжелого течения COVID-19 в три раза превышала таковую у принимавших другие базисные противовоспалительные препараты (БПВП). В исследовании J.A. Sparks и соавт. с участием пациентов с РА показано, что при использовании РТМ шансы госпитализации повышались в пять раз, а частота таких неблагоприятных событий, как потребность в оксигенации/вентиляции или смерть, – в три раза по сравнению с получением ингибиторов ФНО-α [6]. Аналогичные данные получены и другими исследователями. Так, N. Singh и соавт. обнаружили, что у пациентов с РА использование РТМ привело к двукратному увеличению шанса госпитализации, пятикратному увеличению шанса госпитализации в отделение интенсивной терапии, трехкратному увеличению шанса проведения инвазивной вентиляции легких по сравнению с использованием стандартных БПВП (стБПВП) [23].
Связь между использованием моноклональных антител против CD20 (РТМ, окрелизумаб) и исходами COVID-19 была оценена в ходе метаанализа результатов 22 исследований. В частности, установлено существенное увеличение риска тяжелого течения (отношение шансов (ОШ) 2,95 (95% ДИ 2,30–3,78)) и смерти (ОШ 2,14 (95% ДИ 1,37–3,35)) среди пациентов с COVID-19, получавших моноклональные антитела против CD20. Дополнительный анализ, который был сосредоточен на исследованиях, включавших пациентов с верифицированным COVID-19, подтвердил повышенный риск, связанный с использованием моноклональных антител против CD20, – ОШ 2,61 (95% ДИ 1,92–3,56) и 1,90 (95% ДИ 1,08–3,35) соответственно. Эти результаты согласуются между различными подгруппами, включая пациентов с РА [27].
Повышенный риск тяжелого течения COVID-19 и смерти, связанный с применением моноклональных антител против CD20, можно объяснить потенциальным влиянием препаратов данной группы на иммунный ответ. Анти-CD20-терапия нацелена на В-клетки, которые отвечают за выработку антител, в том числе участвующих в нейтрализации вирусов, таких как SARS-CoV-2. При типичном иммунном ответе на инфекцию, вызванную SARS-CoV-2, В-клетки вырабатывают иммуноглобулины M и G, которые специфически нацелены на шиповидный белок вируса. Эти нейтрализующие антитела играют решающую роль в предотвращении проникновения вируса и заражения здоровых клеток, тем самым ограничивая тяжесть инфекции. Однако моноклональные антитела против CD20 истощают или подавляют В-клетки, что снижает выработку антител. В результате запуск необходимого иммунного ответа для нейтрализации репликации SARS-CoV-2 может быть нарушен, как следствие, организм не сможет эффективно бороться с вирусом [27].
Снижение эффективности нейтрализации вируса, вызванное терапией анти-CD20, также способно привести к длительной вирусной репликации и более высоким вирусным нагрузкам, что влечет за собой усугубление тяжести заболевания. Кроме того, отсутствие устойчивого ответа антител может задержать клиренс вируса и увеличить риск развития осложнений, таких как пневмония и острый респираторный дистресс-синдром (ОРДС), ассоциированные с необходимостью кислородной поддержки и проведения интенсивной терапии. Ослабление иммунного ответа на фоне анти-CD20-терапии также повышает восприимчивость к вторичным инфекциям. Сочетание нарушения выработки антител и длительного присутствия вируса может создать благоприятные условия для возникновения оппортунистических инфекций, что еще больше утяжелит клиническое течение и прогноз COVID-19.
Считается, что риск развития тяжелых осложнений COVID-19, ассоциированных с приемом РТМ, с течением времени может уменьшиться. Так, N. Singh и соавт. выявили, что у пациентов с РА, получивших РТМ более чем за 180 дней до заболевания COVID-19, показатели смертности были значительно ниже, чем у принимавших РТМ за 30 дней и менее до инфекции [23]. Тем не менее в период пандемии решение об инициации анти-В-клеточной терапии должно быть взвешенным. Индивидуальные решения о лечении, основанные на характеристиках пациента и тяжести заболевания, имеют решающее значение для обеспечения безопасности больного и достижения оптимальных результатов [27].
Другие генно-инженерные биологические препараты
Имеющиеся на сегодняшний день данные о влиянии других генно-инженерных биологических препаратов (ГИБП) на прогноз COVID-19 у больных РА разрозненны и требуют уточнения.
В исследовании Z. Izadi и соавт., включавшем 6077 пациентов с ИВРЗ, в том числе 2146 – с РА, монотерапия ингибиторами фактора некроза опухоли α (ФНО-α) ассоциировалась с более низкими шансами госпитализации или смертельного исхода по сравнению с другими методами лечения, включая применение ингибиторов ФНО-α в сочетании с БПВП, отдельное применение метотрексата (МТ) и ингибиторов JAK [15]. В исследовании M. Gianfrancesco и соавт., проведенном в начале пандемии, монотерапия ингибиторами ФНО-α была связана с более низкой вероятностью госпитализации (ОШ 0,40 (95% ДИ 0,19–0,81)) по сравнению с неполучением базисной противовоспалительной или иной генно-инженерной терапии [1]. Полученные результаты подкрепляют данные исследований гистологических образцов, полученных из лимфатических узлов от пациентов, умерших от COVID-19. Так, в указанных образцах было обнаружено большое содержание ФНО-α [28].
Таким образом, ингибиторы ФНО-α уменьшают выраженность проявлений системного воспалительного ответа при COVID-19, однако высокий риск инфекционных осложнений, свойственный этой группе противоревматических препаратов, препятствует их широкому применению для лечения SARS-CoV-2-инфекции.
Не утяжеляло течения COVID-19 и плановое применение ингибиторов рецепторов интерлейкина (ИЛ) 6 или абатацепта (АБЦ) [6]. Так, в ходе рандомизированных клинических исследований у пациентов с COVID-19 ингибитор рецептора ИЛ-6 тоцилизумаб значимо снижал смертность от всех причин (ОР 0,89 (95% ДИ 0,81–0,98); p = 0,03), потребность в искусственной вентиляции легких (ИВЛ) (ОР 0,80 (95% ДИ 0,71–0,90); p = 0,001), продолжительность стационарного лечения (p = 0,01) [29]. Абатацепт и инфликсимаб также ассоциировались с уменьшением реабилитационного периода и статистически значимо увеличивали выживаемость пациентов при COVID-19 (ОШ 0,62 (95% ДИ 0,41–0,94) и 0,9 (95% ДИ 0,39–0,90) соответственно) [30, 31].
Следовательно, ингибиторы ФНО-α, ингибиторы рецептора ИЛ-6 и АБЦ как относительно безопасные препараты в отношении риска развития тяжелых осложнений COVID-19 могут рассматриваться для рутинного лечения РА.
Ингибиторы янус-киназ
Данные о влиянии таргетных препаратов на течение COVID-19 у больных РА противоречивы. В исследовании J.A. Sparks и соавт. у пациентов с РА, систематически принимавших ингибиторы JAK, риск тяжелого течения COVID-19 (госпитализация/потребность в кислороде/смерть) оказался в два раза выше, чем у получавших ингибиторы ФНО-α [6]. Согласно данным H. Bower и соавт., ингибиторы JAK ассоциировались с более высоким риском госпитализации или смертельного исхода [13]. Однако эти результаты необходимо интерпретировать с учетом малого размера когорты участников исследования. В работе J.R. Curtis и соавт. достоверной связи между плановой терапией препаратом из группы ингибиторов JAK и потребностью в госпитализации не выявлено [32]. В крупном когортном исследовании RECOVERY показано, что 28-дневная смертность среди пациентов с COVID-19, впервые получавших барицитиниб наряду со стандартными методами лечения, была на 13% ниже, чем в контрольной группе [33].
Таким образом, в основе влияния планового лечения ингибиторами JAK на неблагоприятный исход COVID-19 может лежать ухудшение вирусного клиренса. В то же время применение препаратов данной группы у пациентов с гипервоспалением способно предотвратить развитие дыхательной недостаточности и других органных осложнений.
Синтетические базисные противовоспалительные препараты
Используемые для лечения РА базисные противовоспалительные препараты не утяжеляют течение COVID-19, за исключением сульфасалазина. Согласно результатам, полученным A. Strangfeld и соавт., в группе пациентов с РА сульфасалазин ассоциировался с более высоким шансом смерти от COVID-19 по сравнению с метотрексатом [5]. Такие результаты отчасти могут быть обусловлены преимущественным назначением сульфасалазина как препарата с низким иммуносупрессивным эффектом лицам с высоким риском заражения SARS-CoV-2. Однако данные регистра SECURE-IBD также показали повышенный риск тяжелого течения COVID-19 среди пациентов с воспалительными заболеваниями кишечника, получавших сульфасалазин, – скорректированное ОШ (сОШ) 3,1 (95% ДИ 1,3–7,7) против 0,9 (95% ДИ 0,4–2,2) для применявших ингибиторы ФНО-α [34]. Предположительно, сульфасалазин может подавлять выработку интерферона I плазмацитоидными дендритными клетками и таким образом уменьшать вирусный клиренс. Сообщения об увеличении риска возникновения опоясывающего герпеса у пациентов с РА, принимавших сульфасалазин, могут указывать на более широкое влияние препарата на иммунный ответ при вирусных инфекциях, чем это считалось ранее [35]. Другой БПВП, гидроксихлорохин, на ранних этапах пандемии позиционировался как потенциальный терапевтический агент у пациентов с COVID-19, однако в ходе исследований он не продемонстрировал необходимой клинической эффективности [5, 36]. В то же время иммуносупрессивное действие гидроксихлорохина у пациентов с РА менее выражено по сравнению с таковым других БПВП, поэтому он является препаратом выбора при необходимости минимизировать риск инфицирования.
В отношении других БПВП, таких как лефлуномид или азатиоприн (АЗА), получено небольшое количество данных, позволяющих сделать вывод об относительной безопасности этих препаратов. Поэтому существует необходимость дальнейших исследований в этом направлении.
Глюкокортикоиды
Несмотря на то что ГК включены в рекомендации по лечению COVID-19, их рутинное применение увеличивает риск развития тяжелых осложнений.
Данные исследования RECOVERY указывают на то, что применение дексаметазона в дозе 6 мг/сут в течение десяти дней у больных COVID-19 способствовало значимому снижению частоты смертей среди находящихся на ИВЛ – 29,3 и 41,4% (ОР 0,64 (95% ДИ 0,51–0,81)), а также количества нуждавшихся в кислородной поддержке – 23,3 и 26,2% (ОР 0,82 (95% ДИ 0,72–0,94)). Однако в группе пациентов, которым не требовалась оксигенация, различия в эффективности дексаметазона и обычного ухода не наблюдались [37]. Согласно данным регистра C19-GRA, включавшего 230 пациентов с РА, группа рутинного приема средних и высоких доз ГК (≥ 10 мг/сут) ассоциировалась с двукратным повышением риска госпитализации по сравнению с группой контроля. В этом же исследовании низкая доза ГК (1–9 мг/сут) не увеличивала риск госпитализации [1]. Метаанализ, включавший 44 исследования с участием 20 197 пациентов, подтвердил положительное действие ГК в отношении снижения 28-дневной смертности и потребности в ИВЛ. В то же время в отдельных работах отмечены задержка клиренса SARS-CoV-2 и нарастание числа случаев развития вторичных инфекций [38]. Первое могло быть обусловлено преждевременным назначением ГК в период активной вирусной репликации. Более того, применение ГК в фазу вирусной нагрузки, то есть в течение первых семи – десяти дней болезни, может усугубить последнюю с дальнейшим нарастанием интенсивности воспалительного ответа и выраженным ухудшением состояния. M. Matthay и соавт. установили, что ГК способны оказывать как отрицательное, так и положительное влияние на разных стадиях SARS-CoV-2-инфекции, поражения легких и ОРДС [39].
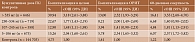
Подтверждением изложенному выше являются данные недавно опубликованного исследования S. Marozoff и соавт. В работе ученых была продемонстрирована значимая ассоциация тяжести течения COVID-19 с ГК, применявшимися в течение трех месяцев до инфицирования (табл. 3) [40].
Таким образом, для лечения РА в период пандемии особое значение приобретают обоснованность и оптимальное время назначения, а также применение минимальной эффективной дозы пероральных ГК.
Влияние COVID-19 на течение ревматоидного артрита
COVID-19 может ухудшать течение РА в силу ряда косвенных причин, в том числе из-за прекращения приема БПВП на время инфекционной фазы или развития постковидного синдрома [41, 42].
М. Di Iorio и соавт. провели анкетирование 174 пациентов с ревматическими заболеваниями, в том числе 69 – с РА [43]. Изменение привычного приема БПВП отметил 51% опрошенных. Этот показатель был меньше среди получавших РТМ (46%) и гидроксихлорохин (23%). У 41% наблюдалось обострение ревматического заболевания. О развитии постковидного синдрома сообщили 45% респондентов. Следует отметить, что пациентам этой группы чаще требовалась госпитализация по поводу COVID-19 (ОШ 3,5 (96% ДИ 1,3–9,9)) и у них наблюдалось большее количество симптомов (ОШ 1,4 на симптом (95% ДИ 1,2–1,6)).
С момента старта кампании по вакцинации накапливаются данные о роли вакцинального статуса у лиц с ревматическими заболеваниями. Так, N.J. Patel и соавт. установили, что в данной когорте предшествующая вакцинация снижала продолжительность инфекционной фазы COVID-19 и вероятность появления постковидного синдрома [44]. Аналогичные результаты были получены в общей популяции [45].
Более подробно вопросы влияния БПВП и ГИБП на иммуногенность вакцин против COVID-19 и обусловленной этим коррекции схем лечения на момент вакцинации рассмотрены в отдельной публикации данного номера журнала [46].
Выводы
В эпоху COVID-19 при выборе тактики лечения пациентов с РА необходимо скрупулезно оценивать соотношение риска и пользы противоревматических препаратов, в том числе РТМ, ассоциирующегося с тяжелыми исходами SARS-CoV-2-инфекции. Кроме того, важно изучить связь приема противоревматических препаратов и развития постковидного синдрома, влияния различных БПВП и ГИБП на исходы COVID-19 и т.д. Для решения этих задач необходимы новые исследования на крупных когортах пациентов с ревматическими заболеваниями.
Конфликт интересов
Исследование выполнено в рамках темы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7.
Исследование не имело спонсорской поддержки.
Конфликт интересов отсутствует.
E.S. Aronova, PhD, B.S. Belov, MD, PhD, G.I. Gridneva, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Boris S. Belov, belovbor@yandex.ru
Patients with immuno-inflammatory rheumatic diseases, including rheumatoid arthritis, are at high risk of SARS-CoV-2 infection, severe infection and mortality. Along with the classic risk factors for poor prognosis in patients with rheumatoid arthritis, severe COVID-19 and mortality are associated with the activity of inflammation, as well as immunosuppressive therapy.
The review presents the main results of a differentiated study of pharmacological treatments for rheumatoid arthritis associated with an unfavorable prognosis of COVID-19. It is emphasized that when choosing treatment tactics for patients with rheumatoid arthritis in the era of COVID-19, it is necessary to seriously evaluate the risk-benefit ratio when prescribing certain antirheumatic drugs, including rituximab, given its association with severe outcomes of SARS-CoV-2 viral infection.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.